Caratteristiche
Il virus della rosolia (Rubella virus, RuV) venne isolato per la prima volta nel 1962 da Parkman e Weller. Appartiene alla famiglia dei Matonaviridae (precedentemente Togaviridae) ed è l’unico membro del genere Rubivirus. Il virione ha una forma sferica (fig.1), con un diametro compreso tra 40 e 80 nm, l’envelope è strettamente associato al capside icosaedrico, composto da monomeri di proteina C, che racchiude al suo interno il genoma virale rappresentato da una molecola di RNA a polarità positiva di circa 9762 nucleotidi.
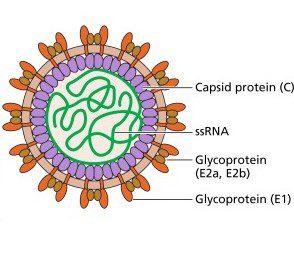
Due tipi di glicoproteine sono associate all’envelope: E1 (58 kDa) ed E2, E2a (47 kDa) e E2b (42 kDa). E1 funge da antirecettore virale essendo responsabile del riconoscimento e attacco del virione al recettore posto sulla membrana della cellula bersaglio. Possiede anche un’attività fusogena dipendente dalla presenza di ioni calcio. L’interazione tra E1 e Ca2+ ha luogo in un sito della glicoproteina compreso tra due regioni fusion loop (FL): FL1 dal residuo 88 al 93 e FL2 dal residuo 131 al 137. L’assenza di ioni Ca2+ inibisce l’attività di E1.
La glicoproteina E2 invece ha un ruolo nel garantire il corretto folding di E1. Il recettore ad oggi non è stato ben individuato anche se molte evidenze dimostrano che possa trattarsi della glicoproteina oligodendrocitaria associata alla mielina (MOG) senza escluderne potenziali altri. La MOG è espressa soprattutto nel sistema nervoso centrale come ad esempio nei processi degli oligodendrociti nell’uomo; nel timo e milza in topi e ratti. L’assenza però dell’espressione di questa glicoproteina nel tratto respiratorio dimostra che RuV si debba legare ad un altro tipo di recettore.
Il genoma (fig.2) come detto in precedenza è costituito da una molecola di RNA a polarità positiva, simile ad un RNA messaggero cellulare poiché presenta all’estremità 5’ un cappuccio di 7-metil guanosina e all’estremità 3’ una coda di poliA. Organizzato in due frammenti aperti di lettura (ORF), quello al 5’ codifica per le proteine non strutturali necessarie per la trascrizione e replicazione, la p150 con attività metil-/guanililtransferasica e la p90 che esibisce attività di replicasi e elicasi tipiche delle RNA polimerasi-RNA dipendenti. L’ORF al 3’ invece codifica per le proteine strutturali del capside (C) e per le glicoproteine dell’envelope E1 ed E2. Sono presenti inoltre 3 regioni non codificanti (UTRS): una di 40 nt all’estremità 5’, una posta tra i due ORF di 118 nt e una di 59 nt all’estremità 3’.

Filogenesi
| Dominio | Acytota |
| Gruppo | IV (+ssRNA) |
| Ordine | Non assegnato |
| Famiglia | Matonaviridae* |
| Genere | Rubivirus |
| Specie | Rubella virus (RuV) |
Patogenesi
L’uomo è l’unico ospite naturale e la sola riserva d’infezione per il virus della rosolia, del quale si conosce un unico sierotipo. Così come il morbillo e la scarlattina, anche questa patologia è esantematica, caratterizzata cioè dalla comparsa di un rash cutaneo maculo-papulare che procede dal capo agli arti (fig.3). Il periodo d’incubazione (tempo che intercorre tra l’ingresso del virus nell’organismo alla comparsa dei primi sintomi) è di circa 15-18 giorni.
L’ingresso del virus nell’organismo avviene attraverso il tratto respiratorio per mezzo di goccioline aerodiffuse (droplet) e replica a livello della mucosa del tratto respiratorio superiore ed in seguito nei linfonodi regionali, determinando un ingrossamento degli stessi (linfoadenopatia) che precede l’esantema in genere di 5-10 giorni. In seguito alla viremia, il virus diffonde e si replica in molti distretti. Può attraversare la placenta e la replicazione di RuV nei tessuti embrionali può essere causa di aborto spontaneo. Se l’infezione è contratta nelle prime 8-12 settimane di gestazione, il rischio di difetti alla nascita è molto alto.
La replicazione del virus interferisce con le mitosi e la normale crescita delle cellule determinando così una sindrome rubeolica congenita (SRC) le cui manifestazioni a carico del sistema nervoso (ritardo mentale, sordità, disturbi del comportamento), degli occhi (glaucoma, corioretinite), apparato cardiovascolare (stenosi aortica, stenosi valvolare polmonare, difetti del setto atriale e ventricolare) sono evidenti alla nascita, riscontrabili nel primo anno di età o durante l’infanzia. Seppur rare le complicanze dovute alla rosolia si osservano soprattutto negli adulti come l’artrite e la porpora trombocitopenica.

Metodi di identificazione
Poiché l’esantema può essere confuso con quello sostenuto da altri virus, la diagnosi è tipicamente indiretta sierologica con la ricerca di IgM specifiche la cui presenza indica infezione acuta o recente (fig.4). L’indagine viene svolta anche nel sospetto di sindrome rubeolica congenita, in quanto la persistenza del virus provoca nel feto la risposta anticorpale IgM-specifica a partire dalla 20° settimana di gestazione ed, il riscontro di IgM nel bambino indica inequivocabilmente infezione intrauterina. Gli anticorpi IgG persistono per tutta la vita, pertanto la loro positività indica vaccinazione o pregressa infezione. La ricerca dell’RNA genomico in diversi campioni clinici del neonato o in campioni di liquido amniotico o di villi coriali può essere effettuata con molta specificità tramite RT-PCR con sonde specifiche solitamente per il gene E1. L’immunità acquisita è permanente, ma sono possibili reinfezioni.

Terapia
Non esiste un trattamento per la rosolia ma è presente un vaccino vivo attenuato efficace e sicuro che negli anni ha contribuito notevolmente ad un decremento dei casi, soprattutto per quanto riguarda la rosolia congenita. Si tratta di un vaccino trivalente MPR (Morbillo, Parotite e Rosolia). In Italia la prima dose è somministrata a 12-15 mesi di età, la seconda a 5-6 anni. Negli adolescenti e adulti mai vaccinati sono previste due dosi a distanza di almeno 4 settimane.
Si ringrazia Diego Piacentini per il contributo
Fonti
- N. Lambert, P. Strebel et all., 2015, Rubella.
- Z. Zhu, M. Chen et all., 2016, Analysis of complete genomes of the rubella virus genotypes 1E and 2B which circulated in China 2000-2013.
- W. Dimech, L. Grangeot-Keros e C. Vauloup-Fellous, 2016, Standardization of assays that detect anti-rubella virus IgG.
- M. Dubé, F.A. Rey, M. Kielian, 2014, Rubella virus: first calcium-requiring viral fusion protein.
- G. Antonelli, M. Clementi, 2008, Virologia Medica.
- P.J. Walker, SG Siddell, E.J. Lefkowitz et all., 2019, Changes to virus taxonomy and the International Code of Virus Classification and Nomenclature ratified by the International Committee on Taxonomy of Viruses (2019).
- https://www.iss.it