Caratteristiche
L’HPV (Human Papilloma Virus) è un virus nudo (privo di pericapside), appartenente alla famiglia Papillomaviridae, caratterizzato da un capside icosaedrico dal diametro di circa 50-55 nm, formato da 72 capsomeri (Fig. 1), che racchiude un doppio filamento di DNA circolare di 8000 paia di basi (bp). Questo contiene otto geni codificanti per proteine aventi funzioni specifiche (Fig. 2).
Il tropismo dell’HPV è raffigurato dal tessuto epiteliale squamoso stratificato, che costituisce la cute e alcune mucose (orale, faringea, esofagea, rettale, vaginale).
Non si tratta di un virus singolo, bensì di una vasta famiglia che include più di 200 ceppi (o sierotipi) raggruppati in cinque generi, ovvero α (alfa), β (beta), γ (gamma), μ (my), ν (ny). Quelli responsabili di patologie negli esseri umani sono pressappoco sessanta, e tra questi abbiamo HPV 1, HPV 2, HPV 3, HPV 6, HPV 11, HPV 13, HPV 16, HPV 18, HPV 31, HPV 32, HPV 45 e HPV 46. I primi cinque generano soprattutto delle lesioni cutanee autolimitanti (verruche e condilomi), mentre gli altri sette sono oncogeni, ossia inducono la formazione di tumori benigni (papillomi e polipi) o maligni (carcinomi). HPV 16 rappresenta il sierotipo più oncogeno, ed è responsabile del 3-4% di tutte le neoplasie nel mondo.


Filogenesi
Dominio Monodnaviria
Regno Shotokuvirae
Phylum Cossaviricota
Classe Papovaviricetes
Ordine Zurhausenvirales
Famiglia Papillomaviridae
Replicazione
Il virus riesce ad addentrarsi negli epiteli squamosi stratificati attraverso delle microlesioni o abrasioni e penetra nelle cellule dello strato basale mediante l’interazione col recettore che esse esprimono, cioè l’integrina α2β4. Poiché l’HPV non possiede una sua DNA polimerasi DNA dipendente, per replicarsi deve dipendere dalla DNA polimerasi cellulare; per tale ragione infetta esclusivamente i cheratinociti dello strato più profondo (basali), che sono quelli distinti da una proliferazione più attiva.
Come accennato all’inizio, l’HPV esprime otto geni, i quali si dividono in precoci (E1, E2, E4, E5, E6, ed E7), che vengono espressi all’inizio del ciclo di replicazione, e tardivi (L1 e L2), la cui espressione avviene negli stadi più avanzati.
Il ciclo infettivo del virus (Fig. 3) inizia con l’entrata nelle cellule bersaglio mediante endocitosi mediata da recettore, seguita dalla perdita del capside in seguito all’acidificazione dell’endosoma, e al rilascio del genoma, che raggiunge il nucleo. In questa sede vengono sintetizzate le proteine E1 ed E2, le quali si legano all’origine della replicazione virale e reclutano la DNA polimerasi cellulare; la prima svolge un’attività elicasica (separa i due filamenti di DNA), mentre la seconda aiuta E1 nell’attivazione della trascrizione. C’è da rimarcare che queste due proteine stimolano la risposta del danno al DNA (DDR) e utilizzano il meccanismo della ricombinazione omologa (HR) per facilitare la replicazione. L’innesco della DDR comporta il reclutamento della deacetilasi SIRT1, che deacetila l’elicasi Werner (WRN), la quale interagisce con il DNA in fase di duplicazione. SIRT1 e WRN regolano i livelli di replicazione e promuovono la fedeltà della replicazione mediata da E1-E2. Per chiarire un concetto, la deacetilazione è un processo molecolare che consiste nella rimozione di gruppi acetilici, e che si verifica anche a livello del DNA, dove cambia l’espressione genica (epigenetica).
Durante il ciclo di replicazione il virus subisce uno “spostamento” verso la superficie del tessuto, dal momento che i cheratinociti basali si differenziano e migrano dagli strati più interni dell’epitelio verso quelli più esterni; in questo processo avviene l’espressione dei diversi geni virali. Negli strati basale e parabasale (o spinoso) si compiono rispettivamente la persistenza del genoma virale e la sua amplificazione, e in tali eventi entrano in gioco E1, E2, E6 ed E7. Le ultime due agiscono come degli oncogeni, poiché reprimono due proteine cellulari che fungono da oncosoppressori (controllori della divisione cellulare), ossia p53 e Rb. L’incremento dell’attività di E6 ed E7 rappresenta il fattore che contribuisce alla moltiplicazione cellulare, all’inibizione della differenziazione, all’instabilità cromosomica e alla conseguente tumorigenesi.
Negli strati intermedi intervengono E4 ed E5, la prima frantuma le citocheratine (filamenti intermedi del citoscheletro) allo scopo di consentire il rilascio dei nuovi virus, e stimola l’espressione di L1 e L2, mentre la seconda attiva il recettore del fattore di crescita dell’epidermide (EGFR) per favorire la moltiplicazione cellulare. L1 e L2 codificano per due proteine strutturali che costituiscono il capside virale; L1 è la proteina capsidica maggiore, L2 la proteina capsidica minore.
Nello strato granuloso, grazie all’espressione di L1 e L2, inizia l’assemblaggio e la maturazione dei nuovi virioni, che vengono liberati a livello dello strato corneo in seguito alla rottura delle cellule infette che si sfaldano. I virus neoformati possono infettare altri cheratinociti basali e il ciclo ricomincia.
Nelle infezioni benigne il genoma virale rimane sottoforma di DNA circolare extracromosomico (episomale), mentre in quelle maligne si integra nel genoma cellulare.

Patogenesi
L’HPV colpisce sia i maschi che le femmine, si diffonde da un individuo all’altro attraverso un contatto cute-cute, cute-mucose e mucosa-mucosa (per questo motivo raffigura il virus a trasmissione sessuale più diffuso), mediante trasmissione verticale da madre a feto (in tal caso nel bambino può insorgere la papillomatosi respiratoria ricorrente) e tramite il contatto con oggetti contaminati. I determinanti che incrementano la possibilità di contagio sono l’elevato numero di partner sessuali, la giovane età al momento del primo rapporto sessuale, la presenza di altre malattie sessualmente trasmissibili.
L’infezione è facilitata dalla presenza di piccole lesioni e, nella maggioranza degli episodi, è transitoria e non provoca alcun danno o malattia, in quanto il sistema immunitario riesce a eliminare il virus; inoltre, nel 60-90% dei casi l’infezione si risolve spontaneamente nel giro di uno o due anni. Tuttavia, ci sono situazioni in cui il contagio ha delle conseguenze. Nel caso in cui si viene a contatto con ceppi a basso rischio (HPV 1, 2, 6, 11, 13, 32), possono comparire delle proliferazioni benigne autolimitanti (escrescenze) a livello cutaneo, ossia le verruche e i condilomi, o tumori benigni delle mucose, cioè papillomi e polipi.
Le verruche e i condilomi sono caratterizzati da iperplasia delle cellule dello strato spinoso e da ipercheratosi (eccesso di cheratina). Le verruche si formano in particolare sulle mani, sulle piante dei piedi, sul viso e sul contorno ungueale, raramente possono manifestarsi anche nella mucosa orale; possono essere nodulari, filiformi o piane (Fig. 4). I condilomi rappresentano una tipologia di verruche che colpisce le zone genitali (prepuzio, corpo del pene e scroto negli uomini; vulva, vagina, perineo e cervice uterina nelle donne) e la sede perianale, e possono apparire grandi, piccole, piatte, in rilievo o a grappolo (Fig. 5).


Per quanto concerne i papillomi e i polipi, i primi si formano nella cavità orale, nella faringe e nella laringe, e sono distinti da un aspetto papillare e rugoso, con una serie di villi cilindrici o filiformi (Fig. 6), mentre i polipi si collocano nella mucosa rettale e possono presentare due diversi aspetti morfologici: peduncolati, cioè con l’estremità libera globosa e rotondeggiante, legata alla mucosa mediante un peduncolo più o meno esile, e sessili, ovvero direttamente attaccati alla mucosa (Fig. 7). Se non vengono asportati, a lungo andare questi due tumori si trasformano in carcinomi.
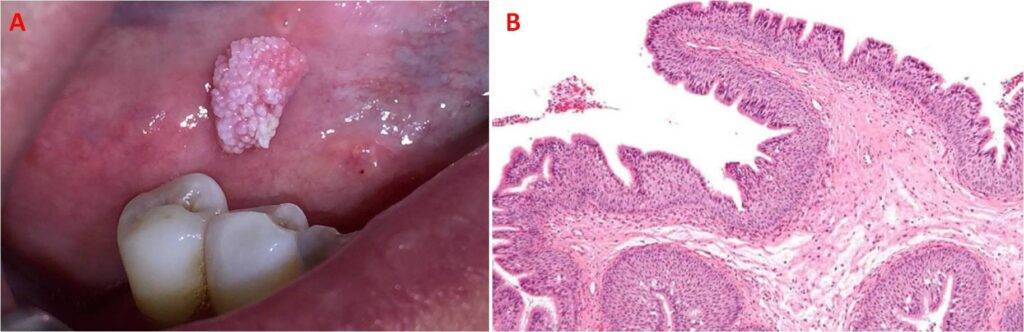

Le quattro tipologie di lesioni descritte possono essere asintomatiche, oppure provocare sintomi come prurito, dolore lieve o sensazione di fastidio. La condizione è differente per i papillomi laringei, che determinano disfonia con raucedine (cambiamento anomalo della voce che diventa stridula e aspra oppure bassa e cavernosa), dispnea e tosse cronica.
Passando ai ceppi ad alto rischio (HPV 16, 18, 32, 45 e 46), essi sono responsabili della genesi di tumori maligni, e tra questi abbiamo i carcinomi dell’ano, della vulva, della vagina, della cervice uterina, del pene, della cavità orale e dell’orofaringe. Bisogna sottolineare che il virus è necessario ma da solo non è sufficiente per promuovere l’oncogenesi; il potenziale maligno si svolge grazie all’associazione con altri agenti, che però non sono ancora stati identificati con esattezza. Tra i più probabili abbiamo i fattori ormonali, chimici (fumo di tabacco, benzopirene) e infettivi (herpes simplex virus 2).
Il carcinoma della cervice uterina colpisce 2.300 donne all’anno in Italia, è il quarto tumore più frequente nelle donne ed è maggiormente diffuso in giovane età. Nei paesi più sviluppati i programmi di prevenzione e screening hanno permesso una riduzione dei casi di decesso, mentre nei Paesi del Terzo Mondo il numero delle vittime è ancora elevato.
Il carcinoma penieno raffigura una condizione inconsueta che riguarda tra 0,1 e 1,5 uomini su 100.000 negli stati occidentali, 3,7 su 100.000 nei paesi in via di sviluppo, ed è correlato a una igiene intima inadeguata, a una riduzione dell’orifizio prepuziale, a condizioni infiammatorie croniche e al fumo di sigaretta. I sintomi possono essere variazione dello spessore e del colore della cute in alcune zone, placche biancastre o rossastre, piccole ulcerazioni o noduli. Tuttavia, tali sintomi non sono specifici di questa neoplasia.
Per quanto riguarda i carcinomi della cavità orale e dell’orofaringe, secondo il Registro Nazionale dei Tumori (AIRTUM), quelli associati all’HPV raffigurano rispettivamente il 10% e il 31% di tutti i tumori localizzati in queste due sedi; tra i fattori di rischio del carcinoma orofaringeo, rientrano il sesso orale con un cospicuo numero di partner differenti e l’abitudine al fumo. Le manifestazioni cliniche possono essere mal di gola, disfagia, odinofagia (dolore o bruciore quando si deglutisce), otalgia (dolore intenso, bruciante o sordo alle orecchie) e difficoltà di articolazione.
Per concludere questo paragrafo, citiamo la correlazione tra HPV e fertilità maschile; questo virus, come altri agenti patogeni sessualmente trasmissibili (Chlmydia trachomatis, Neisseria gonorrheae), può raffigurare un fattore che determina la riduzione della fertilità negli uomini. Se presente nel liquido seminale, l’HPV può aderire agli spermatozoi e alterarne la motilità fino a impedire il completamento della fecondazione dell’ovocita.
Metodi di identificazione
Rispetto a gran parte delle infezioni virali, la diagnosi di infezione da HPV non prevede il dosaggio di anticorpi nel siero. Le tecniche di laboratorio impiegate per la ricerca di questo virus sono le seguenti:
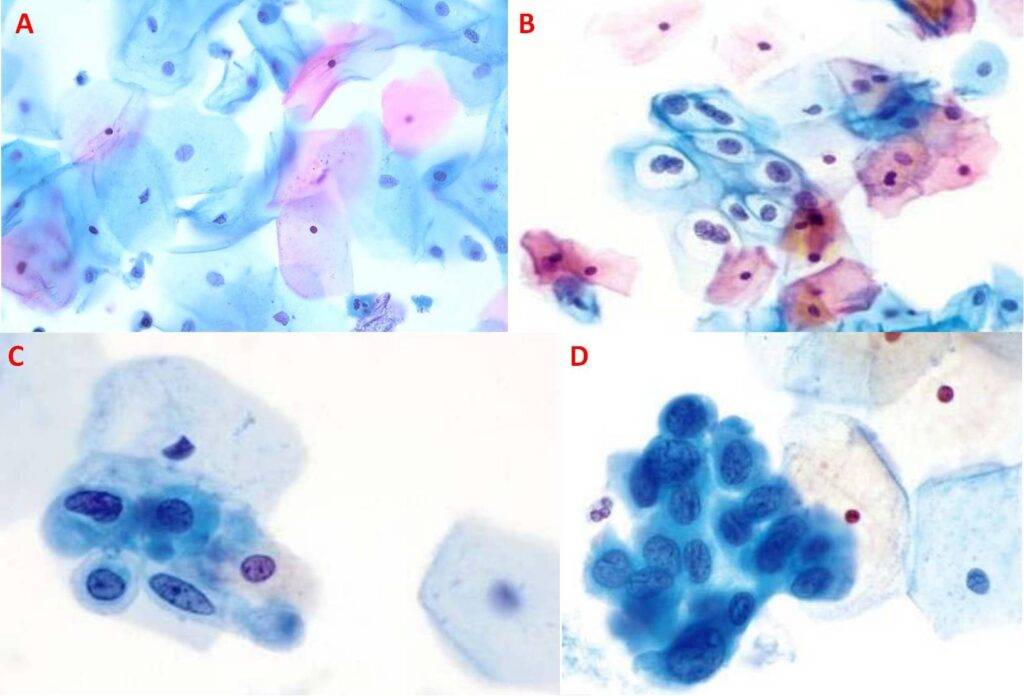
- Pap test (o test di Papanicolaou), che è specifico per le donne ed è utile per diagnosticare precocemente un’infezione che potenzialmente può condurre al carcinoma della cervice uterina, ragion per cui viene impiegato nei programmi di screening. Il test, poco invasivo e semplice, consiste nel prelevare con una spatola le cellule di sfaldamento della cervice; in seguito queste vengono strisciate su un vetrino, fissate, colorate con la colorazione di Papanicolaou e osservate al microscopio ottico. L’esame microscopico permette di rilevare cellule epiteliali normali (quelle più superficiali hanno un nucleo piccolo e sono colorate di rosa/arancio, mentre quelle più profonde sono verdastre/bluastre e hanno un nucleo più grande) (Fig. 8A), coilociti (cheratinociti infettati dall’HPV che appaiono ingrossati, col nucleo allargato e circondato da un alone bianco. A volte possono esserci due nuclei) (Fig. 8B) e cellule displastiche/tumorali (con alterazioni della forma, il nucleo ingrossato e ipercromico, la membrana nucleare irregolare, il rapporto nucleo-citoplasma aumentato) (Fig. 8C e D). Nel caso in cui il Pap test risulti positivo, si procede con la colposcopia, che consiste nell’uso di uno strumento chiamato colposcopio, attraverso cui il medico esamina la zona interessata con un binocolo;
- Immunoistochimica, che si basa sull’utilizzo di anticorpi marcati con un enzima che si legano agli antigeni specifici del virus presenti nei campioni di tessuto o di cellule prelevati per l’analisi. L’aggiunta del substrato e della sostanza cromogena porteranno alla generazione di un precipitato colorato che indicherà la presenza delle proteine virali e/o di proteine coinvolte nella proliferazione cellulare. Il risultato si analizza al microscopio ottico;

- Ricerca del DNA virale, che prevede l’estrazione del DNA da un campione (biopsia, cellule, tampone), per poi fare l’amplificazione mediante PCR (reazione a catena della DNA polimerasi). Attraverso questo test è possibile identificare il ceppo virale;
- Ibridazione in situ, che consente di individuare il genoma virale nel tessuto attraverso l’ibridazione con specifiche sonde di DNA (marcate con una molecola fluorescente o con un enzima) che riconoscono le sequenze genetiche del virus. Il tessuto viene esposto a un enzima (proteinasi), allo scopo di rendere accessibile il DNA, poi si applica la sonda e il preparato si guarda al microscopio ottico semplice o al microscopio a fluorescenza (Fig. 10);

- Southern blot, un altro metodo basato sull’ibridazione sonda-DNA, che consta di questi passaggi: amplificazione del DNA, trattamento con enzimi di restrizione per frammentarlo, separazione dei frammenti mediante elettroforesi su gel, trasferimento dei frammenti su un filtro di nitrocellulosa, applicazione di sonde marcate e rivelazione.
Oltre alle analisi di laboratorio, nella diagnosi di infezione da HPV rientrano anche gli esami obiettivi, che hanno lo scopo di ricercare e ravvisare lesioni come verruche, condilomi, tumori perianali, papillomi e carcinomi della mucosa orale.
Per i polipi e i carcinomi all’interno della mucosa ano-rettale, si ricorre all’anoscopia, cioè un esame in cui il medico proctologo infila nell’ano un cilindro di plastica trasparente, l’anoscopio. Per i papillomi e i carcinomi faringei e laringei, l’esame indicato è la laringoscopia, che consiste nell’introduzione di una sonda a illuminazione propria (laringoscopio) in gola attraverso la cavità nasale o appoggiato alla lingua. Gli eventuali carcinomi scorti vengono confermati dall’esame istologico e studiati tramite tomografia computerizzata.
Un test specifico per gli uomini è la peniscopia, che è efficace per lo screening delle lesioni genitali e si effettua mediante un colposcopio, al fine di valutare la presenza di anomalie cellulari sulla superficie esterna del pene. Se le lesioni presentano un aspetto anomalo, quindi c’è un sospetto di neoplasia, devono essere confermate mediante biopsia ed esame istologico.
Terapia e profilassi
Le verruche e i condilomi di solito si risolvono da soli nel giro di alcuni anni, ma nel caso in cui tali lesioni diano fastidio o creino irritazione e/o dolore, è possibile utilizzare farmaci specifici, come ad esempio le creme che si applicano sulle lesioni; tra queste cui abbiamo l’Imiquimod, ad azione immunomodulatrice, il 5-fluoro-uracile e la podofillotossina (Condyline, Wartec). Il primo è indicato sia per le verruche che per i condilomi, gli altri due solo per i condilomi acuminati. Altri farmaci sono quelli a base di interferone alfa 2-a (Pegasys, Introna), che si iniettano direttamente nelle lesioni.
Ci sono alcune circostanze (lesioni estese, condilomi anali) che richiedono metodiche specialistiche, tra cui l’applicazione di acido tricloroacetico, la crioterapia con azoto liquido, l’elettrofolgorazione e il laser ad anidride carbonica.
Per quanto concerne i polipi, i papillomi e i carcinomi, il trattamento consiste nella rimozione chirurgica.
Passando alla prevenzione, esistono tre vaccini contro l’HPV, cioè il bivalente, il quadrivalente e il nonavalente; quest’ultimo (Gardasil-9) è il più efficace, dal momento che protegge verso nove ceppi del virus (HPV 6, 11, 16, 18, 31, 33, 45, 52 e 58), quindi previene sia le verruche e i condilomi che i tumori. Il bivalente protegge solo da HPV-16 e 18, il quadrivalente dai sierotipi 16, 18, 6 e 11.
Il Gardasil-9 prevede la somministrazione di tre dosi a cinque o tredici mesi di distanza l’una dall’altra, e contiene le proteine L1 purificate, prodotte mediante la tecnologia del DNA ricombinante. Queste non provocano la malattia, bensì stimolano il sistema immunitario a produrre anticorpi contro il virus. La vaccinazione è raccomandata in età adolescenziale, prima dell’inizio dell’attività sessuale, ma anche se la somministrazione del vaccino avviene quando si ha già avuto rapporti sessuali, la protezione è comunque garantita. Considerando che il numero di ceppi di HPV è notevolmente maggiore rispetto a quelli su cui agisce il vaccino, non bisogna abbandonare il sesso sicuro; l’uso del preservativo e il numero ridotto di di partner sessuali abbassano la probabilità di contagio.
Fonti
- Martina Murdolo. 2012. “Medicina di laboratorio”, Universitalia
- Dipon Das, Molly L. Bristol, Nathan W. Smith, Claire D. James, Xu Wang, Pietro Pichierri, Iain M. Morgan. 2019. “Werner Helicase Control of Human Papillomavirus 16 E1-E2 DNA Replication Is Regulated by SIRT1 Deacetylation”, American Society for Microbiology
- Sheila V. Graham. 2017. “The human papillomavirus replication cycle, and its links to cancer progression: a comprehensive review”, Clinical Science
- José Veríssimo Fernandes and Thales Allyrio Araújo de Medeiros Fernandes. 2012. “Human Papillomavirus: Biology and Pathogenesis”, Human Papillomavirus and Related Diseases
- Jesse M. Young, Amira Zine El Abidine, Ricardo A. Gómez-Martinez and Michelle A. Ozbun. 2019. “The Known and Potential Intersections of Rab-GTPases in Human Papillomavirus Infections”, Frontiers in Cell and Developmental Biology
- Stefan Duensing, Anette Duensing, Elsa R. Flores, Anh Do, Paul F. Lambert And Karl Münger. 2001. “Centrosome Abnormalities and Genomic Instability by Episomal Expression of Human Papillomavirus Type 16 in Raft Cultures of Human Keratinocytes”, Journal Of Virology
- http://math.unife.it/lm.biomolecolare/insegnamenti/virologia/materiale-didattico/16-dna-n-papillomavirus.pdf
- https://www.lacooltura.com/2018/12/papilloma-virus-struttura-trasmissione-rischi-e-prevenzione/
- https://www.poliambulatoriopcm.it/wiki/ginecologia/vaccino-papillomavirus-umano/
- https://www.airc.it/news/hpv-e-cancro-un-problema-non-solo-femminile
- https://www.auxologico.it/malattia/hpv-papilloma-virus
- https://www.hsr.it/news/2021/luglio/papilloma-virus-in-cosa-consiste-come-curare
- https://www.epicentro.iss.it/hpv/
- https://healthy.thewom.it/salute/hpv/
- https://medicinaonline.co/2019/02/15/differenza-tra-condilomi-verruche-genitali-e-papule-perlacee/
- https://www.dermatologo-torino.it/condilomi-lesioni-verrucose-da-hpv-human-papilloma-virus/
- https://medicinaonline.co/2019/02/15/differenza-tra-condilomi-ed-emorroidi/
- https://www.cpo.it/workspace/files/ghiringhello-colposcopisti-201-534cfd7029b64.pdf
- https://www.msdmanuals.com/it-it/professionale/disturbi-dermatologici/infezioni-virali-cutanee/verruche
- https://www.airc.it/cancro/informazioni-tumori/guida-ai-tumori/tumore-del-pene#:~:text=Il%20tumore%20del%20pene%20pi%C3%B9,altri%20tumori%20ancora%20pi%C3%B9%20rari
- https://www.biolabanalisi.it/esame-del-liquido-seminale/#:~:text=L’HPV%20%C3%A8%20uno%20degli,la%20fecondazione%20di%20un%20ovocita.
- https://www.studioroghi.it/tag/hpv-papilloma-orale-laser-biospia-escissione/#iLightbox/0
- https://www.studiodentisticocozzolino.it/patologia-orale/#hpv
- https://www.endoscopiadigestiva.it/endoscopia_digestiva/polipi-del-colon/
- https://www.airc.it/cancro/affronta-la-malattia/guida-agli-esami/colposcopia
- https://www.clinicacastelli.it/visite-esami/anoscopia/
- https://www.ihy-ihealthyou.com/esame/peniscopia
- https://www.msdmanuals.com/it-it/professionale/disturbi-di-orecchio,-naso-e-gola/tumori-della-testa-e-del-collo/carcinoma-squamocellulare-orofaringeo
- https://www.mypathologyreport.ca/it/pap-test/
- https://www.sbt.ti.ch/dep/cplo/dianamueller.pdf
- https://www.gisci.it/documenti/convegni/laquila2012/20120621/venditti_gisci_20120621.pdf
- https://www.my-personaltrainer.it/farmaci-malattie/farmaci-condilomi-acuminati.html
- https://www.ema.europa.eu/en/documents/overview/gardasil-9-epar-summary-public_it.pdf
- https://drfrancescoferrara.it/condilomi-anali-prevenirli-riconoscerli-e-curarli/











1 commento su “Papillomavirus (HPV)”