Spesso la vera forza degli avversari è la nostra debolezza: l’assenza di una risposta o di una sponda adeguata in difesa dei nostri confini cellulari è la “non-mossa” che ci fa scacco matto. Se i linfociti T, per esempio, fossero insufficienti, pericolosissimi virus oncogeni, come il Papillomavirus, potrebbero trasformare cellule sane in cloni mutati.
Papillomavirus e Poliomavirus
Originariamente racchiusi nella stessa famiglia definita dei Papovavirus, i Papillomavirus ed i Poliomavirus sono gruppi virali caratterizzati da doppio filamento di DNA e potenziale oncogenicità.
I Papillomavirus devono il proprio nome alle manifestazioni cutanee che sono in grado di procurare all’organismo infettato: l’infezione su pelle e mucose si esprime, infatti, con verruche o papillomi. I papillomi sono, proprio, escrescenze papulose pruriginose o asintomatiche, ma sempre altamente infettive. I Poliomavirus, invece, sono stati così denominati per la capacità di produrre molti- (“poli”, in greco) -tumori benigni (“oma” desinenza medica per le neoplasie benigne). In entrambi, caratteristiche ben note sono le ridotte dimensioni e la presenza di geni precoci e tardivi, nel corredo genetico. Questi due tipi di geni garantiscono, ai virus oncogeni, la tipica persistenza nel corpo dell’ospite. Si succedono, infatti, fasi di latenza e fasi conclamate con disturbi lievi o, addiritura, con comparsa di forme tumorali.
Cancro infettivo: un incubo per entrambi i sessi
Secondo dati dell’AIRC, in Italia, più dell’8% di tutte le forme tumorali registrate sono causate da infezioni virali. Il Papillomavirus umano (HPV), in particolare, è l’agente eziologico nel 20% dei 31000 casi di oncogenesi virale.
Ma l’HPV non è un unico ceppo virale: si contano, infatti, più di 120 sierotipi. Alcuni di questi, detti commensali, sono di scarsa pericolosità; altri ceppi, invece, si dimostrano decisamente più temibili. I ceppi virali commensali di HPV (HPV6 ed HPV11), causano prevalentemente insorgenza di verruche, condilomi e papillomi. I sierotipi oncogeni (HPV16 ed HPV18), invece, provocano la maggior parte dei tumori della cervice uterina, e non solo. La trasmissione prevalente è di natura sessuale, ma esiste anche quella per contatto fisico differente: servono, per questa via, lacerazioni cutanee e contemporanea presenza di unità virali molto attive.
I virus, di fatto, si replicano sfruttando le cellule della pelle e delle mucose, di cui promuovono, poi, una crescita abnorme (iperplasia). Le escrescenze papillari che ne derivano sono, inoltre, rivestite di uno strato di cheratina.
L’infezione a livello genitale riguarda notoriamente le donne, ma, naturalmente, percorrendo vie sessuali, proviene da contatto con uomini che ne sono infetti (spesso asintomatici). Tuttavia, la pericolosità dei ceppi HPV oncogeni minaccia in egual misura cervice uterina, vagina, pene, glande e scroto. Senza neppure dimenticare altre lesioni ad evoluzione maligna, a livello delle alte vie respiratorie: laringe, faringe, lingua, palato, tonsille e naso.
Carcinoma a cellule squamose uterine da Papillomavirus
Secondo la definizione data da Majno “un tumore è una massa afinalistica, atipica, autonoma e aggressiva“. Si tratta, dunque, di un ammasso di cellule atipiche, la cui crescita esponenziale e priva di controllo centrale non ha alcuna funzione per l’ospite. Sia l’architettura istologica, però, sia le singole cellule presentano anomalie strutturali e funzionali. Una crescita così frenetica, inoltre, finisce per aggredire il tessuto sano circostante, di fatto invadendolo.
Sul concetto di autonomia delle cellule mutate, che creano il primo clone tumorale (da cui deriveranno miriadi di cellule trasformate identiche), tuttavia, non si può affermare una totale indipendenza dal contesto. Persino cellule così aggressive hanno bisogno di nutrimento, supporto vascolare e sostegno ormonale per evolvere di fase in fase (Fig. 1)
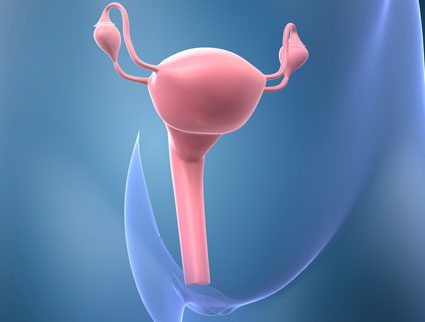
L’utero femminile è una struttura allungata (Fig. 2), idealmente suddivisa in due porzioni: una parte superiore detta corpo ed una inferiore detta collo (o cervice). Il collo dell’utero è in diretta continuità con la vagina che apre l’organo all’esterno per la fecondazione. La regione del collo rivolta verso il corpo dell’utero si definisce endocervice ed è rivestita da cellule ghiandolari. La regione più prossima alla vagina, invece, è nota come ectocervice ed è tappezzata di cellule epiteliali squamose. I virus oncogeni tendono ad approfittare proprio di quest’ultimo tipo di cellula epiteliale, più facile da raggiungere dal canale vaginale, per infettarla ed abitarla.
Linfociti T e Papillomavirus: lo studio che assegna nuovi ruoli ai “cattivi”
Posto che il Papillomavirus umano (β-HPV) si riscontra, di solito, nell’80% del carcinoma a cellule squamose della cervice uterina, la comunità scientifica concorda sulla responsabilità virale nel cancro cutaneo. Eppure, nonostante il rischio elevato duvuto al β-HPV, gli studi attuali non si sono concentrati molto sulla precisa identificazione della tipologia virale prevalente, in queste forme neoplastiche cutanee. Sarà perchè il genoma di β-HPV viene raramente integrato nel DNA delle cellule infettate oppure perchè esso risulta trascrizionalmente non attivo nelle cellule infettate.
Fatto sta che risultati come quelli fino adesso raggiunti hanno fatto pensare ad un coinvolgimento oncogenico virale del genere “toccata e fuga”. Martin Hufbauer e Baki Akgül ipotizzarono, infatti, che β-HPV fosse in grado solo di determinare l’inizializzazione mutagena del processo di oncogenesi cellulare, finalizzato poi dai raggi ultravioletti (Fig. 3). Secondo questo schema, dunque, il Papillomavius sembrerebbe scomparire nelle fasi successive di proliferazione tumorale.

Fig. 3 – Fasi di trasformazione neoplastica. Fonte: MDPI and ACS Style
Alla scoperta delle capacità oncogene di β-HPV
Per indagare finalmente a fondo il ruolo del Papillomavirus nella cancerogenesi della pelle, John D. Strickley e colleghi hanno selezionato un ceppo murino (C57BL/6J), sottoponendolo a retro-infezione con un virus murino di HBV, detto MmuPV-1. Tale ceppo virale produce lesioni cutanee (verruche convergenti) in topi immunosoppressi (CD8a), ma nessuna manifestazione, invece, negli esemplari immunocompetenti originali (wild-type). Alcuni esemplari murini hanno subìto inoculo virale, mentre altri solo un inoculo vuoto. Due mesi dopo, i due gruppi murini sono stati sottoposti a protocollo di cancerogenesi chimica per 30 settimane. Sorprendentemente, i topi infettati con MmuPV-1 hanno manifestato un notevole ritardo nello sviluppo di tumori cutanei, sia nell’immediato che a lungo termine, rispetto a quelli inoculati a vuoto.
Tra Linfociti T e comensali virali “litiganti“, l’ospite gode di immunità insperata
I ricercatori, a questo punto, hanno vagliato l’ipotesi che il ruolo dei linfociti T sia predominante nella benefica manifestazione del ceppo virale MmuPV-1. Così, linfociti T di memomia (Fig. 4), provenienti da topi immunizzati al virus, sono stati trasferiti in topi immunosoppressi (CD8a). In questi esemplari, vulnerabili alle verruche, il trasferimento di cellule T ha garantito minori lesioni cutanee da virus. I linfociti T di memoria hanno, inoltre, fornito immunità da verruche in esemplari murini originari (wild-type) in cui ve ne erano in gran numero e persistenti. Tali esemplari, inoltre, sottoposti a cancerogeni chimici (DMBA e TPA) per 20 settimane, hanno superato l’insulto chimico prolungato, in uno stato di elevata protezione dal cancro cutaneo.
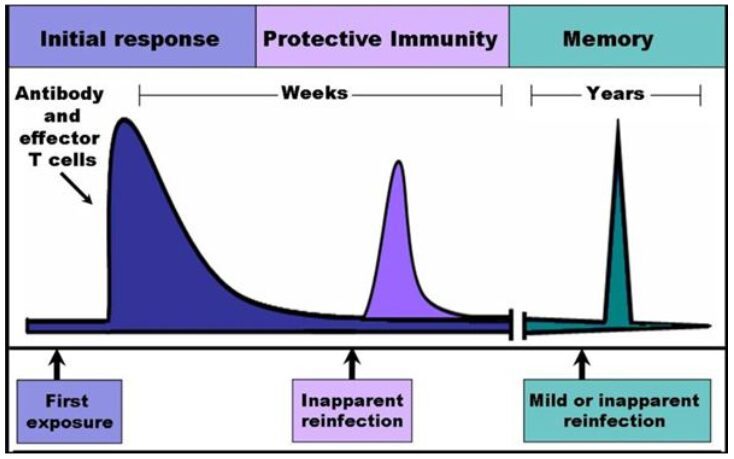
Figura 4 – L’esposizione multipla ad agenti esogeni costruisce una vera e propria memoria immunitaria.
Infine, anche topi dotati di immunità acquisita mediante inoculo di linfociti T di memoria hanno manifestato protezione da cancerogenesi chimica. Tali linfociti T provenienti da topi immuni al virus MmuPV-1 hanno, però, dimostrato una competenza esclusiva per le fasi iniziali del processo mutageno. Queste cellule immunitarie, infatti, non sono in grado di proteggere i mutanti cellulari nelle fasi successive ed avanzate di crescita del carcinoma squamoso.
A completamento ultimo dello studio, poi, i ricercatori hanno rilevato DNA virale MmuPV-1 nelle cellule cutanee normali. Anticorpi anti-MmuPV-1 sono comparsi, invece, nel sangue di topi infettati con il virus. Nonostante, dunque, non vi fossero cambiamenti nei livelli generali dei linfociti T, le cellule dell’epidermide colonizzate da MmuPV-1 hanno incrementato la percentuale delle proprie cellule T di memoria residenti tissutali, sul totale delle cellule immunitarie della pelle.
I linfociti T CD8+ hanno risposto a molte domande
I ricercatori hanno osservato che topi con immunità acquisita hanno sviluppato molti meno casi tumorali rispetto ad esemplari non infettati. Inoltre, i dati raccolti hanno fatto registrare, nelle cellule cutanee tumorali di topi infettati con MmuPV-1, un notevole incremento del numero totale di linfociti T, ed in particolare di cellule CD8+.
Le cellule immunitarie CD8+ sono anche note come linfociti T suppressor, in quanto agiscono eliminando direttamente virus, batteri o antigeni estranei all’organismo. Uccidono, dunque, le cellule infettate con azione citotossica. Le cellule CD8+ possono, inoltre, produrre soppressione della risposta immunitaria, al contrario dei linfotici T helper (CD4) che, di fatto, la stimolano.
Per determinare il ruolo dei linfociti T CD8+, nel mediare immunità anti-tumorale, indotta dalla colonizzazione del Papillomavirus murino, i ricercatori hanno suddiviso ceppi murini immunocompetenti (SKH-1) in due gruppi. Un gruppo ha subìto inoculo con il virus (MmuPV-1) , mentre l’altro ha ricevuto solo un inoculo di particelle virali (Sham(VLP)). Entrambi i gruppi di roditori, a causa di anticorpi anti-CD8 e del protocollo di cancerogenesi con raggi UV, hanno mostrato riduzione dei linfociti T CD8+. Eppure, topi infettati con MmuPV-1, anche se mancanti di capacità riparative di mutazioni indotte dai raggi UV sul DNA, sono risultati protetti dal cancro cutaneo, rispetto al gruppo inoculato con solo particelle virali (Sham(VLP).
Linfociti T umani e Papillomavirus
Per determinare, poi, se il ceppo di Papillomavirus umano (β-HPV) giochi un ruolo ugualmente protettivo sulla nostra pelle, i ricercatori hanno applicato tecniche biomolecolari di ibridazione in situ con sonde ad RNA ed a DNA.
L’obiettivo era rintracciare eventuali prodotti di trascrizione, come i peptidi E6 ed E7, di 25 tipi virali di commensali del β-HPV, nei tessuti umani. Contrariamente a quanto riscontrato nelle lesioni cutanee dei soggetti immunosoppressi, nelle cellule cancerose di carcinoma squamoso, in soggetti immunocompetenti, i ricercatori hanno potuto registrare solo un’ampia assenza di trascritti di RNA da β-HPV. Addirittura, l’espressione ribonucleica di β-HPV era inferiore a quella presente in cheratinociti normali di zone di tessuto adiacente alle cellule cancerose. Questo, però, solo in pazienti immunocompetenti. Invece, le lesioni cutanee dei pazienti immunsoppressi hanno mostrato una gran quantità di trascritti di RNA da β-HPV.
Sonde di ibridazione in situ di DNA degli stessi 25 sierotipi commensali di β-HPV hanno mostrato una carica virale alta nel carcinoma a cellule squamose di pazienti immunosoppressi, rispetto a cellule cancerose di pazienti immunocompetenti. Questa carica virale così elevata è risultata correlata a riduzione dei linfociti T CD8+. Inoltre, scoperta cruciale è stata quella secondo la quale i peptidi E7 di β-HPV attivino i linfociti T CD8+, isolati da cellule cutanee sane in soggetti immunocompetenti. Diversamente i pericolosissimi peptidi E7 di HPV16, ceppo oncogenico per eccellenza, non esplicano la stessa salvifica attivazione immunitaria.
L’immunosoppressione dei Linfociti T è il vero tallone d’Achille
I risultati presentati in questo studio rivelano, dunque, un inedito ruolo protettivo dei Papillomavirus commensali, nello sviluppo di neoplasie di altra natura (chimica, fisica). Impiegando, infatti, la colonizzazione della pelle con un modello murino di Papillomavirus, i ricercatori hanno, di fatto, dimostrato che la protezione dal cancro segue vie indipendenti dall’immunità classica.
Aver individuato linfociti T CD8+ specifici per β-HPV, in pelle sana umana, è indicativo di una immunità acquisita attivata costantemente contro HPV commesali, in adulti sani. Tali cellule T, che risiedono nella pelle, possono mirare a cheratinociti contenenti virus attivi e formare verruche o tumori della pelle.
Quindi, vaccini a base di Linfoti T, che colpiscano commensali di HPV, possono rappresentare un approccio innovativo nel potenziamento dell’immunità anti-virale a livello della pelle. Data, poi, la biodiversità nel virobiota, residente sulla pelle, sarà fondamentale caratterizzare sempre meglio queste comunità virali ed i loro contributi alla nostra salute.