Caratteristiche dei norovirus
I norovirus sono altamente infettivi e persistenti nell’ambiente. In questo articolo approfondiremo diversi aspetti, e introdurremo alcuni degli studi scientifici più recenti riguardanti le ricerche svolte sui norovirus.
Filogenesi dei norovirus
| Dominio | Riboviria |
| Regno | Orthornavirae |
| Phylum | Pisoniviricota |
| Classe | Pisoniviricetes |
| Ordine | Picornavirales |
| Famiglia | Caliciviridae |
| Genere | Norovirus |
| Specie | virus di Norwalk |
La specie più nota è denominata virus di Norwalk, dal nome della città dell’Ohio centro di un’epidemia di gastroenterite nel 1968. Durante l’epidemia, il virus era stato trovato nelle feci ed osservato mediante microscopia elettronica.
I norovirus possono essere geneticamente classificati in almeno sette diversi genogruppi (GI, GII, GIII, GIV, GV, GVI e GVII). I norovirus comunemente isolati nei casi di gastroenterite acuta appartengono ai due genogruppi: il genogruppo I (GI) comprende il virus Norwalk, il virus Desert Shield e il virus Southampton, e il genogruppo II (GII), che comprende il virus Bristol, il virus Lordsdale, il virus Toronto, il virus Messico, il virus Hawaii e il virus Snow Mountain.
Genoma di norovirus
Il genoma virale, contenuto nel capside, è costituito da RNA a senso positivo a singolo filamento lineare. Il genoma del norovirus è lungo 7,5 kilobasi e codifica sei proteine non strutturali, e due proteine strutturali che sono la proteina del capside maggiore VP1 (59 kDa) e la proteina del capside minore VP2 (29 kDa). Il 5′-terminale è legato ad una proteina VPg e il 3′-terminale ha un tratto poli(A).
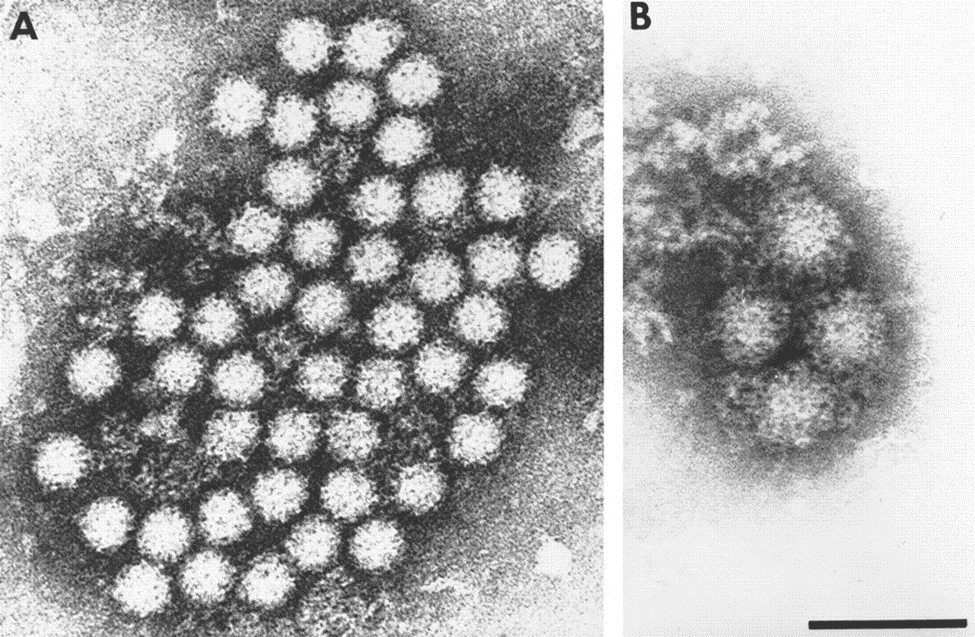
Struttura virale dei norovirus
Sono virus nudi, cioè non avvolti dal pericapside. Le particelle di norovirus hanno un diametro di circa 27-30 nm con simmetria icosaedrica T = 3; tuttavia sono stati descritti virioni anche più piccoli con simmetria icosaedrica T = 1.
Ciclo replicativo
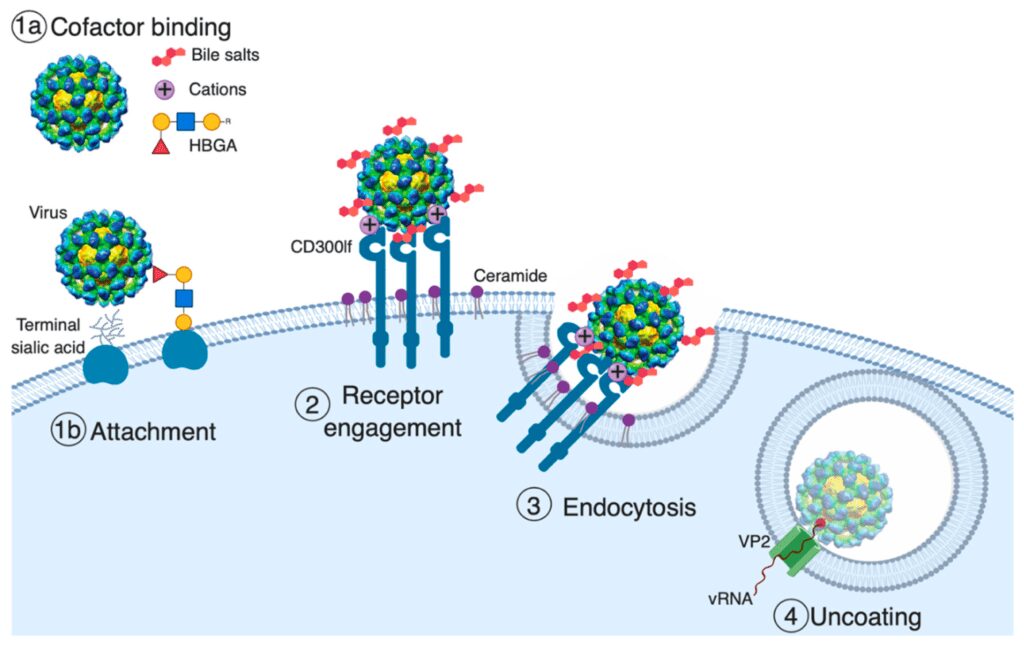
La replicazione virale avviene nel citoplasma. L’ingresso del virus è un processo costituito da più fasi. La prima fase dell’ingresso virale riguarda il legame del virus alle cellule ospiti mediato dai fattori di attaccamento. I fattori di attaccamento sono molecole della cellula ospite, non essenziali, e concentrano il virus sulla superficie cellulare. Non inducono attivamente l’ingresso del virus. Queste molecole includono gli antigeni del gruppo sanguigno (HBGA), gli acidi biliari, l’acido sialico e i cationi bivalenti.
La seconda fase è il legame con i recettori presenti sulla membrana cellulare. I recettori sono molecole essenziali, legano specificamente la particella virale, e promuovono attivamente l’ingresso virale. Ad oggi, non è ancora chiaro quale sia il recettore per il norovirus umano. Avviene, quindi, il legame tra la superficie cellulare e il norovirus, e la fase di endocitosi. Il genoma virale deve penetrare nella membrana endosomiale per entrare nel citoplasma della cellula ospite.
Le fasi successive del ciclo di replicazione sono le seguenti:
- VPg viene rimosso dall’RNA virale, e quindi tradotto in una poliproteina ORF1 elaborata per produrre le proteine di replicazione.
- Dal singolo filamento di RNA a polarità positiva (ssRNA+) viene sintetizzato un doppio filamento di RNA (dsRNA).
- Il genoma dsRNA viene trascritto / replicato fornendo in tal modo mRNA virali e nuovi genomi ssRNA+.
- La traduzione dell’RNA subgenomico dà origine alla proteina del capside e alla proteina strutturale minore VP2.
Infine, avviene l’assemblaggio di nuove particelle virali, e il rilascio mediante lisi cellulare.
Modalità di trasmissione del norovirus
L’ospite più comune per i norovirus è l’essere umano, e i mammiferi in generale. I norovirus si diffondono facilmente e rapidamente tramite diverse vie di contaminazione. La trasmissione avviene direttamente da persona a persona, per via oro-fecale o via aerosol, oppure tramite acqua o cibo infetti, ma anche per contatto con superfici contaminate. Il cibo può essere contaminato da norovirus in molti modi, incluso quando:
- una persona infetta tocca il cibo con le mani nude su cui sono presenti le particelle virali
- il cibo viene posizionato su un bancone o una superficie su cui sono presenti le particelle virali
- il cibo viene coltivato o raccolto con acqua contaminata, come per esempio le ostriche vengono raccolte da acqua contaminata oppure frutta e verdura irrigate con acqua contaminata
Nella maggior parte dei casi documentati, la trasmissione è avvenuta mediante il consumo di acqua o alimenti contaminati. Il più delle volte, la contaminazione è stata attribuita alle cisterne di raccolta dell’acqua o a piscine e fontane.
Sono state inoltre descritte diverse epidemie legate al consumo di alimenti contaminati subito prima del consumo da parte di un alimentarista, produttore o distributore. Infatti, i lavoratori infetti del settore alimentare sono spesso la fonte di focolai, in quanto tendono a maneggiare i cibi pronti con le mani nude prima di servirli (come frutta e verdura crude).
Metodi di identificazione
I norovirus non sono coltivabili in laboratorio (è possibile solo negli enteroidi umani derivati da cellule staminali) e, per questo motivo, hanno posto qualche problema diagnostico in passato. Fino a qualche anno fa, infatti, era possibile identificarli solo con l’osservazione al microscopio elettronico, date le minuscole dimensioni, oppure misurando la presenza di anticorpi nel sangue. Inoltre, non essendo coltivabili, è stato difficile approfondire le modalità di infezione e di replicazione dei norovirus negli esseri umani.
Negli ultimi anni, il norovirus è stato analizzato mediante reazione a catena della polimerasi a trascrizione inversa (RT-PCR) oppure mediante test commerciali ELISA (acronimo dall’inglese Enzyme-Linked Immuno Assay) per la ricerca del virus da campioni biologici.
Inoltre la ricerca ambientale dei virus enterici umani richiede un limite di rilevamento (LOD) estremamente basso. Sebbene le tecniche basate su RT-PCR forniscano la specificità necessaria per il rilevamento e l’identificazione del norovirus, questi metodi molecolari sono suscettibili all’inibizione di più componenti associati a matrici ambientali, e non riescono a fornire sufficiente rapidità e applicabilità sul campo. Le tecniche di immunodosaggio sono più semplici della RT-PCR e hanno il potenziale per essere incorporate su una piattaforma microfluidica.
Patogenesi
Abbiamo già approfondito in un altro articolo le recenti scoperte sulle cellule bersaglio del norovirus nell’uomo. Quando una persona viene infettata dal norovirus, dopo circa 1-2 giorni possono comparire i sintomi di infezione. Il sintomo principale è la gastroenterite acuta.
Diversi nomi sono stati usati per indicare le varie epidemie, ad esempio gastroenterite virale epidemica, diarrea virale, malattia invernale del vomito, a seconda del quadro clinico prevalente.
La gastroenterite da virus Norwalk ha un periodo di incubazione di 24-48 ore. L’inizio è rapido, ed il decorso clinico è breve, di circa 12-60 ore. I sintomi comprendono diarrea, nausea, vomito, febbricola, crampi addominali, cefalea e malessere. La malattia può essere invalidante durante la fase sintomatica, ma raramente si rende necessario il ricovero in ospedale.
Gli anticorpi si sviluppano durante il decorso della malattia, e di solito esercitano un effetto protettivo relativamente breve contro la reinfezione con lo stesso agente. In particolare, l’immunità allo stesso ceppo di norovirus può durare da 6 mesi a 2 anni. Questa immunità non protegge completamente dalle infezioni da parte di altri genotipi dello stesso virus.
Oltre all’immunità acquisita a seguito dell’infezione (o eventualmente a seguito della vaccinazione), esiste una componente genetica innata. Recentemente, è stata approfondita l’associazione tra l’infezione da norovirus e gli indicatori genetici dell’espressione di HBGA. La produzione di HBGA è codificata da tre famiglie di geni che esprimono gli antigeni: ABO (enzimi A/B), secretori (FUT2) e di tipo Lewis (FUT3). Si è osservato che il genotipo FUT2 è un fattore importante nel determinare il rischio di infezione da norovirus pediatrico, soprattutto nel norovirus GII.4 che predomina in tutto il mondo (Currier et al., 2014). Queste caratteristiche genetiche che influenzano l’espressione di HBGA sembrano essere molto variabili in base all’etnia.
Terapia
Non esiste una terapia specifica per la gastroenterite da norovirus. La terapia sintomatica consiste nel sostituire le perdite di liquidi e correggere i disturbi elettrolitici, attraverso la somministrazione di liquidi per via orale ed endovenosa.
Il mezzo più importante per prevenire la trasmissione e l’infezione da norovirus è il lavaggio frequente e appropriato delle mani. I disinfettanti per le mani a base di alcol (≥ 62% di etanolo) possono essere utili come metodo aggiuntivo per l’igiene delle mani, ma non devono sostituire il lavaggio con acqua e sapone.
La prevenzione della malattia da norovirus di origine alimentare si basa sulla fornitura di cibo e acqua sicuri. I norovirus sono relativamente resistenti ai fattori esterni ambientali: sono in grado di sopravvivere al congelamento, a temperature fino a 60°C, e possono perdurare nei molluschi anche a seguito di cottura a vapore dell’alimento. Inoltre, i norovirus possono sopravvivere fino a 10 ppm di cloro, ben al di sopra dei livelli abitualmente presenti nei sistemi idrici pubblici.
Nonostante queste caratteristiche, è probabile che misure relativamente semplici, come la corretta manipolazione dei cibi freddi, il lavaggio frequente delle mani e il congedo per malattia retribuito, possano ridurre sostanzialmente la trasmissione alimentare dei norovirus.
Ad oggi, non esiste un vaccino preventivo. Sono stati condotti degli studi che hanno portato allo sviluppo di vaccini sperimentali contro i ceppi più comuni di norovirus. Le difficoltà principali per lo sviluppo del vaccino sono dovute da:
- la natura complessa del norovirus
- le risposte immunitarie umane
- la difficoltà di coltura del virus
- i modelli animali limitati per i test sui vaccini.
Numerosi vaccini sono attualmente in fase di sviluppo preclinico, e uno ha completato gli studi clinici di Fase II sugli adulti. Si tratta di vaccini multivalenti, simili ai vaccini antinfluenzali.
Cenni di epidemiologia
I calicivirus umani sono diffusi in tutto il mondo. I Cdc statunitensi stimano che ogni anno, nel mondo, si verifichino 685 milioni di infezioni da norovirus, di cui 200 milioni tra bambini sotto i 5 anni. Come nel resto d’Europa, anche in Italia si registrano diversi casi di infezione da norovirus all’interno di strutture ospedaliere, case di riposo, scuole e all’interno di ambienti confinati, come per esempio le navi da commercio, e le navi da crociera.
Nella maggior parte dei Paesi europei è stato registrato un andamento crescente dei casi di infezione da norovirus a partire dal 1997, con un picco significativo nel 2006 in molti Paesi.
In Italia, negli ultimi anni sono state segnalate diverse epidemie di gastroenteriti collegate al consumo di acqua contaminata da norovirus, con diverse centinaia di soggetti coinvolti, e probabilmente riconducibili ad un malfunzionamento dei sistemi di potabilizzazione. Nel 2006, la provincia di Taranto è stata colpita da un’epidemia di norovirus, e la causa è da attribuirsi proprio al consumo di acqua contaminata. Anche nel 2013 è stato registrato un focolaio di norovirus nel nord Italia che ha colpito 33 bambini. I pazienti avevano bevuto acqua di fiume durante un’escursione. Lo scarico improprio di acque reflue umane nel fiume potrebbe aver causato questo focolaio portato dall’acqua.
Noronet
Noronet è una rete informale di scienziati che lavorano in istituti di sanità pubblica o università che condividono dati virologici, epidemiologici e molecolari sul norovirus. Lo scopo di Noronet è quello di ampliare le conoscenze sulle tendenze geografiche e temporali nell’emergenza e nella diffusione delle varianti di norovirus, limitando così l’impatto e la portata delle future epidemie. Un secondo obiettivo è la progettazione di una nomenclatura standardizzata, ben fondata per genotipi e varianti di norovirus esistenti ed emergenti o sottolineaggi.
Fonti
- health.gov
- viralzone
- iss.it
- cdc.gov
- noronet
- Kapikian AZ, Wyatt RG, Dolin R, Thornhill TS, Kalica AR, Chanock RM. Visualization by immune electron microscopy of a 27-nm particle associated with acute infectious nonbacterial gastroenteritis. J Virol. 1972 Nov;10(5):1075-81. doi: 10.1128/JVI.10.5.1075-1081.1972. PMID: 4117963; PMCID: PMC356579.
- White LJ, Hardy ME, Estes MK. Biochemical characterization of a smaller form of recombinant Norwalk virus capsids assembled in insect cells. J Virol. 1997 Oct;71(10):8066-72. doi: 10.1128/JVI.71.10.8066-8072.1997. PMID: 9311906; PMCID: PMC192173.
- Graziano VR, Wei J, Wilen CB. Norovirus Attachment and Entry. Viruses. 2019 May 30;11(6):495. doi: 10.3390/v11060495. PMID: 31151248; PMCID: PMC6630345.
- Payne DC, Parashar UD, Lopman BA. Developments in understanding acquired immunity and innate susceptibility to norovirus and rotavirus gastroenteritis in children. Curr Opin Pediatr. 2015 Feb;27(1):105-9. doi: 10.1097/MOP.0000000000000166. PMID: 25490691; PMCID: PMC4618547.
- Currier R, Shirley SH, Payne DC, et al. FUT2 genotype influences the burden of pediatric norovirus gastroenteritis. Presented at the 2014 meeting of the Pediatric Academic Societies; Vancouver, Canada. 2014.
- Capece G, Gignac E. Norovirus. 2022 Aug 8. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2022 Jan–. PMID: 30020637.
- Di Bartolo I, Pavoni E, Tofani S, Consoli M, Galuppini E, Losio MN, Ruggeri FM, Varisco G. Waterborne norovirus outbreak during a summer excursion in Northern Italy. New Microbiol. 2015 Jan;38(1):109-12. Epub 2015 Jan 1. PMID: 25742154.
- Martinelli D, Prato R, Chironna M, Sallustio A, Caputi G, Conversano M, Ciofi Degli Atti M L, D’Ancona F P, Germinario C A, Quarto M. Large outbreak of viral gastroenteritis caused by contaminated drinking water in Apulia, Italy, May – October 2006. Euro Surveill. 2007;12(16): pii=3176. https://doi.org/10.2807/esw.12.16.03176-en.
Crediti delle immagini
- Immagine in evidenza: Capece G, Gignac E. Norovirus. 2022 Aug 8. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2022 Jan–. PMID: 30020637.
- Figura 1: Kapikian AZ, Wyatt RG, Dolin R, Thornhill TS, Kalica AR, Chanock RM. Visualization by immune electron microscopy of a 27-nm particle associated with acute infectious nonbacterial gastroenteritis. J Virol. 1972 Nov;10(5):1075-81. doi: 10.1128/JVI.10.5.1075-1081.1972. PMID: 4117963; PMCID: PMC356579.
- Figura 2: Graziano VR, Wei J, Wilen CB. Norovirus Attachment and Entry. Viruses. 2019 May 30;11(6):495. doi: 10.3390/v11060495. PMID: 31151248; PMCID: PMC6630345.