Progetto Genoma Umano
Il 14 aprile 2003 è stato portato a termine il Progetto Genoma Umano: finalmente si disponeva del completo sequenziamento del DNA della nostra specie. Alla gioia dell’impresa eroica è tuttavia susseguita subito l’incomprensione: la parte codificante dei geni (gli esoni), rappresenta infatti soltanto una piccola percentuale del nostro DNA.
I trasposoni
In cosa consiste il resto del genoma? La maggior parte dei nostri cromosomi è costituita da sequenze ripetitive disperse: i trasposoni. I nostri cromosomi sono un oceano di trasposoni dal quale emergono di tanto in tanto gli esoni.
I trasposoni, anche chiamati elementi genetici mobili, elementi trasponibili o geni saltatori, sono dei frammenti di DNA capaci di replicarsi e di posizionarsi in regioni diverse dei cromosomi. Questo è un meccanismo molecolare spesso codificato dall’elemento stesso.
Qual è il loro ruolo?
Sembra che la storia dei trasposoni sia molto antica: essi hanno oltrepassato le barriere inter-specie acquisendo delle funzioni ritenute essenziali. Tuttavia, succede anche che i trasposoni possano seminare il panico nelle nostre cellule ed innescare processi patologici, come quelli cancerosi.
“Taglia – incolla” o “incolla – taglia”?
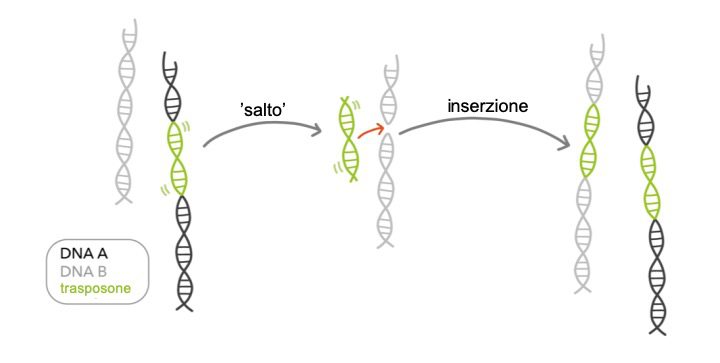
A seconda dei loro meccanismi, si distinguono due grandi famiglie di trasposoni: “taglia – incolla” o “incolla – taglia”. I primi prevedono l’escissione sotto forma di DNA, accompagnata dall’integrazione della parte escissa in un’altra parte del genoma. Essi rappresentano la famiglia dei trasposoni a DNA, spesso chiamati solo trasposoni (Figura 1).
L’altra famiglia, detta “incolla – taglia”, è invece la più comune negli esseri umani. In questo caso l’elemento è dapprima trascritto in RNA, convertito in DNA ed integrato in un’altra parte del genoma. In questo caso si parla di retrotrasposoni. L’enzima chiave di questo processo è la trascrittasi inversa, che ricopia l’RNA sotto forma di DNA. Esso è presente anche nei retrovirus, come HIV, i quali ne rappresentano i probabili antenati. Del resto, la distinzione tra retrotrasposoni e retrovirus è incerta.
Alcuni retrotrasposoni sono diventati indipendenti dall’ospite originale dopo aver acquisito un gene codificante per proteine dell’involucro, divenendo retrovirus. Al contrario, certi retrovirus hanno infettato la linea germinale del loro ospite (le cellule sessuali) diventando così dei retrotrasposoni, trasmessi da una generazione ad un’altra.
I retrotrasposoni della linea L1
Solo una sottofamiglia di retrotrasposoni è sempre attiva nel nostro genoma: i retrotrasposoni della linea 1 o L1, di origine non virale. Essi assistono la replicazione (retrotrasposizione) di elementi trasponibili non codificanti per una trascrittasi inversa, come le sequenze Alu o SVA. Tuttavia, tra le migliaia di copie di elementi L1 del nostro genoma, solo un centinaio sono in grado di generare nuove copie. Gli elementi L1 sono presenti solo negli umani; i nostri cugini, scimpanzè e gorilla, possiedono infatti altri elementi trasponibili attivi.
In seguito al Progetto Genoma Umano, è stato sequenziato il genoma di migliaia d’individui diversi nel mondo. Seppur simili, essi differiscono tuttavia in modo più o meno importante. Le variazioni genetiche riscontrate inoltre non sono soltanto semplici modificazioni di nucleotidi, ma anche cambiamenti più grandi, come delezioni o inserzioni, in particolare proprio di elementi trasponibili.
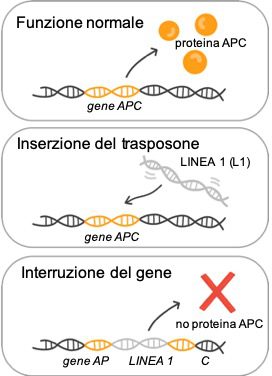
Le conseguenze dei trasposoni possono essere complesse: si potrebbero verificare ad esempio modificazioni dei livelli d’espressione del gene, perturbazioni del profilo spazio-temporale della sua espressione, persino creazioni di nuove forme dello stesso gene (Figura 2).
Alla fine degli anni ’80, Haig Kazazian, studiò le mutazioni responsabili dell’emofilia. Kazazian scoprì delle inserzioni dell’elemento L1 nella regione codificante del gene del fattore VIII (implicato nella coagulazione), nei pazienti affetti da emofilia. Quest’osservazione è stata straordinaria per diversi motivi: ha infatti dimostrato non solo che esistevano degli elementi trasponibili attivi negli esseri umani, ma anche che potevano essere la causa di malattie genetiche.
Oggi sappiamo che inserzioni ereditabili possono prodursi nelle cellule sessuali, spermatozoi e ovuli, dei genitori. Fortunatamente, queste nuove inserzioni non provocano necessariamente malattie genetiche.
I mosaici genetici
Il lavoro di Kazazian e più recentemente, il lavoro del team di Jose-Luis Garcia-Perez, dell’Università di Edimburgo, mostrano che il processo di retrotrasposizione potrebbe avvenire nel primo stadio dello sviluppo embrionale.
In questo stadio infatti alcune cellule dell’organismo o della placenta sono soggette ad inserzione ed altre no, facendo sì che molti di noi risultino chimere genetiche. Nella maggior parte dei tessuti adulti, i retrotrasposoni L1 sono repressi da numerosi meccanismi cellulari che bloccano la loro espressione e replicazione.
I lavori di Alysson Muotri e Fred Gage, dell’Istituto Salk a San Diego, hanno mostrato che i retrotrasposoni sono reattivi nel cervello degli esseri umani e dei roditori. Le domande restano comunque tante: è un processo normale, oppure importante per le funzioni cerebrali o la complessità del nostro cervello? Una maggiore attività dei retrotrasposoni potrebbe dare origine a delle malattie neurologiche o neurodegenerative, come la schizofrenia o il morbo di Parkinson?
Il laboratorio di Fred Gage ha rivelato che nel topo, l’accumulazione di nuove copie dell’elemento L1 potrebbe essere influenzata dalle prime esperienze di vita, collegando così ambiente e alterazioni genetiche nel cervello. I retrotrasposoni L1 sono attivi anche nei tumori umani. Il gruppo di Burns, dell’università John Hopkins, ha individuato il meccanismo di retrotrasposizione in circa la metà dei tumori epiteliali. Numerosi laboratori nel mondo hanno scoperto nuove inserzioni di L1 nei tumori, e la loro assenza nei tessuti normali circostanti.
Recentemente, un vasto studio del Consorzio Internazionale della Genomica del Cancro, ha provato che la riattivazione dei retrotrasposoni può condurre a un largo ventaglio d’alterazioni cromosomiche. In particolare, nel cancro dell’apparato digerente (cavo orale, esofago, stomaco e colon) o del polmone. I genetisti hanno identificato migliaia d’inserzioni, ma anche inversioni, traslocazioni o grandi delezioni di milioni di paia di basi, associate alle inserzioni.
Trasposoni ed epigenetica
E cosa succede a livello epigenetico? Le modificazioni chimiche del DNA e degli istoni, le proteine attorno alle quali il DNA si avvolge, giocano un ruolo importante nella regolazione genica, e nella repressione dei retrotrasposoni. Questo profilo epigenetico è profondamente alterato nelle cellule cancerose. Inoltre, si è pensato per molto tempo che queste alterazioni erano sufficienti per riattivare i retrotrasposoni L1.
La verifica di quest’ipotesi è stata difficile per due ragioni: la sequenza dei retrotrasposoni è quasi identica e la loro posizione nel genoma varia enormemente. In queste condizioni com’è possibile sapere se nelle cellule tumorali molti elementi L1 sono riattivati, o se solamente un piccolo numero di copie viene espressa?
Alcuni ricercatori hanno utilizzato l’associazione di più approcci innovativi di sequenziamento e bioinformatica per arrivare a formulare una risposta: solo poche copie di L1 sono attive in un tipo cellulare o in un dato tessuto. Alcune di queste copie sono polimorfiche nella popolazione, sono cioè presenti solo in certi individui, possono rappresentare dei fattori di predisposizione al cancro nel tessuto dove sono attivi. In altre parole, non siamo tutti uguali per i retrotrasposoni e i loro effetti potenzialmente mutageni.
Inserzioni aleatorie… o quasi
Resta una domanda essenziale: gli elementi trasponibili s’inseriscono in modo totalmente aleatorio nel genoma, oppure prendono di mira delle regioni particolari? Lo studio di organismi modelli e dei retrovirus ha messo in luce la diversità delle strategie adattate: alcuni elementi trasponibili privilegiano le regioni più accessibili dei cromosomi, altri le regioni particolarmente compatte.
Alcuni preferiscono i geni, altri li evitano. Tuttavia, due studi mostrano che seppur non si inseriscano in modo omogeneo nel nostro DNA, non sono affatto influenzati dallo stato di condensazione della cromatina o dalla presenza di geni.
Il principale fattore che guida la loro integrazione è la presenza di un motivo molto corto (una sequenza di basi del DNA) riconosciuto da degli enzimi codificati dall’elemento L1 che guidano la retrotrasposizione. Questo motivo non è distribuito nello stesso modo in tutte le regioni cromosomiche, né tra i due filamenti della doppia elica di DNA. Perché questi risultati sono importanti? Paragonando le regioni dove un elemento L1 si può inserire e quelle dove lo ritroviamo nel corso dell’evoluzione di una popolazione, possiamo riuscire a capire in quali regioni l’inserimento di un elemento trasponibile è dannoso. Viceversa, l’arricchimento d’inserzioni in una regione, per esempio in un tumore, può mettere in luce i fattori che contribuiscono alla crescita tumorale.
Il caso della sindrome di Aicardi-Goutières
Per quanto riguarda gli effetti mutageni dei retrotrasposoni attraverso la loro inserzione nel genoma, lo studio della sindrome di Aicardi-Goutières, dal gruppo di Daniel Stetson, all’università di Washington ha aperto nuove prospettive.
I pazienti colpiti da questa malattia genetica rara presentano dei sintomi infiammatori, disordini neuorologici e dello sviluppo importanti, soprattutto nel cervello. Questo insieme di sintomi ricordano quelli di un’infezione virale congenitale, ma nessun virus conosciuto è stato identificato. La risposta infiammatoria sembra essere iniziata dalla produzione di DNA complementare del retrotrasposone L1 ed il suo accumulo nel citoplasma delle cellule. Si ignora come queste molecole di DNA possano lasciare il nucleo dove la retrotrasposizione avviene normalmente.
Sorprendentemente, in caso di senescenza cellulare, in cui si assiste alla perdita della facoltà proliferativa della cellula a causa del suo invecchiamento, si manifesta un fenomeno simile. La cromatina e gli altri marcatori epigenetici sono profondamente rimodellati, i retrotrasposoni L1 sono riattivati, senza che si notino fenomeni d’inserzione: il loro DNA complementare si accumula nel citoplasma e attiva la risposta infiammatoria legata all’interferone.
Questa risposta infiammatoria, all’origine di numerose patologie associate all’invecchiamento, è abolita quando le cellule, o i topi, sono trattati con inibitori della trascrittasi inversa, utilizzati contro l’HIV. Questa scoperta, fatta dal gruppo di John Sedivy dell’università di Brown, suggerisce che i retrotrasposoni sarebbero direttamente implicati nell’invecchiamento, e che sarebbe possibile limitare il loro effetto deleterio attraverso degli approcci farmacologici.
Nuovi sistemi di connessioni geniche
Le sequenze regolatrici dei trasposti possono agire anche a distanza. Esse sono ridistribuite nel genoma in seguito alla migrazione degli elementi trasponibili con degli effetti diversi a seconda che si inseriscano vicino o all’interno di un gene.
Barbara McClintock, premio nobel della medicina nel 1983 per la scoperta dei trasposoni, suggerì per prima che questi fossero in grado di controllare i geni. Mentre, Roy Britten e Eric Davidon negli anni 1970, immaginarono che essi potessero essere distribuiti e creare nuovi moduli genetici, permettendo un’evoluzione ed un adattamento rapido ad un ambiente mutevole.
Gli esempi nel mondo vegetale e animale sono numerosi. Per esempio, l’inserzione dei retrotrasposoni a monte di un gene implicato nella regolazione della biosintesi delle antocianine, ha portato allo sviluppo delle arance sanguigne.
Oppure, all’inizio del XIX secolo, l’inserzione di un elemento trasponibile in un gene legato alla pigmentazione delle falene, le ha rese più scure. Quest’adattamento fù essenziale, perché permise alle falene di difendersi dagli uccelli, loro predatori. Infatti, in piena rivoluzione industriale, i tronchi degli alberi erano più scuri a causa dell’inquinamento atmosferico.
Il gruppo di Cédric Feschotte, dell’università di Utah, ha identificato negli esseri umani una famiglia di retrovirus endogeni (MER41), che ha invaso il nostro genoma tra 45 a 60 milioni d’anni fa e ci è rimasta. Questi elementi controllano una parte della risposta antivirale innata e hanno contribuito allo sviluppo di centinaia di motivi di DNA capaci di attivare i geni vicini in risposta all’interferone gamma, una proteina che interviene nel controllo delle cellule del sistema immunitario.
In modo simile, il gruppo di Joanna Wysocka, all’università di Stanford, ha scoperto che un sottogruppo di sequenze derivato da retrovirus endogeni HERVK, che esiste solamente nei primati ominoidei, esseri umani compresi, controlla sulla lunga distanza cromosomica l’attività di centinaia di geni attivi nelle cellule embrionali.
I motivi a dita di zinco sono indispensabili
Il legame tra elementi trasponibili e genoma è rafforzato, nei vertebrati, da una famiglia di proteine dette a dita di zinco con un dominio KRAB (KZFP). Ogni proteina riconosce un unico motivo di DNA e induce un cambiamento della cromatina che lo circonda, reprimendo i geni che essa contiene. Ora, una parte dei KZFB riconosce direttamente gli elementi trasponibili. Di conseguenza, la proliferazione di questi trasposoni è contenuta e l’espressione dei geni circostanti regolata.
Didier Trono, della scuola politecnica di Losanna, ha proposto recentemente che le proteine KZFP controllano l’espressione dei geni importanti per lo sviluppo embrionale o neurale. Occasionalmente, sono sequestrati per reprimere una famiglia particolare di elementi trasponibili, in questo tessuto. Questi trasposoni si moltiplicano e si disperdono nel genoma, apportando dei nuovi siti di legame di KZFP vicino a nuovi geni. A lungo termine il processo si spegne, perché da una parte è bloccata dai KZFP e dall’altra, ognuna delle coppie accumula mutazioni che l’inattivano. Nonostante ciò, i motivi di legame di KZFP sono stati disseminati e sono attualmente in grado di regolare nuovi geni. Se le innovazioni così acquisite apportano un qualche avvantaggio selettivo, l’elemento trasponibile che trasporta il motivo sarà progressivamente selezionato, o fissato nella popolazione.
Insomma, la relazione tra i trasposoni e il genoma contribuisce ampiamente all’evoluzione della rete di regolazione genica. Gli elementi trasponibili apportano una plasticità inaudita nei genomi degli esseri viventi, ben al di là delle semplici mutazioni di DNA. Uno degli esempi più evidenti è la comparsa dell’immunità acquisita nei vertebrati, fondata sulla diversificazione degli anticorpi. Come David Schatz, all’università di Yale ha dimostrato, gli enzimi che iniziano queste reazioni, RAG1 e RAG2 derivano da un trasposone a DNA, noto come protoRAG. Anche il nostro sistema immunitario è il frutto dell’addomesticamento di un elemento trasponibile.
E la placenta fu…
Più recentemente nella storia evolutiva, l’evoluzione della placenta nei mammiferi (detti placentali) è legata all’infezione delle cellule sessuali o embrionali da parte di retrovirus. Tutti i retrovirus possiedono sulla superficie delle proteine dell’involucro, che rendono possibile la fusione delle membrane cellulari e virali, la prima fase dell’infezione. Queste proteine, talvolta, influiscono sull’azione del sistema immunitario. Ed anche se i retrovirus non sono funzionali dal punto di vista replicativo ed infettivo, i geni delle proteine dell’involucro, le sincitine, sono sempre funzionali e hanno un ruolo fisiologico essenziale.
Le sincitine, espresse nella superficie delle cellule del trofoblasto, portano alla fusione di queste cellule, una tappa chiave della placentazione. Esse contribuiscono anche alla tolleranza immunologica tra madre e figlio, evitando il rigetto. Inoltre, il gruppo di Thierry Heidmann, dell’Istituto Gustave-Roussy, ha dimostrato che l’addomesticazione degli involucri dei retrovirus endogeni ha avuto luogo numerose volte in maniera indipendente nel corso dell’evoluzione dei mammiferi.
Infine, un ultimo esempio, il gene Arc, implicato nella plasticità sinaptica, deriva da un retrotrasposone che è inserito nel genoma dell’antenato comune dei vertebrati terrestri, i tetrapodi.
Conclusioni
In conclusione, oltre al loro ruolo centrale nell’espressione genica, gli elementi trasponibili hanno contribuito all’emergere di funzioni fisiologiche essenziali come l’immunità, la riproduzione ed il funzionamento cerebrale.
In quanto costituiscono più della metà del nostro genoma, anche se una buona parte è stata addomesticato, è molto probabile che verranno scoperti molti altri esempi.
La nostra autostima dovrebbe soffrirne, dobbiamo molto a dei geni spesso definiti egoisti.
Federica Angius
Fonti
- T. Sultana Et al., The Landscape of L1 Retrotransposons in the Human Genome Is Shaped by Pre-insertion Sequence Biases and Post-insertion Selection, Mol. Cell, vol. 74, pp. 555-570, 2019.
- M. De Cecco Et al., L1 drives IFN in senescent cells and promotes age-associated inflammation, Nature, vol. 566, pp. 73-78, 2019.
- Y. Zhang Et al., Transposon molecular domestication and the evolution of the RAG recombinase, Nature, vol. 569, pp. 79-84, 2019.
- E. Pastuzyn Et al., The Neuronal Gene Arc Encodes a Repurposed Retrotransposon Gag Protein that Mediates Intercellular RNA Transfer, Cell, vol. 173, p. 275, 2018.
- H. Kazazian et J. Moran, Mobile DNA in Health and Disease, N. Engl. J. Med., vol. 377, pp. 361-370, 2017.
- E. Chuong Et al., Regulatory activities of transposable elements: from conflicts to benefits, Nat. Rev. Genet., vol. 18, pp. 71-86, 2017.
- http://sitn.hms.harvard.edu/flash/2018/transposons-your-dna-thats-on-the-go/