
Quando si parla di virus, questi vengono sempre definiti con un’accezione negativa e, comprensibilmente, di rado qualcuno riesce a vederne i lati positivi. Se qualcuno vi dicesse che esistono virus ancestrali, annidati negli antri più oscuri del nostro DNA, e che è anche grazie a questi che il genere umano è in grado di riprodursi, voi ci credereste? È proprio così, stiamo parlando dei cosiddetti RETROVIRUS ENDOGENI UMANI (HERV).
Scoperte recenti mostrano che circa l’8% del DNA umano è caratterizzato dalla presenza di genoma retrovirale fossile, sequenze di natura retrovirale che si sono integrate nel nostro organismo durante processi evolutivi. Esse sono presenti nella maggior parte delle specie animali (per esempio costituiscono circa il 18% del genoma bovino) e si ipotizza derivino da retrovirus esogeni ad oggi estinti, infettivi, che hanno invaso la cellula ospite, attuando così il proprio ciclo di riproduzione caratterizzato dalla trascrizione inversa del loro corrispettivo acido nucleico a RNA in un DNA a doppio filamento e successiva integrazione dello stesso nel genoma ospite.
In seguito alle infezioni, le sequenze retrovirali si sono integrate stabilmente come provirus fissandosi nel genoma della linea germinale e sono state trasmesse di generazione in generazione in maniera mendeliana. Questa ipotesi è rafforzata dal fatto che gli HERVs presentano una struttura genomica analoga a quella degli esogeni. Essa è costituita essenzialmente da tre geni codificanti: Gag, per la produzione di una proteina del capside virale, Pol, per la codifica di enzimi fondamentali quali per esempio la trascrittasi inversa ed infine Env, per la codifica di proteine transmembrana del capside quali Sincizina 1 e 2 responsabili dell’interazione del virus con la cellula ospite, l’adesione e la successiva penetrazione (Figura 1.).
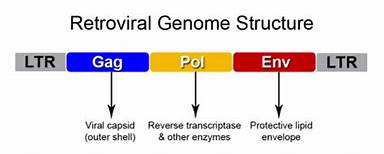
Figura1: struttura genomica dei retrovirus con i 3 geni fondamentali affiancati dalle sequenze regolatorie LTR.
Se questi retrovirus integrati avessero mantenuto nel tempo la loro elevata infettività, ad oggi, stando ai principi alla base dell’evoluzione per i quali ciò che viene trasmesso e conservato nelle generazioni successive sia ciò che fornisce vantaggio all’organismo e non danno, essi di certo non sarebbero più presenti a livello del nostro organismo. Invece, dal momento in cui presumibilmente si sono integrati (circa 50 milioni di anni fa), sono divenuti gradualmente sede di mutazioni, delezioni, metilazioni e riarrangiamenti tali da permetterne una replicazione difettiva e di conseguenza un rapporto simbiontico con gli animali e l’uomo. Il significato della loro presenza nel genoma umano è ancora oggetto di studio, ma sembra che siano implicati sia in processi patologici come sclerosi multipla, tumori, autismo, sia soprattutto in processi fisiologici quali lo sviluppo degli organi genitali e lo sviluppo placentare.
E’ proprio a livello della placenta, organo indispensabile per la crescita fetale intrauterina, che si è riscontrata, tramite esami istologici, un’elevata espressione di questi geni. In particolare, tramite RT-PCR, si è riscontrata un’elevata espressione di S1 e S2 a livello del sinciziotrofoblasto, strato di cellule multinucleate in diretto contatto con il sangue materno che ottimizza gli scambi di nutrienti e ormoni tra il feto e la madre e che mantiene la tolleranza feto-materna con il continuo monitoraggio delle cellule del sistema immunitario materno per prevenire il rigetto del feto (Figura 2).
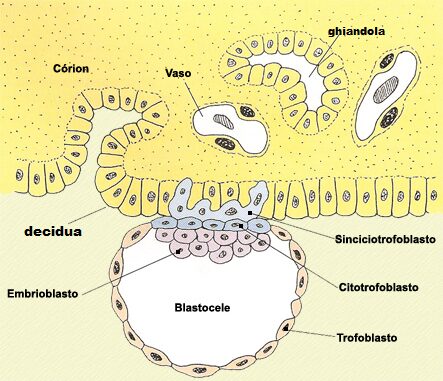
Figura2: illustrazione delle prime fasi dello sviluppo placentare con presenza del sinciziotrofoblasto che si addentra a livello endometriale.
Si è evidenziato come esse siano up-regolate da ormoni prodotti durante la gestazione (progesterone) e che soprattutto una loro down-regolazione comporti un inadeguato sviluppo della placenta con conseguenti problemi nella gravidanza.
La scoperta ancor più sbalorditiva è stata quella di vedere come gli HERVs possano mediare la modulazione delle cellule del sistema immunitario materno. Essi infatti sono in grado di determinare nell’interfaccia madre-feto, a livello trofoblastico, una mal regolazione del complesso di istocompatibilità MHC I classico (che permette il riconoscimento di ciò che è self) e l’induzione di un MHC II, non classico, in grado di andare a sopprimere la risposta immunitaria legando recettori inibitori delle cellule NK.
Tali recettori, a loro volta, ingaggiano molecole inibenti le vie di trasduzione dei recettori attivatori, ig-like leucocitari, o esercitano effetti sulle cellule dendritiche uterine e macrofagiche andando a legare e di conseguenza inattivare i recettori della via innata.
In questo scenario si collocano ulteriori studi che mostrato una anormale espressione di S1 e S2 nelle gravidanze patologiche, soprattutto associate alla pre-eclampsia. Questa patologia è caratterizzata da una placentazione difettiva con riduzione del sinciziotrofoblasto ed una esasperata risposta infiammatoria che può comportare edema ed ipertensione, tutto ciò la rende una delle principali cause di mortalità materna e neonatale.
Altri studi stanno facendo chiarezza sui meccanismi di azione di questi fantastici retrovirus, quello che è certo è che siamo di fronte ad un meraviglioso processo di simbiosi che garantisce la sopravvivenza di entrambe le specie: l’ospite fornisce un’ottima opportunità di propagarsi e la garanzia di sopravvivenza al virus e, grazie a quest’ultimo, l’uomo è in grado di poter dare origine alla sua progenie.
Ed ora, alla luce di tutto ciò, la domanda sorge spontanea: sarà ancora il caso di descrivere tutti questi elementi con accezione negativa o, come spesso succede nella scienza, sarà arrivato il momento di ribaltare questa visione?
Ilaria Bellini
Bibliografia
- G. Antonelli, M. Clementi. “Principi di virologia medica.”. II edizione. Casa Editrice Ambrosiana.
- Weiss RA. “The discovery of endogenous retroviruses.”. 2006.
- Chakrabarti S., Stetzer BP., “The role of human endogenous retroviruses in trophoblast differentiation and placental development.”. 2004.
- Zhang Y., Shi J., Liu S., “Recent advances in the study of active endogenous retroviruses envelope glycoproteins in the mammalian placenta.” 2015.
- Muir A., Lever A., Moffeit A., “Expression and functions of human endogenous retroviruses in the placenta.”. 2004.