Caratteristiche
Il Citomegalovirus umano (HCMV) è un virus ubiquitario che deve il suo nome al tipico effetto citopatico che provoca nelle cellule infettate: queste infatti tendono ad aumentare di volume e a diventare molto grandi, prima di andare incontro a lisi. Appartiene alla famiglia Herpesviridae, sottofamiglia Betaherpesvirinae.
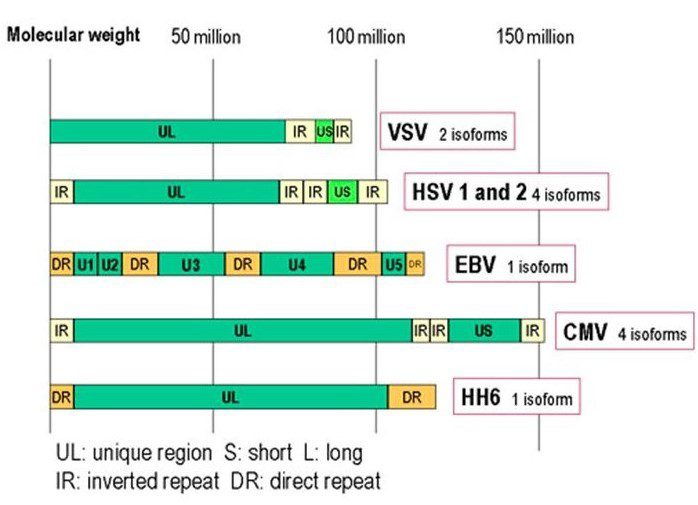
Il virione maturo presenta un diametro compreso tra i 150-250nm ed è composto da un envelope di natura lipoproteica in cui sono posizionate le glicoproteine virus-specifiche, un tegumento elettrondenso e granulare di natura proteica ed un capside icosaedrico di 162 capsomeri. Oltre al virione maturo, si possono formare nelle cellule ospiti due tipi di particelle virali difettive: i Non-Infectious Enveloped Particles (NIEP) e i Dense Bodies (DB). I NIEP sono praticamente identici ai virioni maturi ma mancano di genoma virale, mentre i Dense Bodies mancano di genoma e capside icosaedrico. Il genoma di CMV è costituito da una molecola di DNA bicatenaria (235kb) lineare composta da piccole sequenze ripetute alle due estremità e internamente dette TRL/IRL “Terminal Repeats Long/Internal Repeats Long” e IRS/TRS: “Internal Repeats Short/Terminal Repeats Short” in modo da formare due regioni nucleotidiche di diversa lunghezza, UL (regione unica lunga) e US (regione unica breve). Questa caratteristica è presente nei genomi di molti herpesvirus e a seconda di come sono orientate le due regioni UL e US possono dar luogo a 2 o 4 isoforme; nel caso di HCMV si possono avere 4 isoforme (fig.1).
Filogenesi
| Dominio | Acycota |
| Gruppo | Gruppo I (virus a dsDNA) |
| Famiglia | Herpesviridae |
| Sottofamiglia | Betaherpesvirinae |
| Genere | Cytomegalovirus |
| Specie | Herpes Umano 5 (HHV5) |
Ciclo replicativo del virus
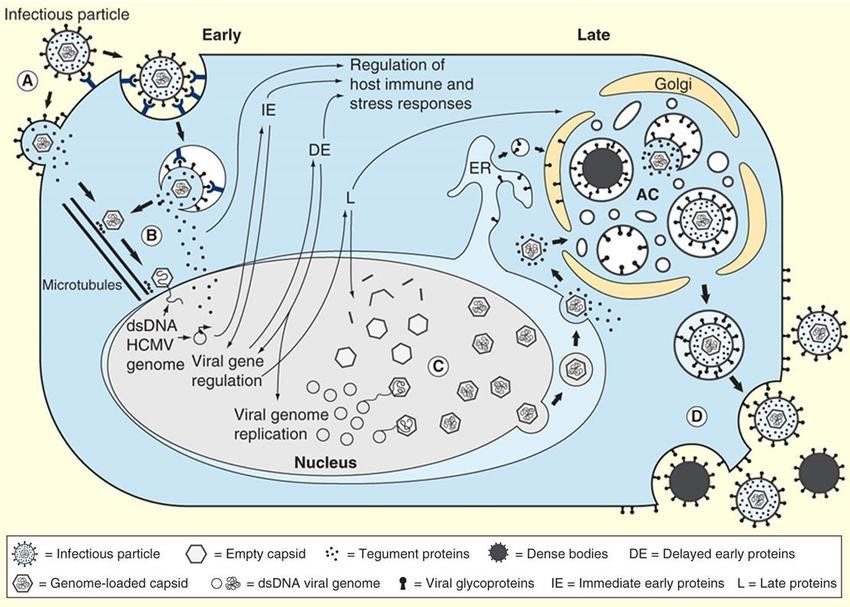
La fase di adesione e penetrazione del virus nella cellula ospite è mediata dal riconoscimento e legame delle glicoproteine (antirecettori) virali gB, gH e gL con i Toll-like receptor 1 e 2 presenti nella membrana cellulare. La funzione principale di questi due recettori transmembrana, così come la maggior parte dei Toll-like, è quella di mediare le fasi iniziali dell’immunità innata, ovvero attivare la cascata di eventi che culmina nell’attivazione del fattore di trascrizione nucleare NF-kB e nella secrezione di citochine infiammatorie.
Una volta penetrato nella cellula, il virus si trasferisce nel nucleo, dove inizia la replicazione tramite l’espressione di geni immediati precoci, precoci e tardivi. Queste categorie di geni codificano per proteine che legano il DNA e controllano la trascrizione genica virale e per i costituenti virali di tipo strutturale. Ad esempio il gruppo dei geni precoci codifica per enzimi implicati nella replicazione del DNA virale come UL112 e UL113 ma anche per glicoproteine come US2 e US11 che mediano l’evasione del virus dal sistema immunitario poiché si legano alle molecole MHC di classe I, trasportandole nel citoplasma dove vengono degradate dal proteasoma. Le proteine tardive (cioè quelle che vengono sintetizzate per ultimo) sono le proteine del tegumento come la pp150, pp71 e pp65 e del capside come ad esempio la costituente principale dei pentoni ed esoni capsidici, la Major Capsid Protein (MCP). La formazione del virione completo avviene in seguito all’acquisizione dell’envelope durante la fase di gemmazione attraverso la membrana nucleare.
Meccanismi patogenetici
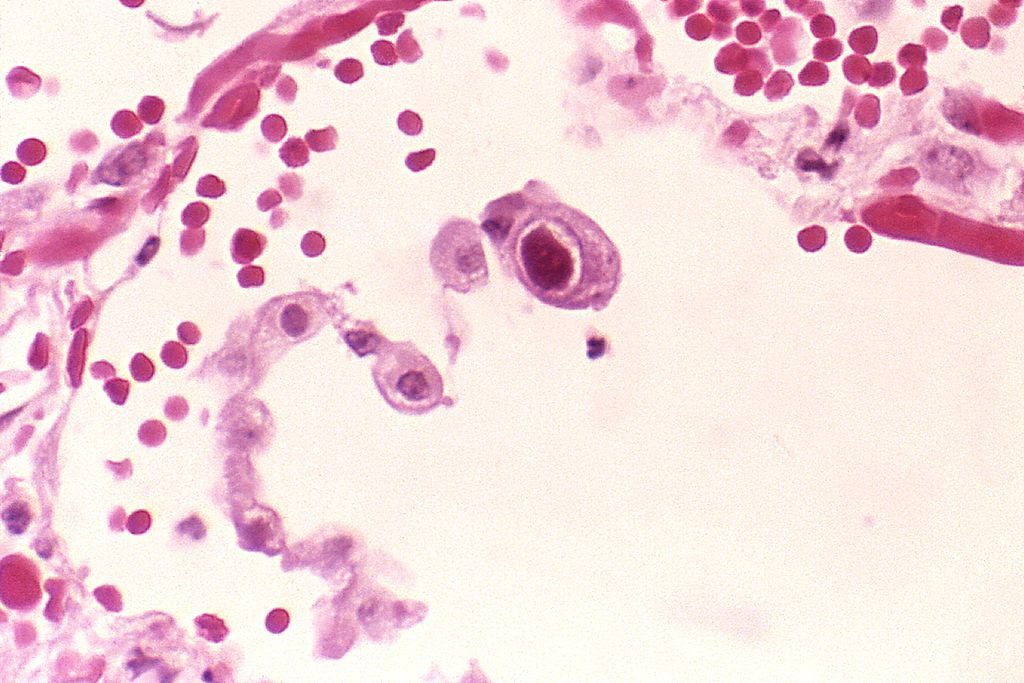
Il citomegalovirus si replica in vitro solamente nei fibroblasti umani, ma in vivo è stato isolato in cellule endoteliali e di derivazione epiteliale (rene, polmone, ghiandole salivari e pancreas). L’effetto citopatico prodotto da questo virus è molto caratteristico, oltre alle tipiche inclusioni intranucleari degli altri herpesvirus, determina inclusioni citoplasmatiche che nel complesso conferiscono alla cellula l’aspetto cosiddetto a “occhio di civetta”.
Dopo l’infezione primaria il citomegalovirus persiste nell’ospite in forma latente. Rappresentano un serbatoio da cui il virus può riattivarsi in determinate situazioni (ad esempio la compromissione del sistema immunitario o l’infezione da HIV) molti tipi cellulari: monociti, le cellule endoteliali e quelle del midollo osseo. Questo virus può essere trasmesso sia per via orizzontale sia per via verticale, sia nel caso si tratti di un’infezione primaria che di una reinfezione riattivazione.
Viene secreto nella saliva, nel sangue, nelle secrezioni lacrimali e nello sperma. La trasmissione avviene per contatto diretto ed il periodo di incubazione è variabile, dipende dalla situazione clinica del soggetto (sano o immunodepresso), in generale è compresa tra 4 e 8 settimane. Quando si manifesta clinicamente i sintomi sono del tutto aspecifici, quali febbre, faringite, malessere generalizzato e linfoadenopatia. Questo quadro clinico è detto sindrome simil-mononucleosica. L’infezione da CMV può essere inoltre acquisita nel periodo prenatale e perinatale ed è la più diffusa infezione virale congenita. I segni clinici alla nascita sono la microcefalia, ittero, epatosplenomegalia, corioretinite e sordità. Nel caso delle infezioni perinatali questo virus viene trasmesso durante il parto tramite le secrezioni vaginali o dal latte materno nella fase di allattamento. Se acquisita durante l’infanzia il quadro clinico può comprendere polmonite, epatosplenomegalia ed in alcuni casi epatite.
Il citomegalovirus è un agente patogeno opportunista, nei soggetti immunodepressi questa infezione assume una notevole gravità, infatti la comparsa di una polmonite interstiziale accompagnata da febbre elevata è la complicanza più frequente con conseguente alto indice di mortalità. Nei pazienti con AIDS l’infezione da CMV è molto frequente e comporta disturbi a livello dell’apparato digerente e visivo con conseguenti esofagiti, coliti e corioretiniti rispettivamente.
Diagnosi
La diagnosi di un’infezione da citomegalovirus richiede l’esecuzione di analisi del sangue in quanto, non essendoci disturbi specifici, non si riesce ad identificare durante la visita medica. Con le analisi del sangue si rilevano gli anticorpi anti-CMV che, nel caso di infezione in corso risultano essere IgM, nel caso di infezione pregressa IgG.
La diagnosi di infezione materna primaria da CMV si basa sulla comparsa di IgG virus-specifiche nel siero di una donna in precedenza sieronegativa o sulla rilevazione di anticorpi IgM specifici associati con IgG a bassa avidità. La diagnosi di riattivazione secondaria è basata su un aumento significativo del titolo anticorpale IgG, con o senza la presenza di IgM ed IgG ad alta avidità.
Nel caso in cui prima della gravidanza il test anti-CMV risulti negativo, è importante che la donna presti particolare attenzione alle misure utili a evitare il contagio durante la gravidanza. Lo screening dell’infezione da CMV non deve essere offerto alle donne in gravidanza poiché non ci sono prove di efficacia a supporto dell’intervento. La diagnosi di infezione fetale di per sé non è un indicatore di malattia. Non è stato ancora identificato un marker del periodo prenatale per prevedere se un feto con infezione congenita sarà sintomatico o meno, o se si svilupperanno sequele e di che tipo. I dati degli studi osservazionali sulla profilassi o terapia con gammaglobuline anti-CMV specifiche disponibili non sono stati confermati da studi clinici controllati randomizzati.
I farmaci antivirali utilizzabili per l’infezione si sono dimostrati teratogeni negli animali e mancano studi sull’uso in gravidanza. Questa raccomandazione attribuisce valore all’alta sieroprevalenza dell’infezione nella popolazione italiana, alla ridotta gravità delle sequele neonatali conseguenti a un’infezione materna secondaria, all’assenza di trattamenti prenatali di provata efficacia e sicurezza per la prevenzione della trasmissione verticale o per la riduzione delle conseguenze di una infezione congenita. Per determinare l’eventuale trasmissione del CMV al feto sono necessari esami più invasivi come l’amniocentesi, da effettuare almeno 7 settimane dopo la data presunta dell’infezione materna, e l’analisi del sangue fetale.
Sebbene attualmente i test sui neonati per CMV non vengano eseguiti di routine, l’infezione congenita può essere diagnosticata identificando il DNA del virus mediante PCR (Polymerase chain reaction) nelle urine, nella saliva o in altri liquidi corporei prelevati entro le prime 2-3 settimane di vita. Dopo 3 settimane di vita, l’individuazione del virus può indicare infezione perinatale. La valutazione del carico virale su sangue o urina di un neonato con infezione congenita può essere utile per la prognosi e il monitoraggio in caso di eventuale terapia.
Trattamento
Il ganciclovir e il foscarnet (fig.4) sono due farmaci efficaci usati per il trattamento delle infezioni gravi nei soggetti immunodepressi. Simile all’aciclovir (farmaco usato per il trattamento di Herpers Simplex Virus di tipo I) per struttura, il ganciclovir (così come foscarnet) inibiscono la DNA polimerasi virale determinando la terminazione della sintesi del genoma virale. Generalmente vengono somministrati per via endovenosa. Al momento non è presente un vaccino.

Si ringrazia Diego Piacentini per il gentile contributo dell’articolo.
Fonti
- Adler & Marshall, 2007, Cytomegalovirus infections, Pediatr. Rev.,28,pp.92-100.
- Beltran & Cristea, 2014, A portrait of the human organelle proteome in space and time during cytomegalovirus infection (Figura modificata fine testo).
- R.F. Kalejta, 2008, Tegument Proteins of Human Cytomegalovirus.
- Tomtishen j,P.,2012, Human Cytomegalovirus tegument proteins pp65, pp71, pp150.
- https://www.albanesi.it/salute/citomegalovirus.htm
- Gilbert GL, Hayes K, Hudson IL, James J., 1989. Prevention of transfusion-acquired cytomegalovirus infection in infants by blood filtration to remove leucocytes. Neonatal cytomegalovirus infection study group.
- https://it.wikipedia.org
- http://slideplayer.it