Utilizzo
Il Simmons Citrate Agar (Fig.1) è un terreno di coltura per il differenziamento delle Enterobacteriaceae, basato sulla capacità microbica di utilizzare il citrato come sola fonte di carbonio.
Negli anni ’20 del secolo scorso Koser sviluppò un brodo per lo sviluppo e il differenziamento dei coliformi fecali, quest’ultimo fu trasformato da Simmons in un terreno solido di più facile utilizzo ed interpretazione.

L’ammonio diidrogeno fosfato rappresenta la fonte di azoto, il fosfato dipotassico funge da tampone, il cloruro di sodio mantiene l’equilibrio osmotico del mezzo; inoltre, come detto in precedenza, il citrato è l’unica fonte di carbonio del terreno. Se questo viene consumato, i batteri libereranno prodotti di scarto fortemente alcalini/basici. Questi ultimi esprimono un enzima chiamato citrato permeasi che converte il citrato in piruvato, successivamente sfruttato per ottenere energia nel ciclo di Krebs.
Nel fare questo, i batteri degradano i sali d’ammonio e liberano ammoniaca che incrementa il carattere alcalino del terreno. Questo innalzamento di pH induce un viraggio dell’indicatore blu di bromotimolo che fa virare il terreno dal verde al blu.
Composizione e preparazione
La composizione del Simmons Citrate Agar è riportata in Tabella 1:
| Ingredienti | Quantità (g/l) |
| Magnesio solfato | 0,200 |
| Diidrogeno fosfato d’ammonio | 1,000 |
| Fosfato dipotassico | 1,000 |
| Citrato di sodio | 2,000 |
| Cloruro di sodio | 5,000 |
| Blu di bromotimolo | 0,080 |
| Agar | 15,000 |
La formula del terreno può essere adattata a seconda delle esigenze, purché il pH finale del mezzo resti di 6,8. Per la preparazione è necessario seguire determinati passaggi:
- Sospendere i 24,28 g di polvere in 1 l di acqua pura/distillata.
- Portare ad ebollizione e mescolare fino al completo scioglimento delle polveri.
- Trasferire il liquido in piastre o in fiasche.
- Sterilizzare tramite un ciclo in autoclave a 121°C per 15 minuti.
Prima di iniziare è necessario assicurarsi che il pH dell’acqua sia compreso tra 6,5 e 7. Se così non fosse, infatti, il colore del mezzo potrebbe essere decisamente diverso da quanto atteso.
Metodo
La procedura di laboratorio prevede di ottenere colture pure dell’organismo che si intende testare, e successivamente il campione potrà essere seminato sulla piastra che dovrà essere incubata a 37°C per 24-48 h.
Risultati della crescita
I coliformi fecali sono incapaci di utilizzare il citrato ed i sali d’ammonio come uniche fonti di carbonio e di azoto presenti nel mezzo. Al contrario, alcuni coliformi non fecali come Enterobacter aerogenes sono in grado di svilupparsi e accrescersi in presenza del solo citrato, facendo virare il pH verso il basico e il colore del terreno dal verde al blu.
Soltanto i microrganismi capaci di servirsi del citrato cresceranno su questo terreno vigorosamente: per esempio, Escherichia coli non si sviluppa sul mezzo o, se lo fa, la crescita risulta talmente minima da non determinarne particolari cambiamenti di colore.
I risultati ottenibili sono riassunti in Tabella 2:
| Microrganismo | Tipologia inoculo | Sviluppo | Aspetto |
| Citrobacter freundii ATCC 43864 | Diretto | Crescita buona | Blu |
| Enterobacter aerogenes ATCC 13048 | Diretto | Crescita buona | Blu |
| Escherichia coli ATCC 25922 | Diretto | Inibizione totale o parziale | Verde |
| Proteus mirabilis ATCC 29906 | Diretto | Crescita buona | Blu |
| Salmonella enteritidis ATCC 13076 | Diretto | Crescita buona | Blu |
| Salmonella typhimurium ATCC 14028 | Diretto | Crescita buona | Blu |
| Shigella flexneri ATCC 12022 | Diretto | Inibizione totale o parziale | Verde |
| Shigella sonnei NCTC 8574 | Diretto | Inibizione totale o parziale | Verde |
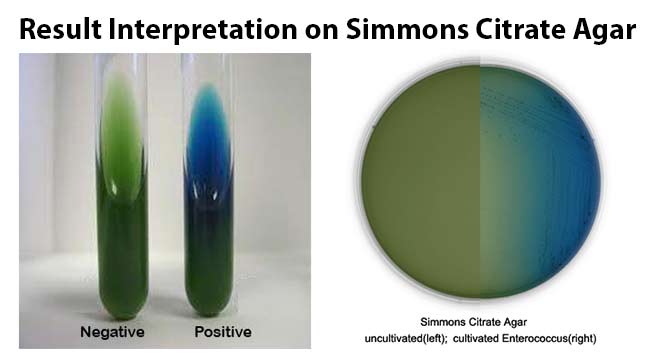
Perciò, una reazione positiva è indicata sia dalla crescita che dal viraggio del colore del terreno di coltura verso il blu (reazione alcalina). Al contrario, una reazione negativa è segnalata dall’inibizione della crescita, o da una crescita limitata, in assenza di cambiamento di colore del terreno.
Immagini
I risultati della crescita e della reazione sono visibili nella figura 2 e nella figura 3 sottostanti:

Limitazioni
I microrganismi fastidiosi, a causa delle loro complicate esigenze nutrizionali, potrebbero non proliferare, o farlo in maniera limitata su questo terreno. Tuttavia, questo non avrebbe nulla a che fare con il metabolismo del citrato. Inoltre, alcuni microrganismi citrato positivi richiedono un’incubazione di almeno 48 h affinché il viraggio di colore del mezzo risulti evidente.
Controllo di qualità
Per un controllo di qualità adeguato è necessario seguire queste indicazioni:
- Le polveri (Fig.4) per preparare il terreno devono apparire gialline e omogenee.
- Il terreno deve essere compatto e resistente, comparabile come consistenza ad un 1,5% di gel d’agarosio.
- Il pH del mezzo deve essere compreso tra 6,60 e 7,00 (soluzione al 2,43% w/v a 25°C).

Le caratteristiche del terreno incubato a 35-37°C per 18-24°C devono rispettare quanto riportato in Tabella 3:
| Microrganismo | Inoculo (CFU) | Crescita | Utilizzo del citrato |
| Klebsiella aerogenes ATCC 13048 | 50-100 | Buona-Ottima | Positiva, colore blu |
| Escherichia coli ATCC 25922 | >=104 | Inibita | |
| Salmonella Typhi ATCC 6539 | 50-100 | Debole-Buona | Negativa, colore verde |
| Salmonella Typhimurium ATCC 14028 | 50-100 | Buona-Ottima | Positiva, colore blu |
| Shigella dysenteriae ATCC 13313 | >=104 | Inibita | |
| Salmonella Choleraesuis ATCC 12011 | 50-100 | Buona-Ottima | Positiva, colore blu |
| Salmonella Enteritidis ATCC 13076 | 50-100 | Buona-Ottima | Positiva, colore blu |
Fonti
- Scheda tecnica HIMEDIA;
- Scheda tecnica NEOGEN;
- Baird R.B., Eaton A.D., and Rice E.W., (Eds.), 2015, Standard Methods for the Examination of Water and Wastewater, 23rd ed., APHA, Washington, D.C.;
- Jorgensen,J.H., Pfaller , M.A., Carroll, K.C., Funke, G., Landry, M.L., Richter, S.S and Warnock., D.W. (2015) Manual of Clinical Microbiology, 11th Edition. Vol. 1.
Crediti tabelle
- Tabella 1 e 3: scheda tecnica HIMEDIA;
- Tabella 2: scheda tecnica NEOGEN.
Crediti immagini
- Immagine in evidenza: scharlab.com
- Figura 1: scharlab.com
- 2: microbiologyinfo.com;
- 3: lumen learning;
- 4: megalab.vn.