Perché si usa?
Il Levine Eosine Methylene Blue (EMB) agar fu inventato da Holt-Harris and Teague nel 1916 come un’alternativa al terreno Endo utilizzato per l’isolamento di bacilli enterici. Per questo scopo, l’eosina ed il blu di metilene sono utilizzati per inibire la crescita di batteri gram-positivi. Oltretutto, i coloranti servono come indicatori della presenza di prodotti di fermentazione.
Per questo motivo, questo tipo di agar è un terreno sia selettivo che differenziale. Infatti, è selettivo nei confronti dei batteri Gram-negativi, permettendo la loro separazione dai batteri Gram-positivi, ed è, inoltre, utilizzato per l’isolamento e differenziazione dei coliformi e coliformi fecali.
La fonte di carboidrati è costituita da lattosio e sucrosio. Gli acidi derivati dalla loro fermentazione vengono interiorizzati dai batteri sotto forma di complessi tra eosina e blu di metilene, producendo una chiara distinzione tra batteri che possono o meno fermentare il lattosio. Conseguentemente, si raccomanda l’utilizzo di questo terreno nel caso di esami microbiologici di acqua potabile, acque reflue, prodotti lattiero-caseari ed alimenti.
Meccanismo di azione
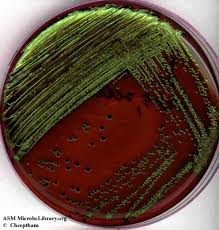
L’apparenza metallica delle colonie di E. coli è il risultato della formazione di complessi di colorante in condizioni acide. Queste ultime, infatti, sono dovuto al processo di fermentazione di batteri che possono utilizzare il lattosio. Il peso molecolare di questi complessi è di 1016, indicando che i due coloranti partecipano alla formazione dei complessi con una concentrazione di 1:1. Oltretutto, in seguito allo studio dei complessi tramite raggi ultravioletti ed infrarossi, è stato possibile capire che al centro del complesso si instaura un legame ammidico, caratterizzato da un forte assorbimento.
Contrariamente, i batteri che non fermentano il lattosio, non possono far diminuire sufficientemente il pH del terreno, inibendo, così, la formazione dei complessi tra eosina e blu di metilene.
Composizione del terreno
- Peptone 10 g/l;
- Lattosio 5 g/l;
- Sucrosio 5 g/l
- Potassio fosfato bibasico 2 g/l;
- Eosina 0.4 g/l;
- Blu di metilene 0.065 g/l;
- Agar 14 g/l;
pH finale: 7.1 ± 0.2
Preparazione del terreno
Per iniziare, sospendere i componenti del terreno in 500 ml di acqua sterile e portare ad ebollizione sotto agitazione. In seguito, controllare il pH e portare, quindi, ad un volume di 1 L con acque sterile precedentemente autoclavata. Continuare autoclavando il tutto a 121°C per 15 minuti. Aspettare che il terreno si raffreddi a circa 60°C e prima di trasferirlo in piastra, agitarlo delicatamente per ossidare il terreno e disperdere il precipitato a fiocchi formatosi durante la sterilizzazione.
Subito dopo la sterilizzazione, il colore del terreno sarà arancione, una volta raffreddato, diventerà di un colore violaceo.
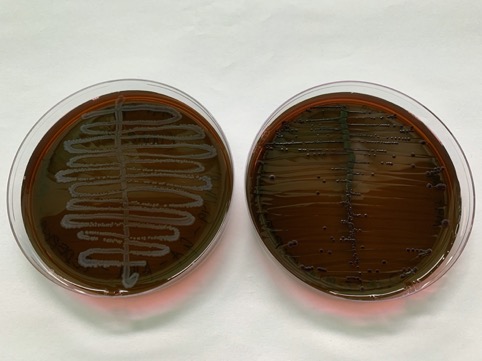
Risultati della crescita
In seguito ad incubazione delle piastre, potrete osservare la morfologia delle colonie.
| Specie batterica | Taglia delle colonie | Colore delle colonie |
| Escherichia coli | grandi | Blu/nero, verde metallico |
| Enterobacter/Klebsiella | grandi | Incolore con il centro blu/nero |
| Proteus | grandi | incolore |
| Salmonella | grandi | incolore |
| Pseudomonas | irregolari | incolore |
| Gram-positivi | Piccole o niente crescita | incolore |
Immagini

Limitazioni del terreno
Il terreno descritto presenta alcune limitazione in quanto non è possibile il suo utilizzo nel caso si debba capire quale carboidrato viene maggiormente utilizzato dal batterio (lattosio o scroscio). Per esempio, Yersinia enterocolitica fermenta il sucrosio e non il lattosio, ciò nonostante produce le stesse colonie blu-nere che producono i batteri fermentatori di lattosio. Inoltre, alcuni ceppi di Salmonella e Shigella potrebbero non crescere su questo tipo di agar.
Alcuni batteri gram-positivi, come enterococci, staphylococci e lieviti potrebbero crescere formando puntini. Inoltre, ceppi non patogeni e che non fermentano il lattosio possono crescere su questo terreno. Test biochimici supplementari dovrebbero essere conseguiti per distinguere questi microrganismi dai ceppi patogeni. Inoculazioni seriali potrebbero essere richieste per assicurare un adeguato isolamento di batteri da campioni di flora mista. Per ovviare a questo problema, nel caso si conseguano test biochimici, immunologici, molecolari o di spettrometri di massa, è raccomandato l’utilizzo di colonie derivate da una coltura pura. Fare attenzione, inoltre, che alcuni ceppi di E. coli potrebbero non formare le caratteristiche colonie verde metallico, ciò non significa che non si tratti di colonie di questa specie batterica.
Federica Angius