Perché eseguire il controllo di qualità dei terreni di coltura?
Una grande quantità di test e procedure in microbiologia dipendono dalla capacità dei terreni di coltura di fornire risultati consistenti e riproducibili. L’uso di terreni che siano conformi a specifiche stabilite è un prerequisito fondamentale per l’affidabilità di qualsivoglia analisi microbiologica. A tale scopo i Laboratori devono dotarsi di un piano di assicurazione/controllo di qualità dei terreni di coltura diversificato per tipologia (terreni in polvere o pronti all’uso) e per ambito applicativo (microbiologia clinica o microbiologia degli alimenti, acque, ambiente, o microbiologia dei farmaci).

Quadro normativo e linee guida per il controllo di qualità dei terreni di coltura.
Vista la complessità della materia, è fondamentale che i Laboratori accreditati per analisi microbiologiche e comunque tutti i Laboratori che impiegano terreni di coltura, seguano le indicazioni e le procedure per il controllo di qualità codificate nelle norme e nelle linee guida.
- Microbiologia agro-alimentare: i documenti fondamentali sono lo Standard ISO 11133 del 2014 ed i successivi adeguamenti del 2018 e 2020, raccolti nella norma UNI EN ISO 11133:2020.
- Microbiologia clinica: la linea guida principale resta il documento del Clinical Laboratory Standard Institute (CLSI): M22-A3. Importanti informazioni sui ceppi da impiegare per i terreni di ultima generazione si possono ritrovare sulle linee guida della Australian Society for Microbiology, per i terreni di coltura per la microbiologia, la micologia e per micobatteri.
- Terreni per l’esecuzione dell’antibiogramma: consultare la linea guida EUCAST.
- Microbiologia farmaceutica: le indicazioni sul controllo qualità dei terreni sono riportati sulla Farmacopea Europea.
I controlli sui terreni di coltura, così come riportati dalle norme e dalle linee guida, prevedono diversi tipi di verifiche di conformità a specifiche predefinite:
- Controlli di carattere generale sulla documentazione fornita dal produttore.
- Controlli chimico-fisici.
- Controllo della biocontaminazione.
- Controllo delle prestazioni microbiologiche (produttività, selettività, specificità, reazioni biochimiche).
Controlli di carattere generale, chimico fisici e della biocontaminazione
Controlli di carattere generale – Sono applicabili a tutte le tipologie di terreni e consistono nella verifica della documentazione fornita dal produttore: nome e codice del prodotto, numero di lotto, data di scadenza, condizioni di conservazione (luce, umidità, temperatura), pH, formulazione, uso previsto, scheda tecnica, scheda di sicurezza, certificato d’analisi che indichi i ceppi utilizzati ed i risultati delle prove con i criteri di accettazione.
Terreni pronti all’uso in piastra – Al ricevimento delle piastre l’utilizzatore deve controllare eventuali anomalie: presenza di piastre rotte, agar staccato dalla piastra, riempimento diseguale delle piastre, strato insufficiente (< 3 mm), emolisi del sangue, colore diverso dall’atteso, presenza di bolle o di una superficie irregolare, umidità eccessiva o disidratazione, precipitati, presenza di colonie (contaminazione). Tutte le piastre con caratteristiche anomale devono essere scartate ed il produttore informato.
Terreni in polvere – Quando si apre un nuovo contenitore controllare il sigillo, registrare la data della prima apertura e valutare visivamente il contenuto dei contenitori aperti. Dopo l’apertura di un nuovo contenitore, la qualità del terreno dipende dall’ambiente di conservazione. La perdita di qualità si manifesta con un cambiamento delle caratteristiche di fluidità della polvere, dell’omogeneità, del colore ecc. Qualsiasi terreno disidratato che abbia assorbito umidità o che mostri evidenti cambiamenti nell’aspetto fisico deve essere scartato.
Controlli chimico fisici dei terreni in polvere dopo la loro preparazione e distribuzione in piastra/provetta/flacone – Verificare e riportare la conformità alle specifiche per volume distribuito, colore, limpidezza, pH, forza del gel.
Controllo della biocontaminazione su piastre/provette/flaconi preparati a partire da terreni in polvere – Una quantità adeguata, a seconda delle dimensioni del lotto, deve essere testata per verificare l’assenza di contaminazione microbica (sterilità) mediante incubazione in condizioni adeguate (es. 30 ± 2°C per un minimo 48 ore). Il campione da testare deve essere di almeno un pezzo per i piccoli lotti (<100 unità). Per lotti più grandi, il Laboratorio deve redigere piani di campionamento e specifiche appropriate, in base ai componenti del terreno di coltura, ai parametri ed ai limiti del processo, al tipo di confezionamento. Un utile riferimento é la linea guida di Australian Society for Microbiology per i terreni per microbiologia che riporta i piani di campionamento e le specifiche di accettabilità per lotti superiori alle 100 unità. Ulteriori informazioni sono contenute nella norma ISO 2859-1.
Per quali terreni eseguire il controllo di qualità delle prestazioni microbiologiche?
Come noto, i terreni di coltura sono presenti sul mercato in formati diversi, sui quali il laboratorio esegue operazioni diverse:
- Terreni in polvere: richiedono una procedura di preparazione (scioglimento, sterilizzazione, aggiunta supplementi, distribuzione).
- Terreni semi-pronti in flacone: richiedono operazioni di preparazione quali scioglimento, aggiunta di supplementi, distribuzione in piastra o provetta.
- Terreni pronti in piastra, provetta e flacone: non richiedono alcuna procedura di preparazione da parte dell’utilizzatore e sono pronti per la semina.

Test da eseguire in base al formato
I terreni di coltura in polvere, dopo la loro trasformazione in piastra o provetta o flacone, richiedono l’esecuzione di un controllo di qualità delle performances in funzione dell’impiego previsto, con ceppi target e non-target, con procedure quantitative o qualitative.
Terreni semi-pronti in flacone o provetta richiedono un controllo di qualità delle performances con procedure qualitative (ISO 11133).
I terreni di coltura pronti per la semina in piastra o provetta o flacone, secondo ISO 11133, non richiedono una valutazione delle performances da parte dell’utilizzatore. L’utilizzatore deve accertarsi che il produttore operi all’interno di un Sistema di Qualità certificato e che esegua i controlli sui terreni in conformità alla norma.
I terreni di coltura pronti all’uso per la microbiologia clinica, secondo CLSI, sono suddivisi in due categorie: “exempt” e “nonexempt” sulla base delle percentuali di non-conformità ritrovate sui lotti di terreni distribuiti sul mercato americano. I terreni “exempt” possono non essere sottoposti a controllo delle performance microbiologiche, fatta eccezione per quelli impiegati per l’isolamento dei patogeni importanti (fastidious), per i quali il controllo qualità é fortemente raccomandato. I “non exempt” devono essere sempre valutati con i ceppi target e non-target indicati nella linea guida.
Controllo delle prestazioni microbiologiche: preparazione dei ceppi
Le indicazioni che seguono sono tratte da ISO 11133 e prevedono la preparazione di tre tipi di colture dei ceppi-test, con tempi di conservazione diversi: reference stock culture, stock culture e working culture.
Reference stock culture
- Ricostituire il ceppo liofilo in accordo alle indicazioni del produttore.
- Isolare il ceppo su agar sangue o su altro idoneo terreno.
- Verificare la purezza e le caratteristiche del ceppo (morfologia colonie, Gram, o identificazione con sistemi biochimici).
- Raccogliere la crescita, inserirla in un criotube, congelare a -70°C e conservare per tempi lunghi.
Stock culture
- Scongelare rapidamente la coltura stock di riferimento.
- Coltivare il ceppo su appropriato terreno (es agar sangue o Tryptic Soy Agar).
- Verificare la purezza e le caratteristiche delle colonie e utilizzarla per un periodo di tempo determinato (per esempio, 14 giorni a una temperatura adeguata ad evitare cambiamenti significativi a seconda dell’organismo).
Working culture
La working culture deve essere preparata dalla stock culture inoculando, con un’ansa da 1µL, 1 o 2 colonie in un brodo non selettivo (es. Tryptic Soy Broth) ed ottenendo una coltura stazionaria. Per la maggior parte dei batteri aerobi è sufficiente un’incubazione di 18-24 ore a 35-37°C. Utilizzare questa coltura di lavoro per un periodo di tempo specifico (ad esempio, per un massimo di tre giorni con conservazione a 2-8°C)
Preparazione delle sospensioni (inoculi) per il test
Partendo dalla working culture, preparare le diluizioni seriali in un adeguato diluente (es. soluzione di Ringer ¼, Peptone Salt Solution) e utilizzare la diluizione più adatta per ottenere il numero desiderato di organismi (Unità Formanti Colonia: UFC) in un volume specifico. Utilizzare le sospensioni entro 2 ore se mantenute a temperatura ambiente o entro 24 ore se conservate a 2-8°C °C. È possibile utilizzare inoculi congelati dimostrando che il microrganismo può sopravvivere per il periodo prescelto.
I ceppi target e non-target da impiegare per ogni singolo terreno di coltura per la microbiologia agro-alimentare sono riassunti nel documento ISO del 2020 e nel link collegato: List of control strains for performance testing of culture media and reagents. I ceppi target e non-target da impiegare per ogni singolo terreno di coltura per la microbiologia clinica sono riassunti nel documento CLSI e nelle linee guida di Australian Society for Microbiology per microbiologia, micologia e micobatteriologia e nelle linee guida EUCAST.
Controllo delle prestazioni microbiologiche: tipologie di terreni e di test
I terreni di coltura, in funzione del loro impiego e del tipo di formulazione, possono essere classificati in differenti categorie.
Tipi di terreni
- Terreni liquidi per la sospensione e la diluizione del campione (es. Peptone Salt Solution)
- Terreni liquidi per il recupero dei ceppi stressati (es. Buffered Peptone Water).
- Terreni liquidi per il pre-arricchimento (es. Tryptic Soy Broth o Buffered Peptone Water).
- Terreni liquidi per l’arricchimento selettivo (es. Selenite Broth, RVS Broth).
- Terreni d’isolamento selettivi (es. mCCDA).
- Terreni d’isolamento selettivi e differenziali (es. XLD Agar)
- Terreni d’isolamento non selettivi (es. agar sangue, Tryptic Soy Agar, CLED Agar)
- Terreni d’isolamento cromogeni e fluorogeni selettivi (es TBX Agar, EC MUG Medium).
- Terreni differenziali per i test di conferma (es. TSI Agar, Urea Agar).
- Terreni per la conta microbica, selettivi e non selettivi (es Baird-Parker Agar, Plate Count Agar).
- Terreni contenenti neutralizzanti dei detergenti e disinfettanti (es. Eugon LT Medium).
- Terreni semi-solidi di trasporto (es. Stuart o Amies).
- Terreni per la conservazione dei ceppi (es. Nutrient Agar a becco di clarino).
Tipi di test
La scelta dei ceppi, del tipo di test (quantitativo o qualitativo), le condizioni di incubazione e la definizione delle specifiche sono modulate sulla base della destinazione d’uso e delle caratteristiche indicate sopra.
La qualità di un nuovo lotto di produzione è valutata confrontandone le prestazioni con quelle di un “Lotto di Riferimento” con provate consistenti performances. Il terreno di riferimento può essere Tryptic Soy Agar o un lotto dello stesso terreno in esame approvato in precedenza. La frequenza delle prove deve essere giustificata dall’utilizzatore finale, tenendo conto del grado di preparazione del laboratorio e del livello di garanzia della qualità in vigore.
Le caratteristiche principali da testare solo la produttività, la selettività e la specificità, con metodi quantitativi o qualitativi, differenti nella loro esecuzione per terreni solidi in piastra o liquidi in provetta/flacone.
Per i terreni destinati all’enumerazione, devono essere eseguiti test quantitativi. Per gli altri terreni, possono essere sufficienti test qualitativi.
- Produttività: livello di recupero di un microrganismo target dal terreno di coltura.
- Selettività: grado di inibizione di un microrganismo non-target su o in un terreno di coltura selettivo.
- Specificità: dimostrazione che i microrganismi non-target non presentino le stesse caratteristiche visive dei microrganismi target.
Le procedure di lavoro per il controllo di qualità dei terreni di coltura sono diverse negli Standard e nelle linee guide citate. I metodi riassunti qui di seguito sono tratti dalla norma ISO 11133 e sono quindi applicabili ai terreni destinati alla microbiologia agro-alimentare ed ambientale. I metodi per i terreni destinati all’esame di campioni di origine umana ed all’esame dei prodotti farmaceutici sono, generalmente, più semplici. Per la loro descrizione si rimanda alla bibliografia citata.
Controllo delle prestazioni microbiologiche: test quantitativo per terreni solidi in piastra

Produttività
Questo protocollo richiede l’uso di una sospensione batterica quantificata (che può essere un materiale di riferimento quantitativo o un inoculo preparato dalla working culture e quantificato). I metodi previsti per il test quantitativo devono consentire il conteggio delle colonie.
La sospensione microbica deve essere seminata e distribuita sull’intera superficie della piastra o seminata per inclusione o filtrata su membrana che viene depositata sulla piastra. Altri metodi di semina sono: Modified Miles-Misra, spiral plater. Il metodo di semina è definito in funzione del terreno da controllare.
Seminare una o più piastre del lotto in esame e del terreno di riferimento con un volume appropriato della sospensione microbica, tarata con una carica tra 80 e 120 UFC. Il volume dell’inoculo varia al variare del metodo di semina e deve rispecchiare il metodo d’analisi nel quale il terreno è previsto. Il risultato di produttività è giudicato conforme se il rapporto tra UFC del lotto in esame e UFC del terreno di riferimento è:
- ≥ 0,5 per terreno selettivo rapportato ad un terreno di riferimento non selettivo
- ≥ 0,7 per terreno non selettivo rapportato ad un terreno di riferimento non selettivo o per terreno selettivo rapportato al terreno di riferimento selettivo dello stesso tipo.
- Se il rapporto dovesse superare 1,4 si deve identificare le cause di tale anomalo valore.

Selettività
Il terreno di riferimento non selettivo ed il terreno selettivo in esame sono inoculati con le diluizioni decimali dei ceppi non-target. Il fattore di selettività é calcolato con la seguente formula: più alta diluizione che mostra una crescita sul terreno di riferimento non selettivo – più alta diluizione che mostra una crescita comparabile sul lotto di terreno selettivo in esame. Il risultato di selettività è giudicato conforme se tale differenza, calcolata per i ceppi non-target, è ≥ 2.
Specificità
La specificità del terreno di coltura è data da caratteristiche fisiologiche indicative essenziali per differenziare organismi affini in base alla presenza, all’assenza e/o al grado di espressione delle risposte biochimiche e alle dimensioni ed alla morfologia delle colonie.
Controllo delle prestazioni microbiologiche: test qualitativo per terreni solidi
La produttività e la specificità sono valutate utilizzando una piastra di terreno di coltura e strisciando il microrganismo in modo da ottenere colonie discrete (es. ecometria). Il volume dell’inoculo deve contenere da 103 a 104 UFC.

La selettività è valutata utilizzando una piastra di terreno di coltura e strisciando ogni microrganismo in una singola linea retta sulla superficie del terreno di coltura, utilizzando un’ansa da 1 µI . Il volume dell’inoculo deve contenere da 104 a 106 UFC. Diversi microrganismi in esame possono essere strisciati sulla stessa piastra come linee parallele senza incrociarsi; le striature devono essere distinguibili per consentire l’osservazione della morfologia tipica. È possibile utilizzare altri metodi d’inoculo standardizzati.
Incubare le piastre nelle condizioni definite dallo standard internazionale specifico. La quantità di crescita sulle piastre dopo l’incubazione viene valutata come segue:
- 0: corrisponde a nessuna crescita;
- 1: corrisponde a una crescita debole (riduzione della quantità di crescita o delle dimensioni delle colonie);
- 2: corrisponde a una buona crescita.
I microrganismi target devono ottenere un punteggio di 2 e presentare aspetto, dimensioni e morfologia delle colonie tipici.
Per i test di selettività, il grado di inibizione dipende dal tipo di terreno. La crescita dei microrganismi non-target deve essere parzialmente o completamente inibita (punteggio 0 o 1).
Controllo delle prestazioni microbiologiche: test quantitativo per terreni liquidi
Questa procedura si applica ai terreni liquidi selettivi e non selettivi ed ai brodi per eseguire determinazioni quantitative con metodo MPN.
Produttività e selettività
- Preparare una serie di diluizioni decimali a partire dalla sospensione “working culture” dei ceppi target e non-target (es. da 10-1 a 10-10).
- Al momento dell’uso, trasferire un volume noto (es. 0,1 ml) di ciascuna diluizione sulla superficie di una piastra di un terreno non selettivo (es. Tryptic Soy Agar) e distribuire l’inoculo.
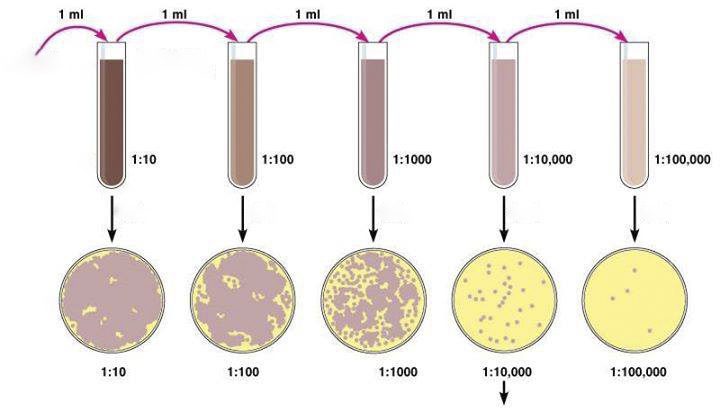
- Incubare in condizioni adeguate al ceppo in questione.
- Contare il numero di colonie sulle piastre di agar alla diluizione più bassa contenente fino a 150 UFC e il numero di colonie alle diluizioni superiori e registrare.
- Selezionare lo stesso numero di provette di terreno in esame corrispondente al numero di provette delle diluizioni seriali scelte.
- Utilizzando le diluizioni preparate come descritto sopra e iniziando dalla diluizione più alta, inoculare un volume noto di sospensione del ceppo (es. 0,1 ml) nelle provette del terreno in esame.
- Incubare le provette nelle condizioni descritte nella norma internazionale pertinente.
- Dopo l’incubazione, effettuare la subcultura in un terreno solido non selettivo utilizzando un’ansa da 10 µI.
- Incubare le piastre inoculate in condizioni adeguate all’organismo. Dopo l’incubazione, esaminare ogni piastra per verificare la presenza o l’assenza di crescita.
Per i ceppi target, di solito è sufficiente utilizzare le diluizioni da 10-5 a 10-8. Per i ceppi non-target, di solito è sufficiente utilizzare le diluizioni da 10-1 a 10-4.
Produttività
La produttività del terreno liquido è soddisfacente se si ottiene una buona crescita (almeno 10 UFC da un’ansa di 10 µl) del ceppo target dalla diluizione che produce meno di 100 UFC (in 0,1 ml) sulla piastra.
Selettività
Per i terreni liquidi selettivi, determinare il fattore di selettività (Sp) dalla diluizione più alta della working culture che mostra una buona crescita (almeno 10 UFC) sulla piastra di terreno non selettivo e dalla diluizione più alta del terreno liquido selettivo inoculato che non mostra crescita (o meno di 10 UFC) del ceppo non-target sulla piastra di terreno selettiva. La differenza tra le due diluizioni (Sp) deve essere di almeno 2.
Controllo delle prestazioni microbiologiche: test qualitativo con singola provetta per terreni liquidi
Il metodo è adatto per testare le prestazioni dei terreni di coltura liquidi non selettivi e dei brodi selettivi utilizzati per i test di conferma (es. Brilliant Green Bile Broth 2%). Il metodo è solo qualitativo e i punteggi sono quindi solo indicativi. I terreni intrinsecamente torbidi possono essere testati con questo metodo solo se sub-coltivati in un terreno solido per dimostrare la crescita.
Punteggi di crescita
- 0 : equivale a nessuna torbidità;
- 1 : equivale a una leggera torbidità;
- 2: equivale a buona torbidità.
Procedura
Selezionare un certo numero di provette contenenti ciascuna 10 ml di terreno o porzioni da 10 ml di ogni lotto da analizzare.
Per testare le prestazioni dei terreni di pre-arricchimento, ad esempio l’acqua peptonata tamponata, inoculare il terreno con un volume di inoculo appropriato contenente < 100 UFC direttamente nel terreno in esame.
Per testare le prestazioni dei brodi selettivi di conferma inoculare il terreno in esame con una sospensione contenente > 106 UFC/ml, utilizzando un’ansa da 1 µl.
- Incubare la provetta nelle condizioni definite dallo standard internazionale specifico
- Esaminare il terreno di coltura per verificare la crescita.
- La valutazione qualitativa deve essere effettuata visivamente. I microrganismi target devono ottenere un punteggio di 2.
La valutazione qualitativa dei terreni opachi è indicata dalla presenza di crescita sul terreno solido.
A volte la crescita dei microrganismi può essere osservata solo come aggregazione/deposito di cellule alla base della provetta o della bottiglia. In questo caso, un’attenta agitazione può migliorare la valutazione e l’interpretazione.
Con questo metodo si possono valutare anche altre caratteristiche, come la formazione di gas e il cambiamento di colore. La norma ISO 11133 descrive altri due metodi per il controllo qualitativo dei terreni liquidi (diluizioni ad estinzione per terreni non selettivi e selettivi e test qualitativo in provetta solo per terreni selettivi). Per la loro descrizione si rimanda allo Standard citato.
Controllo qualità dei terreni di coltura: conclusioni
La natura delle refertazioni di un laboratorio di microbiologia dipende dalla qualità dei terreni di coltura utilizzati. La loro qualità influisce direttamente sulle osservazioni delle caratteristiche culturali dei microrganismi presenti nei campioni. Il controllo di diversi parametri, come le prestazioni microbiologiche, le caratteristiche chimico-fisiche e la contaminazione dei lotti, è lo strumento che aiuta a valutare la qualità dei terreni. Esistono diversi metodi per controllare sistematicamente tutti questi parametri. Il tempo dedicato a garantire le prestazioni dei terreni di coltura sarà ampiamente ripagato in termini di riproducibilità dei dati e di riduzione del tempo dedicato alle indagini sui risultati non conformi.
Fonti
- ISO 11133:2014 Microbiology of food, animal feed and water — Preparation, production, storage and performance testing of culture media.
- ISO 11133:2014/Amd 1:2018 Microbiology of food, animal feed and water — Preparation, production, storage and performance testing of culture media — Amendment 1.
- ISO 11133:2014/Amd 2:2020 Microbiology of food, animal feed and water — Preparation, production, storage and performance testing of culture media — Amendment 2.
- UNI EN ISO 11133:2020 Microbiologia di alimenti, mangimi per animali e acqua – Preparazione, produzione, immagazzinamento e prove di prestazione dei terreni colturali.
- Clinical & Laboratory Standards Institute (CLSI). M22 A3: QC for Commercial Microbiological Culture Media, 3rd Edition.
- The Australian Society for Microbiology. Australian Guidelines for the Quality Assurance of medical microbiological culture media. 2nd edition, 2012.
- The Australian Society for Microbiology. Australian Guidelines for the Quality Assurance of medical mycological culture media, 2012.
- The Australian Society for Microbiology. Australian Guidelines for the Quality Assurance of solid media used in Australia for the cultivation of medically important mycobacteria, 2nd edition, 2012.
- European Pharmacopoeia 11th Edition, 2022, Vol. 1; 2.6.13 Microbiological Examination of non-sterile products: test for specified micro-organisms: 01/2021:20631.
- European Committee on Antimicrobial Susceptibility Testing. Routine and extended internal quality control for MIC determination and disk diffusion as recommended by EUCAST Version 13.2, valid from 2023-06-29.
- ISO 2859-1:1999. Sampling procedures for inspection by attributes — Part 1: Sampling schemes indexed by acceptance quality limit (AQL) for lot-by-lot inspection.
- ISO/TC 34/SC 9 Food products – Microbiology. ISO 11133 on culture media. 21 October 2020.
- ISO/TC 34/SC 9 Food products – List of control strains for performance testing of culture media and reagents, table revised 2022-12-06.
Crediti immagini
- Immagine in evidenza: ATCC
- Figura 1: IStock
- Figura 2: International Standard Organisation
- Figura 3 e 4: Biolife
- Figura 5: Microbes Notes
- Figura 6: SlideShare
- Figura 7: Microbe Online
- Figura 8: Pearson Education Inc.
