Perché si usa?
Negli ultimi anni si evidenzia un aumento della resistenza agli antibiotici da parte di batteri come Escherichia coli o Klebsiella pneumoniae, coinvolti nella maggior parte delle infezioni nosocomiali e/o comunitarie.
In precedenti articoli, si é parlato del gruppo ESKAPE (acronimo di Enterococcus faecium, Staphylococcus aureus, Klebsiella pneumoniae, Acinetobacter baumannii, Pseudomonas aeruginosa, Enterobacter spp), ovvero un gruppo di patogeni con un nome nome evocativo che ricorda la parola inglese “fuggire” e che fa riferimento alla capacitá che questi hanno di scappare, appunto, all’azione degli antibiotici.
Peró, uno degli aspetti cruciali del fenomeno di antibiotico-resistenza é la capacitá che alcuni gram negativi, appartenenti alla famiglia delle Enterobacteriaceae, hanno sviluppato verso farmaci ad amplio spettro come i carbapenemici, utilizzati nel trattamento di infezioni gravi e spesso considerati come una “ultima spiaggia” nel caso di fracasso di altri composti.
Questo fenomeno, insieme alla mancanza di nuovi trattamenti, hanno stimolato la creazione di nuovi algoritmi terapeutici e di mezzi di coltura che aiutino a ottenere risultati nel minor tempo possibile, identificando con viraggio di cromogeni tali microorganismi. Uno di questi mezzi é il CHROMID® Carba, terreno solido selettivo e differenziale per l’identificazione di E. coli e K. pneumoniae produttori di carbapenemasi, il quale giá é stato descritto in un altro articolo. Un altro di tali terreni dediti all’identificazione di Enterobacteriaceae resistenti alle carbapenemasi, ma con obiettivo piú selettivo é ChromID® CARBA SMART Agar, costituito da due terreni di coltura cromogenici (CARB/OXA) distribuiti sulle due metà di un’unica piastra Petri.
Composizione del terreno
Gli ingredienti base del ChromID carba smart, divisi secondo le due metá del terreno, sono i seguenti:
- Metá CARB
- Peptone di caseina (5 g), di origine bovina o suina (8 g) e di origine vegetale 5 g
- Carboidrati 1 g
- L-triptofano 0,9 g
- Tampone fosfato 1 g
- Miscela cromogenica 1,4 g
- Mezzo nutritivo 2,8 g
- Miscela selettiva CARB 0,3 g
- Agar 18 g
- Acqua purificata 1L
2. Terreno OXA
- Peptone di caseina (5 g), di origine vegetale (5 g) e di origine bovina o suina (8 g)
- Carboidrati 1 g
- L-triptofano 0,9 g
- Tampone fosfato 1 g
- Miscela cromogenica 1,4 g
- Mezzo nutritivo 2,8 g
- Miscela selettiva OXA 0,88
- Agar 18 g
- Acqua purificata 1L
Il terreno ha un pH finale di 7,4. Si conserva a 2/8 °C, visto che viene giá fornito come terreno solido. É importante mantenerlo al buio, onde evitare la degradazione del reattivo cromogenico. Non é consigliato utilizzarlo se non mantenuto alle condizioni ottimali.
Risultati della crescita
Il vantaggio del chromID® CARBA SMART Agar sulla sua versione base (CHROMID® Carba) si basa sulla capacitá di discriminare selettivamente, grazie alla presenza di una miscela di antibiotici, principalmente:
- Resistenza dovuta a KPC e metallo-carbapenemasi, nella metá del terreno denominata CARB.
- Resistenza dovuta a meccanismi di tipo OXA-48, nella metá denominata OXA.
In piú, contiene tre substrati cromogenici che permettono l’identificazione delle Enterobacteriaceae carbapeemici-resistenti più frequentemente isolate. Per esempio, E. coli produttore di ß-glucuronidasi (ß-GUR) e/o ß-galattosidasi (ß-GAL) (colorazione spontanea da rosa a bordeaux) o Klebsiella sp, Enterobacter sp, Serratia sp, Citrobacter sp (da verde-bluastro a grigio-bluastro o violaceo dei ceppi che producono ß-glucosidasi).
Immagini
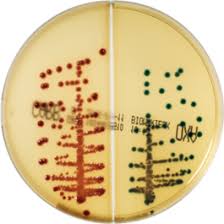

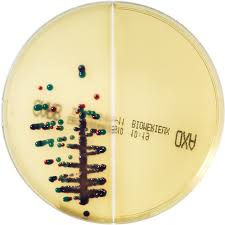

Validazione del terreno
Il terreno CHROMID® Carba SMART é adatto per investigare la presenza di patogeni produttori di carbapenemici, che colonizzano il paziente. Si possono utilizzare i tamponi rettali e campioni clinici di feci, inoculandoli direttamente sull’agar senza necessitá di arricchire previamente la coltura in mezzo liquido. L’incubazione viene fatta a 35ºC ±2ºC, per 18-24 ore.
Dopo l’identificazione su CHROMID® Carba agar, é consigliato effettuare una sub-cultura e determinati test di sensibilitá agli antibiotici per confermare i risultati e fornire un diagnostico corretto.
Per validare il mezzo, sono stati utilizzati ceppi OXA-48, varianti di OXA-48 (classe D di Ambler) e ceppi non OXA, in coltura pura.
Sono stati effettuati test anche in colture miste, per validare la capacitá di identificare infezioni polimicrobiche dovute a microorganismi multiresistenti. Per maggiori informazioni sul tipo di esperimenti, validazione e sensibilitá/specificitá del terreno si puó fare riferimento al datasheet:
Raffaella Onori, PhD
Fonti
- https://www.researchgate.net/publication/301221943_Comparison_of_two_selective_media_for_the_detection_of_Carbapenemase-producing_Enterobacteriaceae_using_direct_plating_and_selective_broth_enrichment
- http://www.biomerieux-culturemedia.com/product/99-chromid-carba-smart
- http://bsac.org.uk/wp-content/uploads/2012/02/BSAC-Userday-John-Perry.pdf
- Onori, R., Gaiarsa, S., Comandatore, F., Pongolini, S., Brisse, S., Colombo, A., … & Bandi, C. (2015). Tracking nosocomial Klebsiella pneumoniae infections and outbreaks by whole-genome analysis: small-scale Italian scenario within a single hospital. Journal of clinical microbiology, 53(9), 2861-2868.
- Lee, S. Y., Octavia, S., & Chew, K. L. (2019). Detection of OXA-carbapenemase-producing Enterobacteriaceae with chromID CARBA SMART screening plate. Pathology, 51(1), 108-110.