Caratteristiche generali
Ci sono diversi metodi che permettono la misura del pH. Il pH-metro é uno di questi ed è tra i più comuni. È uno strumento elettronico che misura il pH in campioni liquidi, semi solidi e solidi con elevata precisione.
Può essere da banco oppure portatile, quest’ultimo utilizzato direttamente sul campo durante la fase del prelievo campione (vedi Fig. 1 e Fig. 2).
Il pH-metro è costituito da un voltmetro collegato ad un elettrodo di misura (con potenziale variabile) e ad un elettrodo di riferimento (con potenziale costante). I due elettrodi agiscono come una batteria. Alla fine della rilevazione, si ottiene il potenziale dell’elettrodo di misura. Il voltmetro è in grado di fornire il valore direttamente in unità di pH.
A causa della difficoltà dell’impiego pratico dell’elettrodo a idrogeno, l’elettrodo di misura più comunemente usato è l’elettrodo di vetro. Uno dei principali vantaggi di questo tipo di elettrodo è che soluzioni altamente colorate non interferiscono con la misura. Inoltre l’elettrodo di misura deve:
- Rispondere in modo rapido e riproducibile alle variazioni di concentrazione dell’analita.
- Essere specifico per l’analita.
L’elettrodo di riferimento, invece, può essere a Calomelano saturo (SCE) oppure a Cloruro di Argento (Ag/AgCl). Quest’ultimo è costituito da un filo in Argento rivestito da un deposito di AgCl, e immerso in una soluzione acquosa satura di KCl (elettrolita).
Elettrolita
È una soluzione salina molto concentrata dove è immerso l’elettrodo di riferimento. Può essere liquido, gel o solido a seconda del tipo di elettrodo. Elettroliti liquidi sono di solito soluzioni di Cloruro di Potassio (KCl), e in questo caso gli elettrodi hanno un orifizio di riempimento per ripristinare il livello dell’elettrolita.
Elettrodo combinato
Nel 1948 il dott. Ingold realizzò il primo elettrodo combinato. Unì i due elettrodi (di misura e di riferimento) fino a formarne uno unico.
La maggior parte degli elettrodi odierni sono compatti, robusti e semplici da utilizzare. Negli ultimi anni hanno fatto la loro comparsa gli elettrodi combinati con sensore di temperatura incorporato. Ciò consente la misura del pH e della temperatura simultaneamente nello stesso punto. Questa evoluzione risulta particolarmente importante nella calibrazione dello strumento.
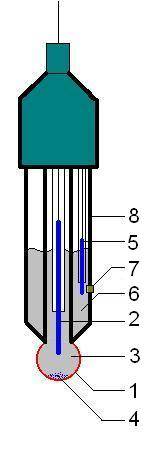
In generale, gli elettrodi combinati sono costituiti da un corpo cilindrico di vetro. Terminano con il bulbo di vetro che è la parte attiva, grazie al quale l’elettrodo percepisce le variazioni di concentrazione degli ioni H+ nel campione da testare (vedi Fig. 3).
Bulbo
Il bulbo è costituito da una membrana molto sottile che riduce la resistenza elettrica. La membrana del bulbo è un vetro di silicati con spessore inferiore a 100 micron ed è costituita da un insieme infinito di tetraedri di SiO44-. Le cariche negative sono bilanciate da cationi (Ca2+, Na2+) che sono contenuti negli interstizi del reticolo. La membrana di vetro è così in grado di scambiare ioni H+ con il campione con cui viene in contatto. Per fare ciò, il vetro deve essere idratato.
La misura si ottiene grazie al potenziale elettrochimico che si viene a creare sui due lati (interno ed esterno all’elettrodo), detto potenziale di membrana esprimibile con un’equazione simile all’equazione di Nernst. In questo modo, si valuta l’alcalinità (pH>7) o l’acidità (pH<7) del campione in esame.
L’estremità dell’elettrodo può avere configurazioni e dimensioni diverse per consentire di scegliere l’elettrodo più opportuno.
- Punta a sfera: è ideale per le soluzioni acquose o comunque liquide. L’estremità a sfera consente di avere un’ampia superficie di contatto con il campione di misura.
- Punta conica: molto adatta per misure in prodotti semi solidi, emulsioni, formaggi, carni ed alimenti in genere.
- Punta piatta: ideale per superfici, per misure dirette su cute, pelli, carta, ecc.
Diaframma
È il punto di unione tra l’elettrolita e il campione. Può essere smerigliato, ceramico, ecc.
Applicazioni strumentali
Il pH-metro può essere utilizzato in diversi ambiti, qua sotto in parte riportati:
- Settore farmaceutico
- Ambito agricolo (suolo)
- Settore ambientale (si misura il pH nelle acque reflue e nelle acque potabili)
- Settore alimentare (si misura l’acidità del vino e dei formaggi)
- Aziende di prodotti chimici
- Settore microbiologico (si misura il pH dei terreni di coltura).
Funzionamento del pH-metro
Per effettuare la misurazione correttamente, inserire l’elettrodo combinato all’interno del campione ad una profondità tale da immergere il diaframma. Attendere qualche minuto prima di ottenere il valore di pH finale.
Calibrare significa comunicare allo strumento le specifiche caratteristiche dell’elettrodo che stiamo utilizzando in quel momento. Per la calibrazione si utilizzano delle soluzioni di riferimento a pH noto (buffer o tamponi). Il primo buffer da utilizzare è sempre quello con pH neutro pari a 7. La calibrazione va fatta utilizzando i buffer di pH che comprendono l’intervallo di misura del campione. Utilizzare solo soluzioni fresche. È importante prevenire le contaminazioni utilizzando un beaker per il risciacquo e un altro per la calibrazione per ogni buffer. Non esistono regole universali sulla frequenza di calibrazione, ma possiamo comunque dare alcuni consigli:
- Se l’utilizzo è giornaliero, allora l’ottimale è la calibrazione giornaliera oppure una volta a settimana.
- Se l’utilizzo è settimanale, allora calibrare ogni inizio settimana.
- Con l’utilizzo sporadico, è consigliata la calibrazione prima di ogni misura.
Limiti dello strumento
I pH-metri possono essere molto pratici e tascabili; tuttavia quelli da banco sono sicuramente strumenti più ingombranti e poco economici. Se si vuole ottenere la misura in tempi rapidi è consigliabile l’utilizzo della cartina tornasole, metodo molto più economico.
Precauzioni di utilizzo
È importante verificare le condizioni dell’elettrodo. Si può verificare manualmente rilevando i mV a pH 7 e a pH 4. A questo punto è possibile calcolare la % di slope con la formula seguente: [(mVpH4 – mVpH7 / 3) / 59,16] * 100. Valori accettabili di solito sono tra l’85 e il 100%. Gli strumenti più moderni fanno questo calcolo in automatico, controllando così lo stato dell’elettrodo.
L’elettrodo non deve essere conservato all’asciutto, e nemmeno in acqua deionizzata o demineralizzata, perché questo potrebbe provocare letture non accurate. L’elettrodo deve essere conservato in apposita soluzione di conservazione.
L’acqua deionizzata o demineralizzata può essere utilizzata solo per i risciacqui intermedi dell’elettrodo. Si sconsiglia invece la pulizia tramite strofinamento, perché essa provoca:
- Una carica elettrostatica che interferisce con la lettura.
- L’usura degli strati sensibili del vetro che compongono il bulbo.
Il basso livello dell’elettrolita liquido all’interno dell’elettrodo di riferimento, causa l’interruzione del contatto elettrico con la soluzione campione per mezzo del diaframma poroso. Ricordarsi di ripristinare il livello tramite il foro di riempimento, di solito presente all’estremità opposta rispetto al bulbo dell’elettrodo.
Infine, per una corretta misura di pH bisognerebbe mantenere il campione in agitazione sull’agitatore magnetico.
Immagini


Fonti
- microbenotes.com
- britannica.com
- hanna instruments
- zetalab
- università Trieste
- Mario Schiavello Leonardo Palmisano Fondamenti di chimica 4° edizione, Edises ISBN-10 8879597825.
Crediti delle immagini
Immagine in evidenza
Figura 1
Figura2
Figura3
Gentile d.ssa Caso, volevo chiederle se il calibrare solo con soluzione acido 4.1 possa portare a misure molto sbagliate di ph maggiori di 4. Esempio 5 o 6. Grazie mille