Plasmodium falciparum è una delle specie di plasmodio responsabili della malaria. Ad oggi sono cinque le specie appartenenti al genere Plasmodium responsabili della malaria. Fu il medico francese Charles Louis Alphonse Laveran (Figura 1), in un ospedale militare in Algeria nel 1880 ad individuare la forma sessuata del plasmodio.



Nel 1885, i medici Ettore Marchiafava e Angelo Celli (Figura 1) battezzarono il parassita con il nome di “Plasmodium” e dimostrarono che questo si accresce nel globulo rosso trasformando l’emoglobina in un pigmento nero e si divide poi in piccoli corpi che invadono altri globuli rossi. Nel 1889, fornirono una descrizione di P. falciparum.
Caratteristiche
Plasmodium falciparum è un protozoo parassita unicellulare obbligato. Il ciclo vitale è possibile suddividerlo in ciclo asessuato o “schizogonico” che si svolge nell’ospite umano, dove si formeranno i gametociti e in ciclo sessuato o “sporogonico” nell’insetto vettore, la zanzara Anopheles nel cui stomaco, maturano i gameti che contribuiranno alla formazione dello zigote (oocisti). Questo zigote che contiene numerosi sporozoiti che una volta rilasciati, raggiungeranno le ghiandole salivari della zanzara. Durante il prossimo pasto di sangue, necessario per la zanzara per lo sviluppo delle uova, gli sporozoiti verranno rilasciati nel torrente ematico del prossimo ospite per dare nuovamente inizio al ciclo.
Filogenesi
| Dominio | Eukaryota |
| Regno | Protista |
| Sottoregno | Chromalveolata |
| Phylum | Apicomplexa |
| Classe | Aconoidasida |
| Ordine | Haemosporida |
| Famiglia | Plasmodiidae |
| Genere | Plasmodium |
| Sottogenere | Laverania |
| Specie | P. falciparum |
Caratteristiche strutturali
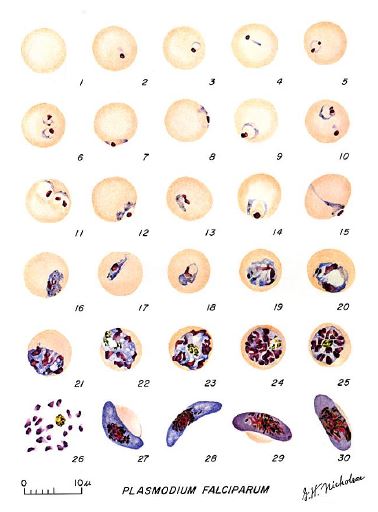
Plasmodium falciparaum durante il proprio ciclo vitale subisce diversi stadi di sviluppo. Nel ciclo schizogonico, in particolare durante il ciclo eritrocitario, che avviene nell’ospite umano il protozoo subisce ben quattro stadi di sviluppo (Figura 2). Queste differenze permettono di distinguere tra le diverse specie di Plasmodium.
| Fase ad anello | Così definita perché al microscopio ottico, il globulo rosso assume la forma di un anello. Questo è più piccolo rispetto alle altre specie. Questa fase dura circa 12 h per il P. falciparum. Il parassita occupa solo 1/3 del volume totale dell’eritrocita. Il protoplasma all’altra estremità del nucleo è più spesso e blu, mentre il nucleo è rosso. Nella parte centrale c’è un vacuolo incolore pieno di liquido nucleare. |
| Trofozoita | Il parassita cresce, si estende in tutto l’eritrocita, assumendo una forma più regolare. Il nucleo è grande. Il pigmento di melanina è abbondante e uniformemente diffuso. |
| Schizonte | Raramente è osservabile in Plasmodium falciparum, questo indica la presenza di un’infestazione più acuta. Il nucleo inizia a dividersi in 2, 3, 4 e 6 nuclei. |
| Fase a rosetta | I nuclei sono divisi al massimo (16-24). A volte possiamo anche vedere la divisione del protoplasma che circonda ogni nucleo, con conseguenti merozoiti con diametro 40-80μm che si posizionano alla periferia del parassita, su diversi piani, dando alla rosetta un aspetto multiforme. La durata della fase pre-rosetta e rosetta è di 8 ore e la durata dell’intero ciclo schizogonico è di 48 ore |
| Gametocita | Sono forme molto grandi che occupano l’intera l’emazia, spesso la deformano in maniera caratteristica. Il nucleo è composto da una grossa massa di cromatina più o meno compatta, di forma tondeggiante o allungata. Sono molto evidenti i granuli di pigmento. |
Patogenesi
Plasmodium falciparum presenta un ciclo complesso e, come già anticipato, si suddivide in un ciclo asessuato (schizogonico) e sessuato (sporogonico) (Figura 3).
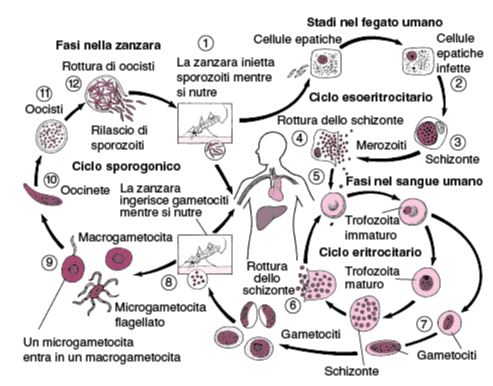
Ciclo schizogonico di Plasmodium falciparum
Il ciclo schizogonico inizia con la puntura dell’insetto vettore che inocula gli sporozoiti nell’individuo. Tuttavia è necessario precisare che affinché la zanzara possa essere effettivamente vettore della malaria è necessario che avvenga il completamento del ciclo sporogonico al suo interno.
Gli sporozoiti entrano all’interno dell’epatocita dove il plasmodio si accrescerà per schizogonia (tipo di riproduzione assessuata), portando alla formazione dei schizonti che richiedono un tempo di maturazione compreso tra 5-11 giorni, dai quali fuoriusciranno i merozoiti.
Poi ha inizio la fase che viene definita “fase eritrocitaria” poiché ha luogo nei globuli rossi. I merozoiti grazie all’interazione con i recettori di membrana riconoscono i globuli rossi. Qui il plasmodio si accresce attraverso diverse fasi di sviluppo, all’interno dell’eritrocita. Oltretutto nel ciclo schizogonico possono formarsi i gametociti che presentano, nel caso di Plasmodium falciparum una caratteristica forma a falce. Il ciclo terminerà poi nella zanzara di sesso femminile del genere Anopheles.
La zanzara Anopheles
Nel 1898, il medico Giovanni Battista Grassi identificò Anopheles claviger come vettore e nell’anno seguente con la collaborazione di Amico Bignami e Giuseppe Bastianelli appurarono la necessità dell’insetto vettore per il plasmodio della malaria per completare il proprio ciclo vitale. Tuttavia nello stesso periodo Ronald Ross effettuava i medesimi studi sulla trasmissione del plasmodio tramite la zanzara Anopheles. Nacque così una disputa sulla rivendicazione della scoperta che andò a favore di Ross che vinse nel 1907 il premio Nobel (Figura 4).




La malaria viene trasmessa attraverso il morso della zanzara appartenente al genere Anopheles. Anopheles gambiae (Figura 5) rappresenta uno dei vettori maggiormente conosciuti. Le specie che costituiscono un vettore di questo protozoo sono circa 60; tuttavia solo 30 di queste sono vettori importanti di malaria.

Sono insetti olometaboli, cioè presentano un ciclo che comprende più stadi prima dello sviluppo ad individuo adulto. Il ciclo di sviluppo delle zanzare si svolge in quattro fasi: uova, larva, pupa ed adulto. Affinché le uova si possano sviluppare l’esemplare femmina, ematofaga, dopo la copula, deve effettuare un “pasto di sangue” da un vertebrato, perché il sangue contiene le proteine necessarie per lo sviluppo delle uova. Le uova per schiudersi necessitano di un bacino d’acqua, dalle quali emergeranno le larve che impupadonsi daranno origine all’individuo adulto. Gli adulti vivono in media da pochi giorni (i maschi) a diverse settimane (le femmine). Le abitudini di puntura delle Anopheles sono crepuscolari e notturne, ore in cui in zone di endemia è più alto il rischio di contrarre la malaria.
Ciclo sporogonico di Plasmodium falciparum
I macrogametociti formatosi nell’individuo infetto e succhiati della zanzara portano alla formazione dei microgametociti che si formano per esfoliazione. Questi migrano attraverso la parete intestinale dell’insetto per formare ovociti ovoidi sulla superficie esterna. L’oocista produce migliaia di sporozoiti lunghi e sottili (~15μm di lunghezza), che alla fine infettano le ghiandole salivari.
L’oocisti si accresce in funzione della temperatura e dell’umidità esterna (valori medi per la temperatura 20-30°C e per l’umidità 60%) raggiungendo 48-80 micron di diametro. Il nucleo si divide attivamente formando 10.000 sporozoiti mobili che rompono la parete dell’oocisti e della lamina basale e sono rilasciati nell’emocele da dove raggiungono le ghiandole salivari e da qui sono iniettati nell’ospite vertebrato.
Manifestazioni cliniche della malaria
Le manifestazioni comuni (Figura 6) sono le seguenti:
- Febbre e brividi intensi (parossismo malarico);
- Anemia;
- Ittero;
- Splenomegalia.
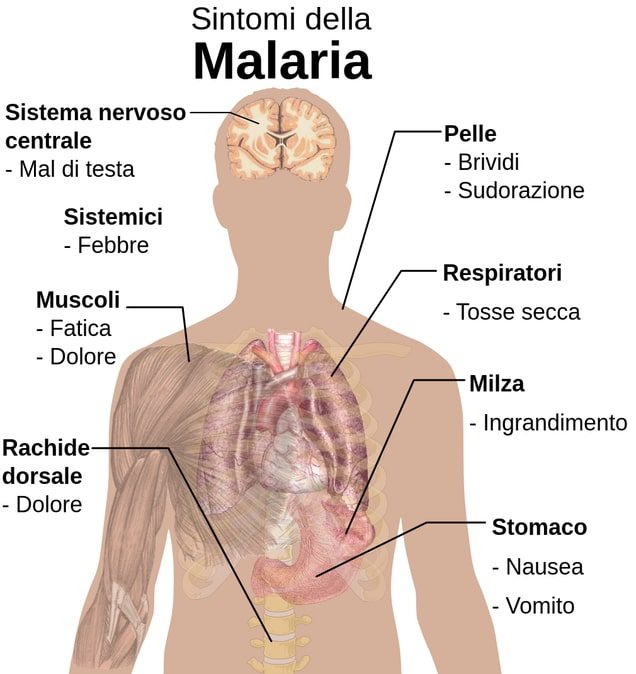
Il parossismo malarico coincide con il rilascio di merozoiti per la rottura dei globuli rossi. Questo è dovuto al rilascio nel momento della lisi, dei cataboliti intrappolati all’interno dell’emazia che provocano le cosiddette “febbre malariche”. Le febbre malariche possono essere suddivise in quartane o terzane, in base al ciclo vitale del parassita. Il classico parossismo malarico inizia con malessere, brivido brusco e febbre che sale fino a 39-41°C, poliuria, cefalea, mialgia e nausea. Dopo 2-6 h, la febbre scende, e si verifica sudorazione profusa per 2-3 h, seguita da estrema debolezza fisica. La febbre all’inizio dell’infezione è spesso ricorrente.
L’aumento di volume della milza con Plasmodium falciparum può anche non verificarsi. Tuttavia le complicazioni possono essere maggiori per gli effetti che questa specie di plasmodio ha nei confronti del circolo microvascolare provocandone istruzione. Questo perché i globuli rossi aderiscono alle cellule endoteliali vascolari, generando ischemia, e conseguente ipossia tissutale a livello cerebrale, renale, polmonare e del tratto gastrointestinale.
Epidemiologia
Il 25 Aprile è stato il giorno mondiale contro la Malaria, istituito nel 2007 dall’Organizzazione Mondiale della Sanità. Secondo il Word malaria report 2019, non sono stati raggiunti i risultati prefissati. Secondo questo rapporto ci sono stati 228 milioni di casi di malaria rispetto ai 231 milioni casi pervenuti nel 2017. Le morti registrate nel 2018 hanno un subito leggero decremento attestandosi a circa 405.000 morti rispetto ai 416.000 morti del 2017 (Figura 7).

Nel 2018 Plasmodium falciparum è stato responsabile del 99,7% dei casi di malaria nel regione africana, 50% nella regione del sud-est asiatico, 71% nella regione orientale del Mediterraneo e 65% nella regione del Pacifico occidentale. Il gruppo di bambini al di sotto dei cinque anni è stato quello più vulnerabile, nel 2018 hanno rappresentato il 67% dei morti in tutto il mondo.
Metodi di identificazione
La diagnosi di Plasmodium falciparum può essere effettuato attraverso l’uso di:
- Microscopia ottica dello striscio di sangue;
- Test diagnostici rapidi in grado di rilevare Ag o enzimi del Plasmodium nel sangue.
Lo striscio di sangue da individuo affetto da malaria provocata da Plasmodium falciparum presenta alcune caratteristiche elencate qui di seguito:
- Non c’è aumento del volume dei globuli rossi;
- Globuli rossi con infestazioni multiple;
- Presenza di anelli con due granuli di cromatina;
- Gametociti a semiluna;
- Si osservano circa 12 merozoiti per schizonte;
- Presenza di granulazione di Mauer.
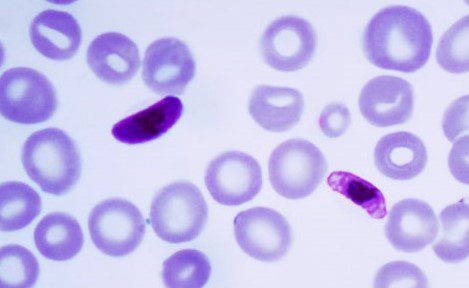
La colorazione utilizzata per l’individuazione delle caratteristiche sopracitate è la colorazione di Wright-Giemsa (Figura 8). I test diagnostici che consentono di individuare il parassita comprendono la PCR, il rilevamento di una proteina ricca di istidina e l’individuazione della lattato deidrogenasi.
Gli esami sierologici non permettono di valutare un’esperienza pregressa ma non di comprendere se si è di fronte ad una forma acuta di malaria.
Terapia
La terapia per Plasmodium falciparum include i seguenti farmaci:
- Atovaquone/proguanil;
- Artemetere/lumefantrina;
- Chinina solfato più uno dei seguenti: Doxiciclina, Tetraciclina, Clindamicina. Meflochina se le altre opzioni non possono essere utilizzate;
- Idrossiclorochina;
- Clorochina fosfato.
Alcuni di questi sono utilizzati per la prevenzione, in caso un individuo decida di avventurarsi in zone endemiche. Altre forme di prevenzione prevedono la lotta all’insetto vettore o la ricerca dei vaccini.
Ismael Sanchez Polanco
Fonti
- “Prevenzione e controllo della malaria d’importazione in Italia” – Roberto Romi, Daniela Boccolini, Giancarlo Majori, Laboratorio di Parassitologia, Istituto superiore di Sanità
- “Procedura operativa per la gestione diagnostico terapeutica della malaria”- Angela Corpolongo, Pasquale De Nardo, Elisa Gentilotti, Piero Ghirga, Micaela Maritti, Emanuele Nicastri, Pasquale Narciso. National institute for Infectious Diseases IRCCS “Lazzaro Spallanzani”. Roma 3 gennaio 2013
- https://www.epicentro.iss.it/malaria/
- https://www.msdmanuals.com/it-it/professionale/malattie-infettive/protozoi-extraintestinali/malaria
- World Malaria report 2019
Mi interesserebbe sapere se è possibile dimostrare di aver contratto la falciparum vent’anni fa in Nigeria