Caratteristiche
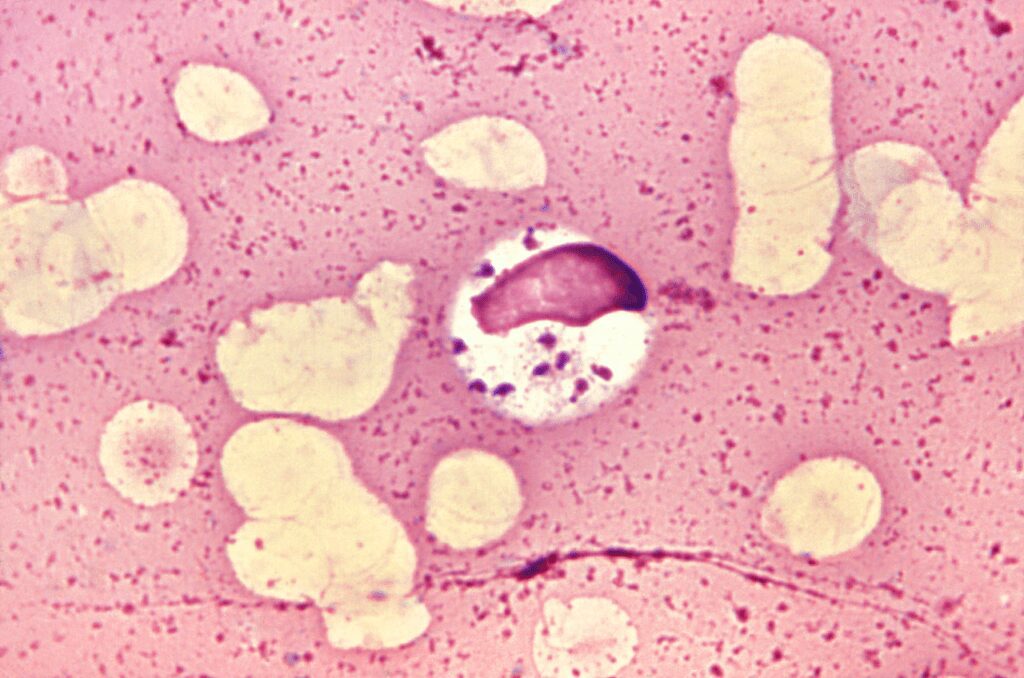
Leishmania donovani (Fig.1) è un parassita intracellulare, agente responsabile della leishmaniosi viscerale antroponotica (LVA), conosciuta anche come “kala-azar” (malattia nera), patologia a coinvolgimento sistemico che rientra tra le forme di leishmaniosi più gravi. Leishmania donovani è un parassita protozoo appartenente alla categoria dei flagellati tessutali, in particolare degli emoflagellati, ed è trasmesso da vettori flebotomi del genere Phlebotomus (P. argentipes, P. orientalis, P. martini).
Filogenesi
| Dominio | Eukaryota |
| Phylum | Euglenozoa |
| Classe | Kinetoplastea |
| Ordine | Trypanosomatida |
| Genere | Leishmania |
| Specie | L. donovani |
Epidemiologia
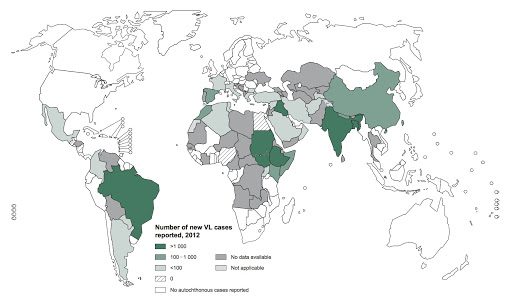
Secondo gli ultimi dati dell’Organizzazione Mondiale della Sanità (OMS), la leishmaniosi, di cui se ne conoscono diverse specie, suddivise sia in base alla patologia provocata (es. leishmaniosi cutanea, leishmaniosi viscerale) sia in base ai paesi interessati, è una patologia endemica in 88 paesi del mondo, con circa 12 milioni di persone colpite e ben 350 milioni a rischio di contrarre la malattia. Le leishmanie, come i tripanosomi ed i plasmodi malarici, sono causa di patologie gravissime che rientrano tra i problemi sanitari a cui l’OMS da molti anni dedica particolare attenzione e controlli. Per quanto riguarda la leishmaniosi viscerale (Fig. 2), la maggior parte dei casi sono registrati principalmente in cinque Paesi: India, Bangladesh, Brasile, Nepal e Sudan.
Morfologia
Leishmania donovani, come tutte le altre specie di leishmania, è un protozoo che durante il suo ciclo vitale può presentarsi sotto diverse forme, a seconda del tessuto – cellula – insetto vettore che lo ospita. I morfotipi riconosciuti sono due:
- amastigote, forma endocellulare replicativa reperibile nelle cellule del sistema reticolo endoteliale e nelle cellule muscolari; è privo di flagello (ne presenta solo un piccolo abbozzo), provvisto di nucleo e cinetoplasto. Rispetto agli altri morfotipi è più piccolo (le sue dimensioni non superano i 5 μm);
- promastigote, presente nell’insetto vettore, provvisto di flagello ma non di membrana ondulante, forma infettante presente nelle ghiandole salivari del flebotomo.
Ciclo vitale
Il ciclo biologico (Fig.3) di Leishmania donovani inizia con l’inoculazione, da parte del flebotomo, durante il pasto di sangue, dei promastigoti (forma infettante) che in esso si sono sviluppati. Successivamente, questi aderiscono alla superficie dei macrofagi, attraverso recettori specifici (es. lipofosfoglucano), e vengono fagocitati. Nel macrofago, avviene la trasformazione del promastigote in amastigote, in cui si moltiplicano attivamente fino ad indurre la lisi delle cellule fagocitarie; gli amastigoti si liberano così in circolo potendo infettare altre cellule, con successive diverse localizzazioni: nel caso della leishmaniosi viscerale, gli amastigoti giungono in organi ricchi di cellule del SRE, come fegato, milza, midollo osseo, con conseguenti alterazioni strutturali e fisiologiche.
Il parassita, grazie ad una serie di adattamenti e strategie messe in atto, riesce ad eludere gli attacchi del sistema immunitario, inibendo la sintesi di ossido nitrico ed alterando l’apoptosi del macrofago e la produzione di mediatori immunologici.
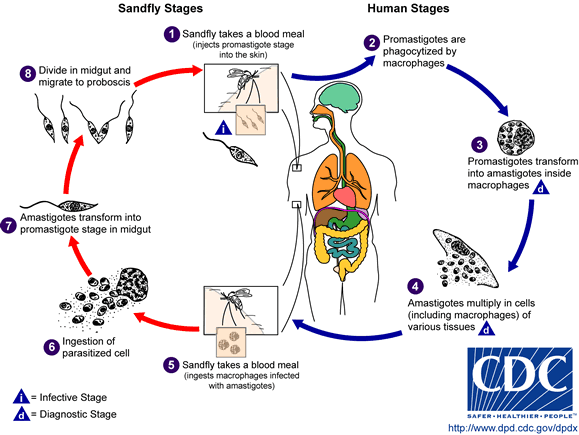
Gli amastigoti, assunti dal vettore durante un nuovo pasto di sangue, si sviluppano di nuovo in promastigoti e, moltiplicandosi attivamente per scissione binaria, raggiungono le ghiandole salivari dell’insetto. Qui, sono pronti per essere inoculati in un altro ospite, dando così inizio ad un nuovo ciclo.
Manifestazioni cliniche
Le manifestazioni cliniche della leishmaniosi viscerale sono correlate alla localizzazione del parassita ed alla sua intensa attività replicativa, ma anche all‘assetto immunitario del paziente. Nei soggetti immunocompromessi (es. coinfezione con HIV), infatti, la prognosi è infausta, a causa anche dell’ulteriore indebolimento del sistema immunitario.
A differenza di quanto avviene nella forma cutanea e cutaneo-mucosa in cui i parassiti rimangono localizzati a livello della cute e delle mucose, nella forma viscerale migrano nei tessuti maggiormente ricchi di cellule del SRE, provocando una reticolo-endotelite sistemica, con iperplasia di fegato, linfonodi e milza, alterazione dell’emopoiesi a causa dei macrofagi infettati presenti nel midollo osseo ed interesse della sottomucosa intestinale. La sintomatologia della forma acuta è rappresentata da febbre molto alta, sindrome epato-splenomegalica, anemizzazione e fenomeni emorragici. Spesso, la cute del volto, delle mani, dei piedi e dell’addome assume un colorito “brunastro–cereo grigiastro” (kala-azar – “malattia nera“).
Spesso, negli esordi più lenti e subdoli, la sintomatologia riguarda malessere, diarrea, pallore, febbre irregolare ed a causa del blocco del sistema reticoloendoteliale, il paziente colpito va incontro a pancitopenia, ipergammaglobulinemia per aumento abnorme di gammaglobuline nel sangue, fenomeni emorragici ed anemizzazione. In assenza di terapia adeguata, l’exitus del paziente avviene per cachessia progressiva o per fenomeni acuti (es. emorragia).
La patologia è comunque sempre molto grave e, generalmente, la guarigione spontanea è rarissima. In alcuni casi, dopo la guarigione post trattamento da kala-azar, L. donovani può permanere silente nei macrofagi ematici ed indurre, anche dopo anni, una forma dermica post kala-azar.
Diagnosi
La diagnosi per Leishmania donovani può essere sierologica, microscopica e molecolare.
La sierodiagnosi viene eseguita su pazienti che non hanno deficit immunitari, generalmente in immunofluorescenza indiretta, immunoenzimatica ed immunocromatografia; se il risultato è positivo per la ricerca di anticorpi anti-Leishmania donovani, la positività va confermata in western blot. Il parassita, soprattutto in pazienti immunocompromessi, può essere ricercato nel midollo osseo, nel fegato e nella milza allestendo con il materiale aspirato uno striscio per successiva lettura microscopica previa colorazione in Giemsa o May-Grunwald Giemsa. Utile è, inoltre, lo striscio di sangue e la goccia spessa. Di frequente utilizzo è anche la diagnosi molecolare eseguita in Real Time PCR.
Terapia
La terapia di elezione per il trattamento della leishmaniosi viscerale era l’antimoniato di N-metilglucamina, ma attualmente questo farmaco è stato surclassato da altri principi attivi, come la pentamidina isetionato per endovena, l’amfotericina B liposomiale per endovena e la miltefosina per somministrazione orale.
Priscilla Caputi
Fonti
- Cancrini G. Parassitologia Medica Illustrata. Edra, 2019.
- Cancrini G. Parassitologia e tecniche di laboratorio. Lombardo, 2013.
- Murdolo M. Microbiologia e Parassitologia. Universitalia, 2012.
- Blackwell, J. M., Fakiola, M., & Singh, O. P. (2020). Genetics, transcriptomics and meta-taxonomics in visceral leishmaniasis. Frontiers in Cellular and Infection Microbiology, 10.
- Owino, B. O., Mwangi, J. M., Kiplagat, S., Mwangi, H. N., Ingonga, J. M., Chebet, A., … & Matoke-Muhia, D. (2021). Molecular detection of Leishmania donovani, Leishmania major, and Trypanosoma species in Sergentomyia squamipleuris sand flies from a visceral leishmaniasis focus in Merti sub-County, eastern Kenya. Parasites & Vectors, 14(1), 1-11.
- Hossain, F., Ghosh, P., Khan, M. A. A., Duthie, M. S., Vallur, A. C., Picone, A., … & Mondal, D. (2017). Real-time PCR in detection and quantitation of Leishmania donovani for the diagnosis of Visceral Leishmaniasis patients and the monitoring of their response to treatment. PloS one, 12(9), e0185606.
- https://www.cdc.gov/parasites/leishmaniasis/biology.html
- https://phil.cdc.gov/
- http://www.ospedalebambinogesu.it/leishmaniosi-umana#.YAwKKehKg2w
- http://www.centrosaluteglobale.eu/malattie-tropicali-dimenticate/leishmaniosi/
- https://www.epicentro.iss.it/leishmaniosi/
- https://www.epicentro.iss.it/leishmaniosi/epidemiologia
- Immagine in evidenza: https://en.wikipedia.org/wiki/Amastigote