Introduzione
Trypanosoma brucei è un protozoo flagellato parassita dell’uomo, appartenente alla classe Kinetoplastea, causa della tripanosomiasi africana, nota anche come malattia del sonno. Questo parassita presenta due sottospecie: T. brucei gambiense e T. brucei rhodesiense; entrambi causano la medesima malattia, ma hanno consistenti differenze: l’areale di distribuzione, gli eventuali serbatoi animali e il vettore. Infatti, T. brucei gambiense si ritrova nell’Africa occidentale e centrale, non presenta serbatoi animali e necessita di vettori igrofili (cioè che vivono in luoghi dove il terreno è ricco d’acqua) come Glossina palpalis e Glossina tachinoides, mentre T. brucei rhodesiense si riscontra in Africa orientale e centrale, presenta come serbatoio animale l’antilope e necessita di vettori xerofili (cioè che vivono in ambienti asciutti) come Glossina morsitans, Glossina pallidipes e Glossina swimmertoni.

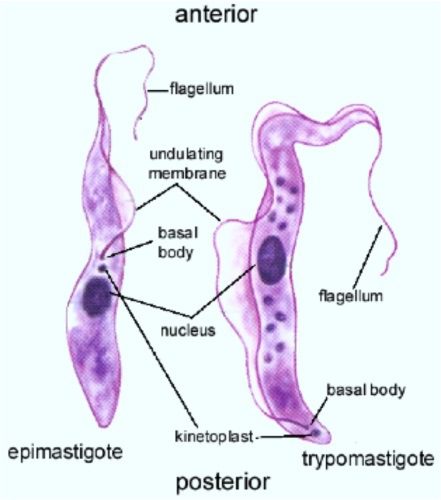
In entrambe le sottospecie il parassita si presenta in due diverse “forme” durante il ciclo vitale: epimastigote e tripomastigote. Esse vengono distinte in base al punto d’inserzione del flagello nella cellula: nel primo dei due stadi il flagello si origina dalla parte anteriore della cellula, viceversa nello stadio di tripomastigote il flagello si origina dalla parte posteriore.
Questa distinzione è dovuta al fatto che il flagello è indice di una variazione importante della struttura cellulare interna: esso è infatti connesso al cinetoplasto, l’organulo che dà il nome alla classe, che si trova nel mitocondrio ed è ricco di DNA (detto kDNA) ed ha caratteristiche uniche. Si tratta infatti di diverse molecole circolari di DNA tra loro concatenate e distinte al loro interno in due classi diverse per numero, struttura e funzione. Il protozoo è nello stadio di epimastigote quando si trova nelle ghiandole salivari della mosca tsè-tsè (Glossina spp.); mentre si trova nello stadio di tripomastigote quando è circolante e presenta dimensioni di 25-30 μm.
Ciclo vitale
Il ciclo vitale di Trypanosoma brucei inizia quando il vettore (Glossina spp.) si nutre del sangue di un mammifero infetto. Il parassita, che si trova nello stadio di tripomastigote circolante, si trasforma in tripomastigote prociclico nell’intestino dell’insetto e si divide per scissione binaria. A questo punto i tripomastigoti lasciano l’intestino e, passando allo stadio di epimastigoti, raggiungono le ghiandole salivari della mosca, dividendosi poi ulteriormente al loro interno. Subito dopo la divisione raggiungono lo stadio di tripomastigoti metaciclici e sono pronti per infettare un nuovo ospite.
L’infezione avviene quando Glossina spp. compie un pasto di sangue e trasferisce nel nuovo ospite i tripomastigoti metaciclici, i quali diventano tripomastigoti circolanti (che si dividono in due ulteriori forme: la forma snella e quella tozza. Maggiori informazioni nel video in fondo all’articolo al capitolo “forme e ciclo vitale”) e vengono trasportati dal flusso sanguigno nei siti d’infezione. A questo punto i tripomastigoti si moltiplicano per scissione binaria nei diversi fluidi corporei (come sangue, linfa e fluido spinale), e infine ritornano nel circolo sanguigno in attesa che un altro rappresentante del genere Glossina abbia fame.

Una capacità particolare
Una caratteristica che rende questo parassita particolarmente difficile da debellare per il nostro sistema immunitario è la capacità di modificare le proprie proteine superficiali, presentando quindi antigeni sempre diversi. Questo è possibile grazie alla ricombinazione dei geni codificanti per le proteine variabili di superficie (VSG), localizzati alle estremità dei cromosomi: quando queste ultime si accorciano provocano delle rotture nel DNA vicino al sito VSG, che vengono sostituite da copie di VSG provenienti da altri cromosomi. Secondo il team responsabile della scoperta, guidato da Catharine Boothriyd, il meccanismo messo in atto da Trypanosoma brucei non è dissimile da quello sfruttato dai linfociti B che producono anticorpi riarrangiando il proprio DNA per contrastare l’enorme numero di possibili infezioni.
Patologia
La malattia dovuta all’infezione di Trypanosoma brucei è la famosa malattia del sonno otripanosomiasi africana. Questa malattia si manifesta dopo un periodo d’incubazione variabile da una a tre settimane, esordendo con mal di testa, febbre, prurito e dolori articolari. A questi primi sintomi generici seguono nei mesi seguenti confusione, mancanza di coordinamento, torpore e sonnolenza, che col passare del tempo degenerano in coma. Secondo i dati dell’OMS, più del 98% dei casi di tripanosomiasi sono imputabili a T. brucei gambiense. Oltre al classico vettore Glossina spp. questo parassita si può tramettere anche in altri modi: sono stati documentati casi di trasmissione sessuale, pasti di sangue di altri insetti ematofagi, puntura involontaria con aghi infetti e trasmissione dalla madre al feto in quanto il parassita riesce ad attraversare la placenta.
Diagnosi e trattamento
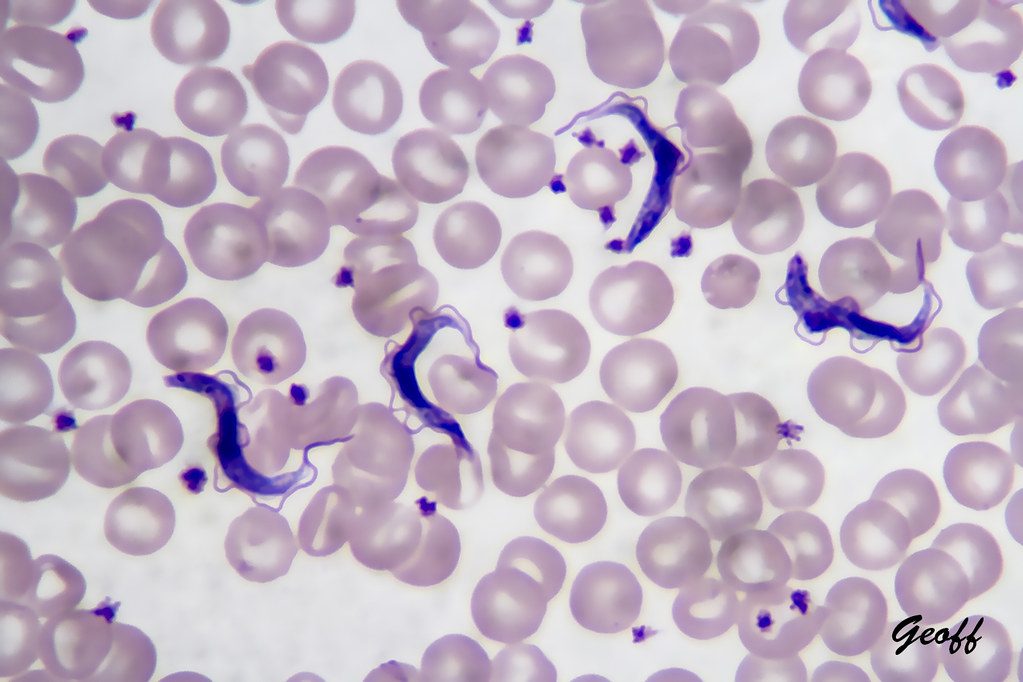
La diagnosi viene effettuata classicamente attraverso l’osservazione al microscopio di uno striscio di sangue (Fig.3), tramite test sierologici (solo su T. brucei gambiense) o monitorando eventuali “segnali” come il gonfiore a livello dei linfonodi cervicali. È inoltre fondamentale conoscere lo stato di avanzamento della malattia, tipicamente tramite una puntura lombare e successiva analisi del fluido cerebrospinale. La diagnosi dev’essere effettuata il prima possibile onde evitare il progressivo peggioramento neurologico, ma, data la labilità dei sintomi iniziali, questo non è sempre possibile. Proprio per questo motivo prevenire è importantissimo, ad esempio mediante screening della popolazione a rischio tramite analisi del sangue periodiche.
Il trattamento della tripanosomiasi prevede l’utilizzo di farmaci particolari a seconda dello stadio di avanzamento della patologia, vengono utilizzati quindi Pentamidine e Suramin negli stadi iniziali, mentre Melasorpol, Eflornithine e Nifurtimox sono i farmaci adottati per contrastare gli stadi avanzati.
Nel 2000 e nel 2001 l’OMS ha avviato una partnership con importanti case farmaceutiche al fine di creare una rete di sorveglianza e supporto nel controllo degli Stati a rischio e fornendo medicine. Questo accordo è stato ulteriormente rinnovato nel 2006, 2011 e 2016 e i risultati iniziano a vedersi: la patologia è in leggera frenata e questo ha incoraggiato altri partner a supportare l’OMS per la causa.
Epidemiologia
Secondo i dati epidemiologici dell’OMS, T. brucei gambiense è presente nell’Africa Occidentale e Centrale, ma l’infezione è attualmente limitata, mentre è molto presente nella Repubblica Democratica del Congo (dove si registrano circa l’80% di tutti i casi di tripanosomiasi). Per quanto riguarda invece T. brucei rhodesiense in Africa Orientale il numero di infetti è basso, con meno di 200 casi dichiarati all’anno, poco più del 3% del totale.
E in Italia? Nel nostro Paese sono stati soltanto due gli episodi di tripanosomiasi, avvenuti nel 2004, ma in entrambi i casi si trattava di persone impegnate per lavoro all’estero nelle aree endemiche, quindi il rischio non sussiste. Per dovere di cronaca vi informo che entrambi i pazienti sono sopravvissuti.
Storia e curiosità
In ultimo, un po’ di storia! Grazie ad analisi molecolari effettutate sull’RNA della subunità minore dei ribosomi di Trypanosoma si è scoperto che i sottogruppi a cui appartengono T. brucei e T. cruzi si sono separati filogeneticamente circa 300 milioni di anni fa e, mentre T. cruzi è successivamente diventato parassita di Triatoma infestans, il nostro T. brucei ha preferito Glossina spp., comparsa per la prima volta circa 35 milioni di anni fa. Da quel momento in poi la puntura di questo insetto ematofago poteva portare con sé anche il protozoo e, forse, è stata proprio l’esposizione al parassita per lunghi periodi che ha fatto sì che le specie selvatiche, anche se infettate da Trypanosoma, non mostrino alcun sintomo.
Al contrario, in soli 130 mila anni di esposizione, gli animali domestici non sono ancora stati in grado di sviluppare una resistenza. Ma veniamo agli esseri umani. Molto probabilmente Trypanosoma ha avuto un ruolo nell’evoluzione dei primi ominidi, selezionando gli individui Trypanosoma-resistenti; infatti, con le eccezioni di T. brucei rhodesiense e T. brucei gambiense (cosa che dimostrerebbe un contatto recente fra questi parassiti e la nostra specie), gli esseri umani sono resistenti a tutte le specie africane di Trypanosoma, cosa che i primati arboricoli non sono.
Facendo un balzo temporale arriviamo agli antichi egizi; questa civiltà allevava il bestiame assieme alla selvaggina, in modo da selezionare animali Trypanosoma-tolleranti. Evidenze di questa malattia nel bestiame si trovano nel Papiro di Kahun (2000 a.C. ca.), in cui si descrive la nagana, l’attuale tripanosomiasi, inoltre c’è traccia di una prima cura alla puntura di Glossina spp., ricavata dal grasso di alcuni uccelli. Durante il Medio Regno la corrente del Nilo cambiò, cosa che provocò una graduale distruzione dei nidi del vettore e indirettamente del protozoo.
Con un altro salto in avanti nel tempo ci troviamo nel Medioevo, periodo a cui risalgono alcuni scritti Arabi che documentano la presenza di Trypanosoma in Paesi africani con cui avevano relazioni commerciali. Una testimonianza particolarmente forte ci giunge dal geografo Abu Abdallah Yaqut (1179-1229), che, durante un viaggio in Africa, raggiunge un villaggio in cui gli abitanti e perfino i cani sono “pelle e ossa e profondamente addormentati”. La scena descritta è spaventosamente simile all’epidemia che colpi l’Uganda nel 20° secolo.
E’ nell’epoca moderna che si inizia a studiare e identificare sempre più univocamente Trypanosoma e la malattia a lui dovuta. Nel 1734 la tripanosomiasi era un flagello per le navi che commerciavano schiavi dall’Africa al Nuovo Mondo: in questo contesto il chirurgo navale John Aktins (1685-1757) pubblicò il primo e accurato testo che descriveva le fasi neurologiche della malattia del sonno, mentre nel 1803 Thomas Winterbottom (1766-1859) descrisse i segni caratteristici del gonfiore ai linfonodi sul collo.
Tuttavia fu il missionario ed esploratore scozzese David Livingston (1813-1875) che nel 1852 suggeri che la nagana fosse correlata al morso di Glossina spp., e furono necessari altri 40-50 anni prima che Trypanosoma fosse identificato come la causa della nagana. Lo scopritore di Trypanosoma brucei nel bestiame fu il patologo e microbiologo David Bruce (1855-1931, Fig.4) nel 1895, che successivamente si occupò anche delle modalità di trasmissione. Per la classificazione dell’odierna sottospecie T. brucei gambiense, questa volta nell’uomo,si deve invece aspettare Robert Michael Forde (1861-1945) e Joseph Everett Dutton (1874-1905), da cui venne rispettivamente scoperto e classificato correttamente nel 1902 appunto sulla nave “The Gambia”. Per quanto riguarda l’altra sottospecie, T. brucei Rhodesiense, bisogna attendere il 1910 e il parassitologo John William Watson Stephens (1865-1946).

Nel seguente video approfondimento (suddiviso nei capitoli) trovate tutti gli approfondimenti su T. brucei. I capitoli del video sono:
- Introduzione (01:25): spiegazione approfondita degli organelli cellulari peculiari (flagello, cinetoplasto, glicosoma, ecc) del parassita e del suo movimento peculiare;
- Forme e ciclo vitale (14:48): differenze tra tutte le forme di T. brucei (tripomastigoti prociclici, metaciclici, forma tozza, forma snella, epimastigoti, ecc) e ciclo vitale;
- Vettore (23:44): descrizione approfondita di Glossina;
- VSG (25:35): spiegazione molto approfondita delle VSG (utilità, struttura, meccanismo di evasione);
- Patologia (31:48): descrizione delle patologie scatenate dalle due sottospecie T. b. gambiense e T. b. rhodesiense;
- Curiosità (37:11): storia del parassita.
Le fonti del video le trovate, divise per argomento, a questo link. Buona visione!
Video Approfondimento:
Andrea Borsa
Fonti
- OMS,
- Le Scienze
- CDC
- PLOS biologue
- Lori Peacock, Simon Cook, Vanessa Ferris, Mick Bailey and Wendy Gibson. The life cycle of Trypanosoma (Nannomonas) congolense in the tsetse fly. Parasites & Vectors 2012
- Zeno Bisoffi, Anna Beltrame, Geraldo Monteiro, Alessandra Arzese, Stefania Marocco, Giada Rorato, Mariella Anselmi and Pierluigi Viale. African Trypanosomiasis Gambiense, Italy. Emerging Infectious Diseases, Vol. 11, No. 11, November 2005.
- Dietmar Steverding. The history of African trypanosomiasis. Parasites & Vectors 2008