Caratteristiche
Cyclospora cayetanensis è un organismo parassita appartenente al numeroso gruppo dei protozoi, organismi unicellulari comparsi oltre un miliardo di anni fa. Specificatamente, C. cayetanensis appartiene alla sottoclasse Coccidia, genere Cyclospora. Inoltre, è interessante notare che il suo nome specifico deriva dal nome dell’Università Cayetano Heredia di Lima (Perù), dove la specie è stata studiata per la prima volta (Upton, 2001). Per quanto riguarda la sua descrizione, essa è stata fatta per la prima volta nel 1994 (Ortega et al., 1994), successivamente a tre casi di infezione umana registrati in Papua Nuova Guinea nel 1977 e 1978 (Ashford, 1979). Nell’essere umano, che rappresenta l’unico ospite per C. cayetanensis, la presenza del protozoo parassita a livello intestinale provoca un’infezione nota come ciclosporiasi (figura 1).

Filogenesi
| Regno | Eukaryota |
| Superphylum | Alveolata |
| Phylum | Apicomplexa |
| Classe | Coccidia |
| Ordine | Eucoccidiorida |
| Sottordine | Eimeriorina |
| Famiglia | Eimeriidae |
| Genere | Cyclospora |
| Specie | C. cayetanensis |
Morfologia strutturale di Cyclospora cayetanensis
Gli studi sulla morfologia strutturale di C. cayetanensis hanno dimostrato la caratteristica coccidica del parassita (Cama & Ortega, 2024), evidenziata dal fatto che il protozoo parassita, ancorato alle cellule epiteliali dell’intestino tenue, al termine del suo ciclo vitale produce oocisti immature. Queste ultime sono cisti in cui, dopo un certo tempo esternamente all’ospite, si sviluppa la maturazione dello zigote. Inoltre, le oocisti sono di forma sferica, con diametro variabile tra 7,7 e 9,9 μm (micrometri, unità di misura derivata corrispondente ad un milionesimo di metro), e sono circondate da una parete spessa meno di 1 μm (Almeria et al., 2019). In particolare, le osservazioni a luce ultravioletta hanno mostrato l’emissione di un colore azzurro brillante delle pareti delle oocisti (figura 2).

Ciclo vitale
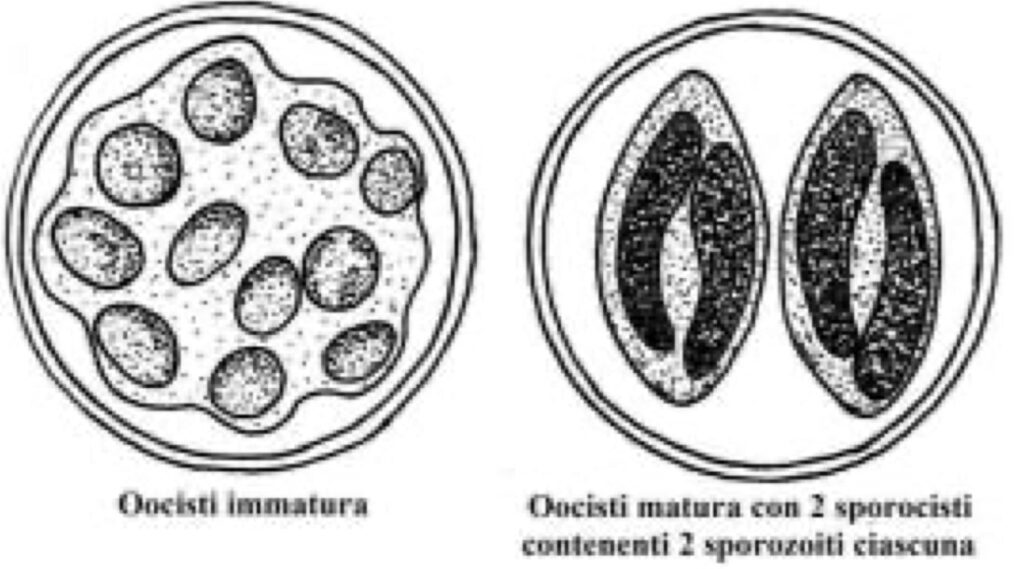
Il ciclo vitale del protozoo inizia con l’ingestione di oocisti mature (figura 3), all’interno delle quali sono presenti 4 sporozoiti, cellule infettive che, una volta fuoriuscite dalle oocisti attraverso il processo di excistazione, penetrano nelle cellule epiteliali dell’intestino tenue. Successivamente, gli sporozoiti vanno incontro ad un ciclo costituito da una fase asessuata ed una sessuata. In particolare, nella fase asessuata gli sporozoiti si trasformano in trofozoiti, cellule che si dividono dando origine a due tipi di schizonti. Si sviluppano, quindi, due generazioni: lo schizonte di tipo I produce da 8 a 12 cellule dette merozoiti di dimensioni modeste (3-4 μm di lunghezza); lo schizonte di tipo II produce 4 merozoiti di lunghezza maggiore (12-15 μm) (Ortega et al., 1997a).
Successivamente i merozoiti formano due tipologie di gameti, microgamete e macrogamete, segnando il passaggio alla fase sessuata. Conseguentemente, la fusione tra i gameti genera lo zigote, attorno al quale viene deposta una parete cellulare con funzionalità protettiva, determinando la sviluppo della oocisti che verrà eliminata con le feci.

Patogenesi
Lo sviluppo della ciclosporiasi, quindi la trasmissione di Cyclospora cayetanensis, avviene per via oro-fecale tramite cibi o acqua contaminati. Successivamente all’ingestione di oocisti sporulate, queste vengono liberate nel tratto gastrointestinale, rilasciando gli sporozoiti che si dirigono verso le cellule epiteliali dell’intestino tenue, in particolare digiuno e duodeno (Almeria et al., 2019), dove, provocando un’infezione, giungeranno a maturazione. Nel dettaglio, i sintomi di infezione si registrano circa una settimana dopo l’assunzione di cibi o acqua contaminati e sono causati da atrofia villosa, ovvero una riduzione dei villi intestinali che provoca una riduzione della capacità di assorbire nutrienti dal cibo, nonchè iperplasia delle cripte, un aumento del numero e delle dimensioni delle cripte intestinali (cripte di Lieberkühn), ovvero le ghiandole deputate alla rigenerazione della mucosa intestinale.
Oltre a questo, una peculiare caratteristica delle oocisti di C. cayetanensis è relativa alla loro non infettività al momento dell’escrezione. Affinché le oocisti diventino infettive è necessario un periodo di diversi giorni, da 7 a 14, all’esterno dell’ospite ad una temperatura compresa tra 22°C e 30°C (Smith et al., 1997) (figura 4). Specificatamente, tale tratto distintivo di questo protozoo parassita influisce sulla sua epidemiologia. È, infatti, improbabile una trasmissione diretta da persona a persona, come ad esempio è inverosimile che uno chef affetto da ciclosporiasi, maneggiando alimenti, possa contaminare il cibo (Herwaldt, 2000).
Sintomatologia
Successivamente all’ingestione di oocisti mature, i sintomi di infezione da Cyclospora cayetanensis sono vari e comprendono nausea, diarrea acquosa, crampi addominali, febbre, affaticamento e perdita di peso (Marie & Petri, 2022). In particolare, essi si manifestano circa una settimana dopo l’infezione e posso perdurare anche per un mese. Tuttavia, questo periodo può prolungarsi ulteriormente se ad infettarsi è una persona con sistema immunitario già compromesso da altre infezioni. Inoltre, le cause di infezione da C. cayetanensis sono dovute all’ingestione di cibo o acqua contaminata dalle oocisti sporulate. Oltretutto, in alcuni casi si possono registrare lievi infezioni, i cui sintomi si manifestano solo per pochi giorni.
Metodi di identificazione di Cyclospora cayetanensis
Per quanto riguarda la diagnosi di infezione da Cyclospora cayetanensis, essa consiste nell’individuare la presenza delle oocisti esaminando campioni di feci al microscopio. Tuttavia, nel caso in cui questo esame non rilevi la presenza del parassita, alcuni laboratori ricorrono a un’ulteriore procedura. In particolare, prelevano dal paziente, attraverso una sonda, un campione di tessuto da esaminare al microscopio. Nel dettaglio, questo procedimento, chiamato biopsia, consente infatti di analizzare il DNA delle oocisti e, di conseguenza, identificare il DNA del parassita utilizzando tecniche molecolari.
Terapia
In caso di infezione il trattamento è di tipo antibiotico con trimetoprim associato a sulfametoxazolo (Marie & Petri, 2022) per 7-10 giorni. Da un punto di vista sintomatologico, tale trattamento blocca i dolori addominali e la diarrea in circa 3 giorni (Cama & Ortega, 2024) e similmente l’espulsione del parassita attraverso le feci si arresta entro il quinto giorno (Pape et al., 1994). Al contrario, per pazienti allergici agli antibiotici trimetoprim-sulfametoxazolo è stato testato con ottimi risultati il trattamento con due antibiotici: ciprofloxacina (Madico et al., 1997; Verdier et al., 2000) e nitazoxanide (Zimmer et al., 2007).
Metodi di prevenzione
Per quanto riguarda la prevenzione, è possibile prevenire un’infezione da Cyclospora cayetanensis evitando il consumo di alimenti crudi, tra cui anche verdure, in particolare non pelate, in aree dove l’infezione è comune, come quelle tropicali e subtropicali, o procedere ad un accurato lavaggio, sebbene uno studio ha dimostrato come quest’ultimo metodo non sempre sia in grado di rimuovere il 100% delle oocisti (Ortega et al., 1997b).
Fonti
- Almeria, S., Cinar, H.N., Dubey, J.P. (2019). Cyclospora cayetanensis and Cyclosporiasis: An update. Microorganisms; 7, 317; DOI: 10.3390/microorganisms7090317.
- Ashford, R.W. (1979). Occurrence of an undescribed coccidian in man in Papua New Guinea. AnnTrop Med Parasitol; 73: 497-500.
- Herwaldt, B.L. (2000). Cyclospora cayetanensis: A Review, Focusing on the Outbreaks of Cyclosporiasis in the 1990s. Clinical Infectious Diseases Society of America; 31: 1040-57.
- Madico, G., McDonald, J., Gilman, R.H., Cabrera, L., Sterling, C.R. (1997). Epidemiology and treatment of Cyclospora cayetanensis infection in Peruvian children. Clinical Infectious Diseases 24, 977–981.
- Marie, C., Petri, W.A.Jr. (2022). Ciclosporiasi. Manuale MSD.
- Ortega, R.Y., Gilman, R.H., Sterling, C.R. (1994). A new coccidian parasite (Apicomplexa: Eimeriidae) from humans. J. Parassitol., 80(4), p. 625-629. American Society of Parassitologists 1994.
- Ortega, Y.R., Nagle, R., Gilman, R.H., Watanabe, J., Miyagui, J., Quispe, H., Kanagusuku, P., Roxas, C., Sterling, C.R. (1997a). Pathologic and clinical findings in patients with cyclosporiasis and a description of intracellular parasite life-cycle stages. J. Infect. Dis.; 176, 1584–1589.
- Ortega, Y.R., Roxas, C.R., Gilman, R.H., Miller, N.J., Cabrera, L., Taquiri, C., Sterling, C.R. (1997b). Isolation of Cryptosporidium parvum and Cyclospora cayetanensis from vegetables collected in markets of an endemic region in Peru. Am J Trop Med Hyg. 57(6): 683-6. DOI: 10.4269/ajtmh.1997.57.683.
- Pape, J.W., Verdier, R.I., Boncy, M., Boncy, J., Johnson Jr, W.D. (1994). Cyclospora infection in adults infected with HIV. Clinical manifestations, treatment, and prophylaxis. Ann Intern Med. 121(9):654-7. DOI: 10.7326/0003-4819-121-9-199411010-00004.
- Smith, H.V., Paton, C.A., Mtambo, M.M.A., Girdwoord, R.W.A. (1997). Sporulation of Cyclospora sp.Oocysts. Appl. Environ. Microbiol.; 63, 1631-1632.
- Upton, J.S. (2001). Cyclospora cayetanensis. Division of Biology, Kansas State University.
- Verdier, R.I., Fitzgerald, D.W., Johnson, W.D., Jr, Pape, J.W. (2000). Trimethoprim-sulfamethoxazole compared with ciprofloxacin for treatment and prophylaxis of Isospora belli and Cyclospora cayetanensis infection in HIV-infected patients. A randomized, controlled trial. Annals of Internal Medicine 132, 885–888.
- Vitaliano A. Cama, Ynes R. Ortega, in Encyclopedia of Food Safety (Second Edition), 2024.
- Zimmer, S.M., Schuetz, A.N., Franco-Paredes, C. (2007). Efficacy of nitazoxanide for cyclosporiasis in patients with sulfa allergy. Clinical Infectious Diseases 44, 466–467.
Crediti immagini
- Immagine in evidenza – Maturazione delle oocisti di Cyclospora cayetanensis modificato da Herwaldt, B.L. (2000). Cyclospora cayetanensis: A Review, Focusing on the Outbreaks of Cyclosporiasis in the 1990s. Clinical Infectious Diseases Society of America; 31: 1040-57.
- Figura 1 – Kaminsky, R.G., Lagos, J., Raudales Santos, G., Urrutia, S. (2016). Marked seasonality of Cyclosporacayetanensis infections: ten-year observation of hospital cases, Honduras. BMC Infectious Diseases16:66. DOI: 10.1186/s12979-016-1393-6.
- Figura 2 – Almeria, S., Cinar, H.N., Dubey, J.P. (2019). Cyclospora cayetanensis and Cyclosporiasis: An update.Microorganisms; 7, 317; DOI: 10.3390/microorganisms7090317.
- Figura 3 – Almeria, S., Cinar, H.N., Dubey, J.P. (2019). Cyclospora cayetanensis and Cyclosporiasis: An update. Microorganisms, 7, 317; DOI: 10.3390/microorganisms7090317.
- Figura 4 – Bernieri, F., Crotti, D., Galli, D., Raglio, A. (2001). Manuale illustrato di diagnostica parassitologia. Zanichelli. ISBN 9788808187444.