L’ASA, o acido acetilsalicilico (noto soprattutto con il suo nome commerciale di Aspirina), è considerato il farmaco di sintesi più utilizzato al mondo per la sua attività antipiretica, analgesica e antitrombotica. Quest’ultima funzione è mediata dalla cardioaspirina, ovvero aspirina a un dosaggio inferiore (100mg) rispetto a quella in compresse (500mg) o effervescente (325mg). Ad oggi si stima che vengano consumate 44.000 tonnellate di ASA ogni anno, equivalenti a 120 miliardi di compresse. Essendo considerato il farmaco di maggior uso in casa e vista la sua ampia disponibilità, spesso si sottovalutano meccanismi d’azione alternativi, tra cui benefici antitumorali nella prevenzione del cancro al colon-retto (CRC).
Caratteristiche chimiche e farmacocinetiche dell’aspirina
L’ASA è un derivato dell’acido salicilico (acido ortodiidrossibenzoico), talmente irritante che può essere usato tal quale solo per uso esterno in ambito cosmetico. Per l’uso sistemico sono stati sintetizzati vari derivati, tra cui esteri dell’acido salicilico, ottenuti per sostituzione del gruppo carbossilico (-COOH), e esteri salicilici di acidi organici, ottenuti per sostituzione del gruppo ossidrilico (-OH). L’acido acetilsalicilico è un estere dell’acido acetico (figura 1).
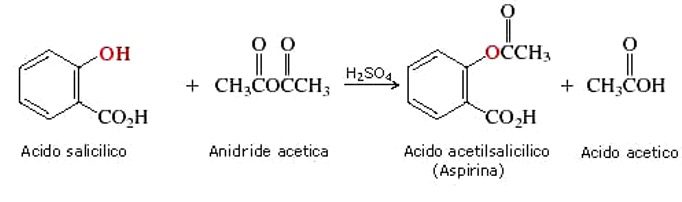
L’ASA è un acido debole appartenente alla famiglia dei farmaci antinfiammatori non steroidei (FANS) e viene assorbito rapidamente attraverso lo stomaco, ma per la maggior parte dalla porzione prossimale dell’intestino tenue. Una parte del farmaco viene assorbita come tale, la restante viene metabolizzata da esterasi della mucosa gastrointestinale e del fegato. In questo modo entra nella circolazione sistemica sotto forma di acido salicilico. Anche la parte di ASA assorbita tal quale subisce una rapida idrolisi (in acido salicilico e acetato attivo) nel plasma, fegato ed eritrociti. Le concentrazioni in circolo di acido acetilsalicilico sono infatti sempre piuttosto basse, non superando quasi mai i 20µg/mL alle dosi terapeutiche di uso comune.
Meccanismo d’azione di ASA e ipotesi molecolari sull’effetto chemiopreventivo
Meccanismo d’azione di ASA
L’ASA esplica la sua funzione antipiretica, analgesia, antinfiammatoria e antitrombotica tramite reazioni di acetilazione irreversibile di COX1, COX2 e COX3. Ovvero enzimi di membrana al centro del pathway di sintesi di prostaglandine (PGs) e trombossano (TX) coinvolti in processi infiammatori e trombotici (figura 2). In questo modo l’aspirina è responsabile del blocco irreversibile di queste proteine e dell’intera via biosintetica che catalizzano.
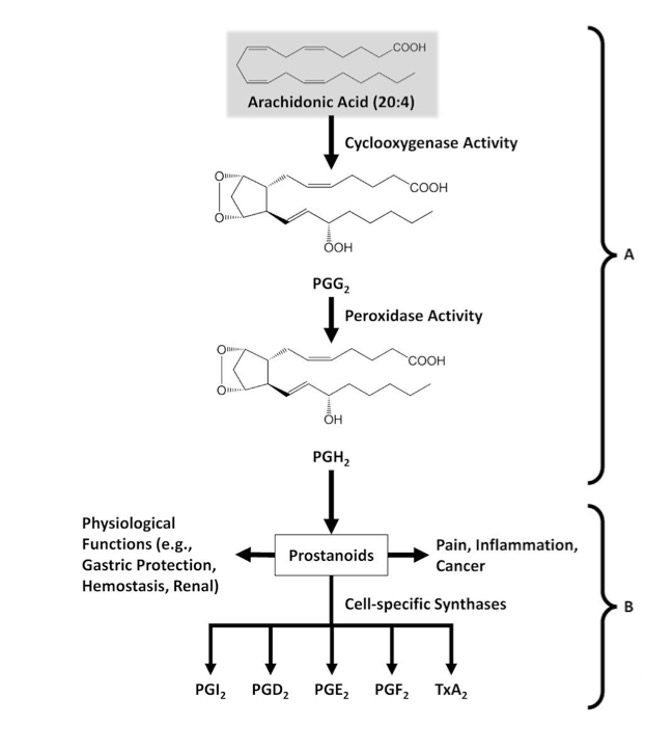
Di maggiore interesse sono sopratutto COX1 e COX2. COX1 è classificata come l’isoforma costitutivamente espressa in tutte le tipologie cellulari a livelli costanti, mentre la COX2 (detta isoforma inducibile) è normalmente assente nelle cellule e aumenta solamente in risposta a certi stimoli, tipicamente infiammatori. Sono enzimi molto simili (dal peso molecolare di 70kDa e 72kDa) ma presentano piccole differenze nelle dimensioni del sito attivo. Proprio su queste si sono concentrate le aziende farmaceutiche con lo scopo di individuare molecole capaci di inibire selettivamente COX2 e non COX1. Infatti quest’ultimo, oltre ad avere un ruolo nell’infiammazione, è importante per il mantenimento dell’integrità della mucosa gastrointestinale. Per cui, il suo blocco eccessivo è causa di danni mucosali come ulcerazioni e emorragie gastriche.
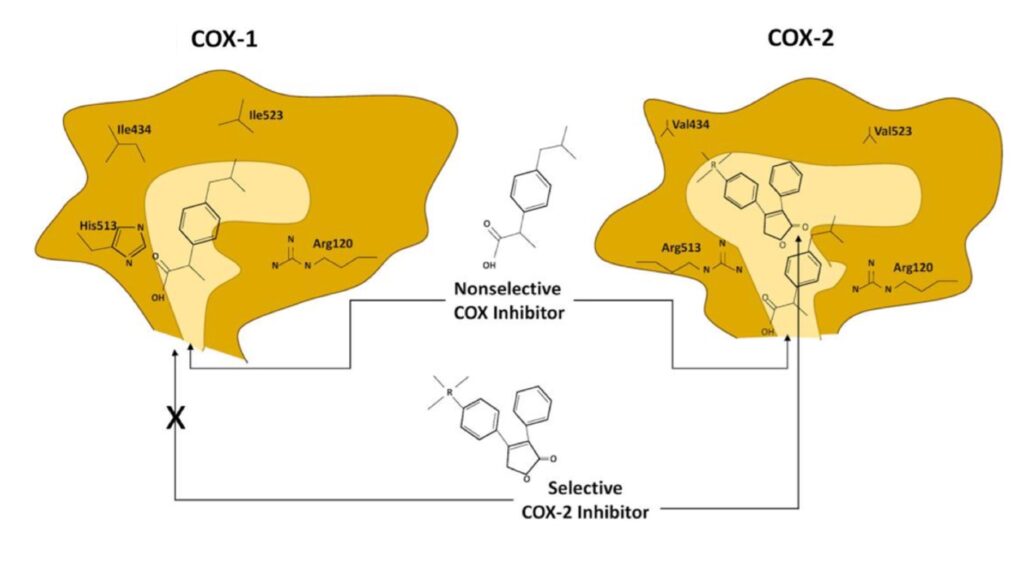
Ruolo di COX1 e COX2 nella cancerogenesi intestinale
Le prime evidenze che COX1 e COX2 sono coinvolte nella cancerogenesi intestinale derivano da studi epidemiologici condotti verso la fine del secolo scorso che mostravano una riduzione dell’incidenza di cancro colorettale (CRC) a seguito di un consumo cronico di ASA. Analogamente, in uno studio del 1993 condotto su pazienti affetti da FAP (Poliposi Adenomatosa Familiare, una forma ereditaria di CRC) si osservava che il consumo di Sulindac (un altro FANS) riduceva il numero e le dimensioni dei polipi.
Il contributo delle due isoforme alla cancerogenesi è però differente. COX1 a livello endoteliale contribuisce all’angiogenesi tumorale e all’infiammazione. COX2 invece è l’isoforma più determinante contribuendo direttamente alla formazione e alla crescita del tumore. L’iperespressione di COX2 è stata riportata in vari tipi di lesioni epiteliali premaligne e maligne, con incidenza del 50% negli adenomi e dell’80% nei carcinomi. È riscontrabile però anche al di fuori delle cellule trasformate, tra cui in cellule infiammatorie, endoteliali e fibroblasti del tessuto neoplastico.
Alla luce di queste considerazioni oggi sappiamo che l’aspirina non è potenzialmente utile soltanto per la prevenzione del cancro, ma è anche somministrato come adiuvante delle oncoterapie. In vari studi condotti su animali è già stato dimostrato che l’ASA è capace di sopprimere la crescita cellulare di vari tipi di tumori, compreso il CRC, riducendo il rischio di metastasi e di mortalità. Tuttavia ancora oggi non sono del tutto chiari i meccanismi con cui l’ASA agisce sulla cancerogenesi e ci sono più ipotesi a riguardo.
Meccanismo d’azione chemiopreventivo COX dipendente – “ipotesi piastrinica”
Con “ipotesi piastrinica” (figura 4) si fa riferimento al fatto che uno degli eventi iniziatori della cancerogenesi intestinale è l’aggregazione e degranulazione piastrinica. Si tratta di un evento che avviene a livello dei vasi della mucosa intestinale in seguito a una lesione, per esempio una lesione pre-neoplastica. Questo porta al rilascio di molecole flogistiche da parte delle piastrine che promuovono l’infiammazione tessutale e l’aumento di espressione di COX2 nelle cellule intestinali. Il risultato è una maggiore espressione di fattori infiammatori nella mucosa, con effetti di iperplasia, transizione epitelio mesenchima (EMT) e trasformazione cellulare in fenotipo maligno. L’effetto chemiopreventivo dell’ASA è attribuito all’inibizione di COX1 piastrinico e di conseguenza della sintesi di molecole infiammatorie che aumenterebbero la sintesi di COX2 nell’epitelio.

Meccanismi d’azione chemiopreventivi COX-indipendenti
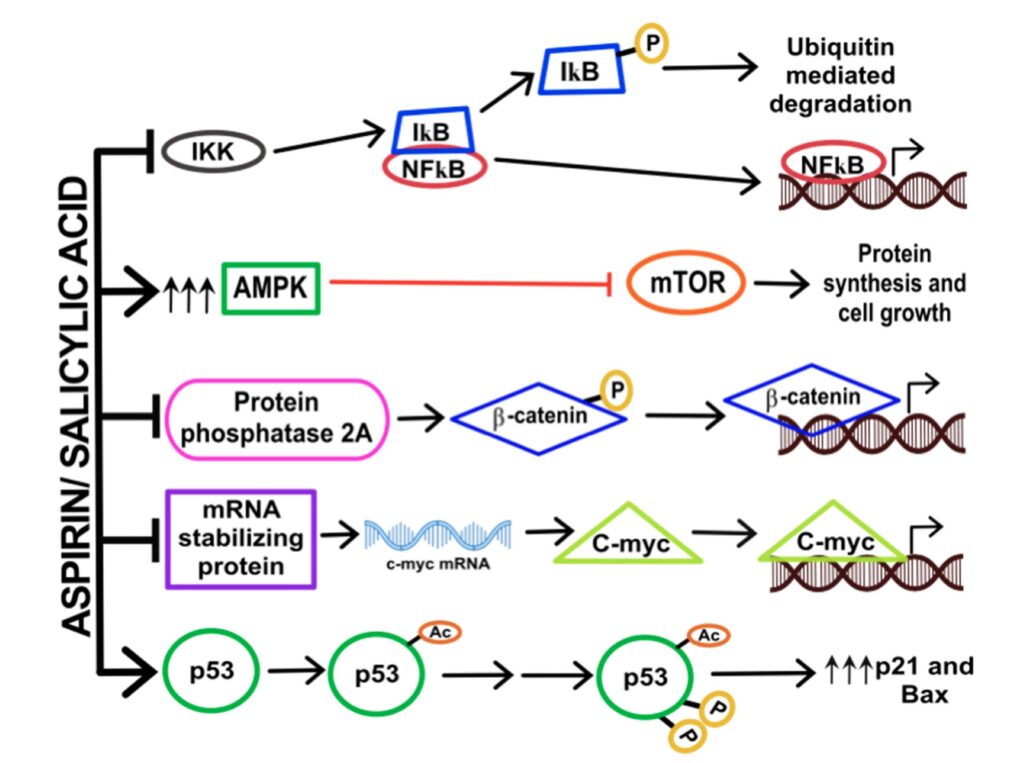
Come si vede in figura 5, pur non agendo su COX, l’ASA è lo stesso capace di esplicare funzioni di carattere antinfiammatorio e antitumorale. In particolare, può farlo sia inibendo che attivando determinati pathways.
Innanzitutto, l’ASA promuove l’attivazione di una proteinchinasi (ovvero aggiunge gruppi fosfato), detta AMPK (AMP-Activated Protein Kinase), che è capace di inibire mTOR, ovvero un’altra proteinchinasi da cui diparte una cascata di signaling che guida proliferazione, mortalità e sopravvivenza cellulare. ASA è inoltre capace di attivare p53, detto guardiano del genoma, ovvero una proteina in grado di segnalare danni al DNA bloccando il ciclo cellulare, oppure mandando la cellula in morte programmata. Circa il 50% dei tumori possiede mutazioni inattivanti in p53 con proliferazione cellulare incontrollata e cancerogenesi. ASA è capace di acetilare (Ac) e fosforilare (P) sia la forma mutata che non mutata di p53, modifiche che la fanno migrare nel nucleo attivando la trascrizione di proteine antitumorali (come p21 e BAX).
Tra le vie inibite da ASA troviamo l’espressione di C-MYC, ovvero un oncogene (gene della proliferazione tumorale). Il fattore trascrizionale per cui codifica, suo omonimo (C-MYC), controlla l’espressione di circa il 15% dell’intero genoma e si trova iperespresso nel 20% di tutti i tumori, promuovendo proliferazione e metastasi. L’effetto di ASA è quello di inibire C-MYC e promuovere segnali antitumorali come l’autofagia. Infine, molti tumori colorettali vedono mutazioni inattivanti del gene APC che causa iperattivazione di una via pro-tumorale detta Wnt/ß-catenina. Questa via è tale che se attiva (non inibita da APC), la ß-catenina (proteina del citoscheletro cellulare) migra nel nucleo attivando la trascrizione di geni coinvolti in proliferazione, motilità e invasione cellulare. In più, ASA blocca la migrazione nel nucleo anche di NFkB, ovvero una oncoproteina.
Prospettive future per l’utilizzo dell’aspirina nella chemioprevenzione
Attualmente uno degli studi più vasti sul ruolo dell’ASA nella prevenzione tumorale è il CAPP3 (Cancer Prevention Project 3). Tale studio coinvolge pazienti con sindrome di Lynch, forma ereditaria di CRC, a cui vengono somministrate in modo randomizzato dosi differenti di aspirina (100mg, 300mg, 600mg) al giorno per due anni. Cominciato nel 1999, le analisi avranno inizio alla fine del processo di reclutamento dei pazienti, stimato nel 2024, e i dati dovrebbero essere pubblicati tra il 2024 e il 2025. L’obiettivo principale del progetto è quello di comprendere il reale effetto dell’aspirina e quale è il minor dosaggio capace di mantenere, con somministrazioni a lungo termine, i benefici chemioprotettivi ad oggi noti dell’ASA.
Tuttavia, le maggiori linee guida internazionali sono concorde nel frenare l’entusiasmo che negli ultimi decenni si sta diffondendo in tale ambito. L’AIFA (Agenzia Italiana del Farmaco), in una nota del 15 Novembre 2018, intende precisare proprio che nonostante in letteratura ci siano informazioni incoraggianti circa l’utilizzo dell’ASA nella prevenzione primaria e secondaria per il CRC, i dati che ad oggi possiede non permettono l’autorizzazione di nuove indicazioni in questo ambito terapeutico. Analogamente, l’americana USPSTF (US Preventive Services Task Force) aveva per la prima volta raccomandato nel 2016, tra le linee guida di prevenzione al CRC, l’utilizzo di aspirina in individui tra 50-59 anni con rischio del 10% di malattie cardiovascolari nei 10 anni successivi. Tuttavia, nel 2022, una revisione delle stesse ha portato a concludere inadeguate le evidenze per cui una dose bassa di ASA riduce mortalità e incidenza di CRC.
Dunque, a fronte di evidenze, talvolta anche concrete, dell’effetto protettivo dell’ASA per il CRC, ad oggi l’ingresso nella quotidianità clinica sembra non essere immediato. Rimane comunque un tema di forte interesse nei laboratori di tutto il mondo.
Abbreviazioni
- AA: Acido Arachidonico
- AIFA: Agenzia Italiana del Farmaco
- AMPK: AMP-Activated Protein Kinase
- ASA: Acido acetilsalicilico (principio attivo dell’aspirina)
- EMT: Transizione Epitelio Mesenchima
- FANS: Farmaci antinfiammatori non steroidi (famiglia farmacologica di appartenenza dell’aspirina)
- FAP: Poliposi Adenomatosa Familiare
- CAPP3: Cancer Prevention Project 3
- COX: Ciclossigenasi (enzima target dell’aspirina)
- CRC: Cancro Colorettale
- MYC: Myelocytomatosis oncogene
- PGs: Prostaglandine
- TX: Trombossano
- USPSTF: US Preventive Services Task Force
Fonti
- https://www.delcarbonioealtrestorie.com/2018/12/dal-salice-allaspirina-la-storia-del.html
- https://www.capp3.org/about.aspx
- https://jamanetwork.com/journals/jamaoncology/article-abstract/2794801
- https://ascopost.com/issues/december-10-2021/update-on-the-role-of-low-dose-aspirin-in-colorectal-cancer-prevention/
- Brune, Kay & Patrignani, Paola. (2015). New insights into the use of currently available non-steroidal anti-inflammatory drugs. Journal of pain research. 8. 105-18. 10.2147/JPR.S75160.
- Din FV, Valanciute A, Houde VP, et al. Aspirin inhibits mTOR signaling, activates AMP-activated protein kinase, and induces autophagy in colorectal cancer cells. Gastroenterology. 2012;142(7):1504-15.e3. doi:10.1053/j.gastro.2012.02.050
- Drew DA, Cao Y, Chan AT. Aspirin and colorectal cancer: the promise of precision chemoprevention. Nat Rev Cancer. 2016;16(3):173-186. doi:10.1038/nrc.2016.4
- Faki Y, Er A. Different Chemical Structures and Physiological/Pathological Roles of Cyclooxygenases. Rambam Maimonides Med J. 2021;12(1):e0003. Published 2021 Jan 19. doi:10.5041/RMMJ.10426
- Fijałkowski Ł, Skubiszewska M, Grześk G, Koech FK, Nowaczyk A. Acetylsalicylic Acid-Primus Inter Pares in Pharmacology. Molecules. 2022;27(23):8412. Published 2022 Dec 1. doi:10.3390/molecules27238412
- Ganduri V, Rajasekaran K, Duraiyarasan S, Adefuye MA, Manjunatha N. Colorectal Carcinoma, Cyclooxygenases, and COX Inhibitors. Cureus. 2022;14(8):e28579. Published 2022 Aug 30. doi:10.7759/cureus.28579
- Gilman Goodman Alfred, Goodman Luois S., Theodore W. Rall., Murad Ferid, Le basi farmcologiche della terapia. Settima edizione (1987) edizione italiana a cura di Nicola Montanaro; Bologna, Zanichelli. (p.627-636)
- Sankaranarayanan R, Kumar DR, Altinoz MA, Bhat GJ. Mechanisms of Colorectal Cancer Prevention by Aspirin-A Literature Review and Perspective on the Role of COX-Dependent and -Independent Pathways. Int J Mol Sci. 2020;21(23):9018. Published 2020 Nov 27. doi:10.3390/ijms21239018
Crediti immagini
- Immagine in evidenza: https://www.medpagetoday.com/hematologyoncology/coloncancer/101243
- Figura 1: https://www.delcarbonioealtrestorie.com/2018/12/dal-salice-allaspirina-la-storia-del.html
- Figura 2 e 3: Faki Y, Er A. Different Chemical Structures and Physiological/Pathological Roles of Cyclooxygenases. Rambam Maimonides Med J. 2021;12(1):e0003. Published 2021 Jan 19. doi:10.5041/RMMJ.10426
- Figura 4 e 5: Sankaranarayanan R, Kumar DR, Altinoz MA, Bhat GJ. Mechanisms of Colorectal Cancer Prevention by Aspirin-A Literature Review and Perspective on the Role of COX-Dependent and -Independent Pathways. Int J Mol Sci. 2020;21(23):9018. Published 2020 Nov 27. doi:10.3390/ijms21239018