Questo articolo fa parte di una rassegna generale sul mondo della microscopia ottica. E’ stato preceduto da una panoramica sulle principali tecniche microscopiche e prima ancora da un’introduzione allo strumento microscopio.
Quando e perchè colorare
In microscopia ottica si utilizzano numerose tecniche di colorazione; esse consentono di aumentare il contrasto tra cellula ed ambiente circostante, permettendo così l’osservazione sia della morfologia cellulare, sia della struttura delle sue singole componenti (organelli, corpi d’inclusione, spore, flagelli, etc..).
Ricorrere alle colorazioni si rende necessario perchè, come abbiamo visto in precedenza, la maggior parte dei microrganismi presenta una scarsa differenza di contrasto tra corpo cellulare, quasi trasparente, ed ambiente acquoso, in particolare laddove manchino dei pigmenti interni.
Il fine primario di ogni colorazione é quello di permettere la corretta identificazione delle specie microbiche in esame.
Per questo motivo esistono numerose tecniche, ciascuna delle quali si basa sull’uso di un solo colorante oppure su quello di più sostanze in combinazione.
In generale, possiamo dire che esistono tre categorie di colorazioni:
- Le colorazioni che permettono selettivamente l’identificazione di una singola specie.
- Quelle che agiscono su più specie diverse, sfruttando la specifica reazione tintoria che ogni microrganismo possiede nei confronti di una stessa sostanza. Un esempio è la colorazione di Gram.
- Quelle che non colorano i microrganismi, ma unicamente lo sfondo, ponendo cosi’ in evidenza per contrasto con la superficie di fondo questi ultimi indiscriminatamente. E’ il caso ad esempio delle tecniche in negativo.
Per scegliere una colorazione da applicare ad un campione è perciò indispensabile come prima cosa chiedersi cosa si desidera osservare di preciso ed avere ben chiara inoltre la natura del colorante da utilizzare.
Ogni colorante (o combinazione di coloranti) è stato infatti concepito tenendo conto delle caratteristiche chimico – cellulari di alcune specie microbiche più che di altre.
Colorazioni specifiche per i batteri gram negativi o gram positivi non permetteranno ad esempio di rilevare eventuali presenze fungine. Allo stesso modo, i coloranti per i funghi (quali il lattofenolo cotton blue) non consentiranno, in genere, di vedere tutte le specie batteriche che pure potrebbero trovarsi nel campione.
In poche parole: si vede soltanto ciò che si colora.
Esistono ovviamente anche colorazioni generiche, capaci di evidenziare in una sola volta microrganismi molto differenti tra loro, che sono di normale utilizzo nella pratica clinica (ad esempio la tecnica Wright-Giemsa).
Per concludere, una menzione speciale va fatta a proposito di quelle colorazioni che sono state ideate per permettere l’osservazione specifica di certe componenti cellulari normalmente non visibili in un esame a fresco. E’ il caso della colorazione di Leifson, che evidenzia i flagelli batterici, oppure della Schaeffer-Fulton, specifica per le endospore.
Prima di mettere mano allo strumento, un buon microscopista deve quindi saper cercare in letteratura scientifica quale colorazione si addice maggiormente all’oggetto della sua indagine, così da scegliere la metodica più appropriata.
La natura chimica dei coloranti
Tutti i coloranti utilizzati in Microbiologia sono composti organici che hanno affinità chimica per specifici componenti cellulari.
Si tratta di particolari molecole derivate dall’anilina (a sua volta estratta dal catrame), le quali hanno al loro interno un gruppo funzionale (cioè una specifica combinazione o gruppo di atomi) che presenta proprietà cromofore a causa dell’assetto assunto dai suoi elettroni. Essi vengono infatti eccitati da lunghezze d’onda normalmente presenti nella luce visibile e quando le riemettono, trasmettono il colore corrispondente.
Queste sostanze si legano alla loro struttura bersaglio (la parete cellulare, gli acidi nucleici, i flagelli, etc..) attraverso un legame di tipo ionico. Sono infatti sali e quando devono essere preparate vengono sciolte in acqua, dove dissociano in ioni carichi positivamente oppure negativamente.
Per questo motivo, esse si suddividono in due grandi categorie:
- coloranti di tipo basico (o cationico): sostanze che in acqua ionizzano assumendo carica positiva. Ne sono un esempio: blu di metilene, fucsina basica, cristalvioletto, safranina e violetto di genziana. I coloranti basici hanno affinità per tutte quelle componenti cellulari che presentano carica opposta (quindi negativa): acidi nucleici, proteine (in larga parte), superficie cellulare batterica (Fig.1).
- coloranti di tipo acido (o anionici): sono sostanze che in acqua ionizzano assumendo carica negativa. Ne sono un esempio: rosso Congo, fucsina acida ed eosinato di sodio. I coloranti acidi presentano affinità per tutte quelle componenti cellulari che presentano carica opposta (quindi positiva): citoplasma batterico, alcune proteine, miceli fungini (Fig.2).
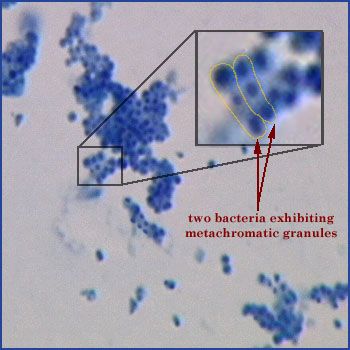
Ciò è causato dei granuli di polifosfato che i Corynebacteria accumulano in natura nel loro citoplasma, i quali assumono appunto una colorazione differente rispetto al resto della cellula.

Senza scendere nei dettagli, per evitare ambiguità bisogna infine sottolineare che quando si parla di coloranti cationici o anionici non ci si riferisce al grado di ionizzazione complessiva della molecola, come normalmente avviene in Chimica, ma unicamente a quello del suo gruppo funzionale.
Dal momento che si tratta di sostanze organiche, i coloranti vengono preparati e venduti in soluzione alcolica (10 g di sale ogni 100 ml di alcool assoluto, la cosiddetta “soluzione madre”), così da risultare conservabili più a lungo. Al momento dell’utilizzo sarà necessario tuttavia diluirli in acqua per consentirne la dissociazione elettrolitica.
La forma pronta all’uso é in genere costituita come soluzione idroalcolica al 10%, salvo diversa indicazione del fornitore o della letteratura: basta perciò semplicemente prendere 10 ml di soluzione madre e diluirli in 90 ml di acqua distillata.
Colorazioni semplici e colorazioni differenziali
Molti coloranti basici (come ad esempio il blu di metilene o la fucsina fenicata) sono in grado di colorare un gran numero di specie microbiche indistintamente; quando si utilizza questo tipo di sostanze, la tecnica prevede il ricorso ad un unico colorante, dal momento che la risoluzione che esso fornisce è tale che non c’è bisogno di applicarne altri (Fig.3).

Si parla in questo caso di “colorazione semplice” , la quale, a secondo del tipo di colorante, può essere effettuata in due modalità differenti:
- progressiva, che si esegue con soluzioni tintoree molto diluite, la cui l’applicazione viene interrotta prima di ipercolorare il campione;
- regressiva, in cui si effettua invece una ipercolorazione e successivamente si applica tramite lavaggio del vetrino una sostanza decolorante (differenziatore), la cui azione viene interrotta tempestivamente. I principali differenziatori sono l’etanolo, l’acetone e l’acido solforico al 20%.
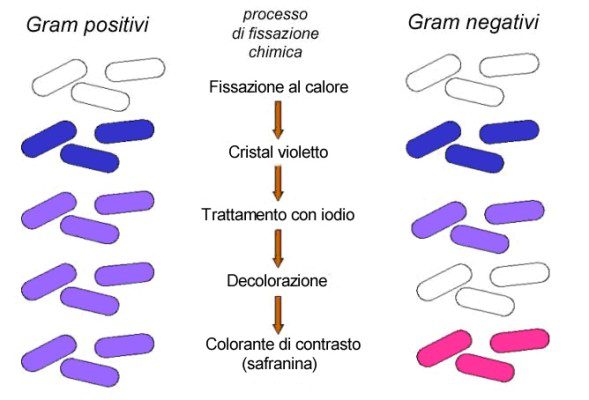
Le “colorazioni differenziali” sono invece tecniche che prevedono l’utilizzo in successione di due o più coloranti diversi. Vengono utilizzate per distinguere tra loro le varie tipologie di microrganismi presenti in un campione, oppure quando si desidera studiare due (o più) differenti strutture cellulari di uno stesso microrganismo (Fig.4).

In queste metodiche si sfruttano, oltre ai differenziatori, anche particolari reagenti detti mordenzanti.
Vediamo insieme che cosa sono ed a cosa servono.
I mordenzanti
Si tratta di sostanze che fissano il colorante alla struttura cellulare di cui è bersaglio, in quanto reagiscono chimicamente con esso per dare un prodotto che ha particolari caratteristiche di stabilità e di penetrazione.
L’esempio di mordenzante di sicuro più conosciuto (Fig.5) è il liquido di Lugol (una soluzione di iodio iodurato) utilizzato nella colorazione di Gram. Tuttavia, altrettanto importanti sono ad esempio il fenolo, l’acido fenico e l’acqua di anilina.
A seconda della tecnica, il mordenzante può essere miscelato al colorante prima della sua applicazione oppure aggiunto ad esso subito dopo (o ancora, subito prima).
Le problematiche delle colorazioni
La maggior parte dei coloranti uccide le cellule presenti nel campione da analizzare; tuttavia ne esistono anche altri che invece permettono di preservarne la vitalità, consentendo di studiare ad esempio il movimento dei microrganismi.
E’ quindi necessario che il microscopista si informi bene sulla sostanza e sulla tecnica che intende utilizzare, alla luce del suo obiettivo finale.
L’analisi del vetrino inoltre dev’essere condotta effettuando sempre un confronto coi risultati già presenti in letteratura, perchè durante la colorazione possono crearsi accidentalmente artefatti a causa di reazioni chimiche indesiderate tra sostanze utilizzate e componenti cellulari.
Le tecniche in negativo
Laddove si desideri osservare microrganismi che non si colorano facilmente, oppure nei casi in cui esista il rischio di alterare la morfologia degli stessi, si utilizza le colorazioni in negativo.
Come abbiamo detto in precedenza, in queste tecniche il colorante utilizzato non si fissa alle cellule microbiche, ma si deposita intorno ad esse, creando così uno sfondo monocromatico sul quale i microrganismi spiccano (incolori) per contrasto (Fig.6).

Le sostanze maggiormente utilizzate in queste metodiche sono il nero china e la nigrosina, oltre a molti coloranti di tipo acido.
Fonti
Bibliografia
- Giuseppe Sicheri. Chimica delle fermentazioni. Milano: editrice Ulrico Hoepli, 2005
- Lansing M.Prescott, John P. Harley. Microbiologia. Bologna: edizioni Zanichelli, 2005
Crediti per le immagini
Immagine in evidenza:
Figura 1:
Figura 2:
Figura 3:
Figura 4:
Figura 5:
Figura 6: