Obiettivo della tecnica
La colorazione di Leifson è una colorazione specifica per i flagelli batterici, le principali strutture di movimento che consentono ai batteri la chemiotassi in ambienti fluidi (per approfondire sulla struttura e sulla fisiologia del flagello batterico, rimandiamo al nostro articolo: https://www.microbiologiaitalia.it/batteriologia/il-movimento-flagellare/).
Viene in genere utilizzata con due possibili scopi diversi: per distinguere tra loro batteri flagellati, morfologicamente simili, presenti in un campione e che differiscano solo nella disposizione dei flagelli, oppure durante l’analisi di materiale da biopsia gastrica in cui si desidera individuare l’eventuale presenza del patogeno Helicobacter pylori.
Nel primo caso, la colorazione di Leifson si applica ad esempio quando si sospetta un’infezione enterica da Pseudomonas: essa presenta infatti flagelli di tipo polare, a differenza degli altri batteri gram negativi del microbiota enterico che sono invece peritrichi.
Generalizzando quest’applicazione, la colorazione di Leifson può ovviamente anche essere utilizzata a scopo tassonomico per identificare, insieme ad altri metodi di colorazione (giemsa, gram, etc.), batteri tra loro correlati dal punto di vista della classificazione ma che si distinguono unicamente per la posizione dei flagelli in parti diverse lungo il “corpo cellulare”, se il lettore ci consente questa espressione (Fig.1).
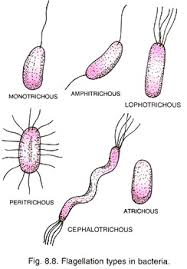
Figura 1 – I flagelli possono trovarsi in posizioni differenti; in base ad essa, i batteri si possono classificare in modo diverso: lofotrichi, peritrichi, monotrichi, etc. Alcuni batteri noti hanno inoltre solo flagelli di un certo tipo e questo, unito ad altre tecniche di analisi, permette d’identificarli in maniera univoca.
Nel secondo caso invece, questa colorazione viene applicata ad uno striscio di materiale ottenuto da biopsia gastrica ma occorre precisare che, dal punto di vista clinico, non basta affatto una colorazione istologica di Leifson da sola per determinare una diagnosi d’infezione da Helicobacter pylori: occorrono anche i risultati di altri esami specifici a sostegno.
Questo in quanto H. pylori può far parte, benché in minima parte, del fisiologico microbiota umano ed è pertanto il suo proliferare oltre una certa soglia, piuttosto che la sua semplice presenza, a scatenarne la patogenicità.
La colorazione di Leifson non viene pertanto riconosciuta dalla comunità medica una tecnica clinica di tipo diagnostico risolutivo, in senso stretto, laddove si sospetti un’infezione da questo batterio.
Che cos’è e come funziona
La colorazione di Leifson deve il proprio nome al suo inventore, il Dottor Einar Leifson del Dipartimento di Patologia e Batteriologia della John Hopkins University, che la mise a punto nel 1930.
I flagelli batterici hanno in media un diametro che si aggira tra i 12 ed i 30 nanometri: la dimensione di queste strutture è pertanto al di sotto del limite massimo di risoluzione del normale microscopio ottico ed esse risultano perciò normalmente invisibili a tale strumento.
Per tale motivo, questa tecnica di colorazione prevede il trattamento preliminare del campione che si vuole osservare, debitamente strisciato su vetrino, con un particolare mordenzante (un composto che aiuta cioè il fissaggio del colore, aderendo selettivamente con la struttura batterica interessata) detto: Reagente di Leifson.
Si tratta di una soluzione idroalcoolica al 10% di sali dell’acido tannico complessati con la Fucsina, un colorante basico molto usato in microscopia ottica: essi precipitano intorno ai flagelli, avendo un’ affinità selettiva per le proteine che li costituiscono e cristallizzandovi intorno ne inspessiscono notevolmente la struttura, portandola cosi’ a dimensioni nel limite di risoluzione dello strumento.
La fucsina è con un colorante primario basico, carico positivamente, che si lega alle stesse proteine flagellari, cariche invece negativamente, per semplice interazione ionica; coadiuvata tuttavia dal mordenzante, essa le colora in modo da rendere i flagelli ben osservabili anche a bassi ingrandimenti, cosa che altrimenti non farebbe.
Successivamente, il campione viene sottoposto ad un colorante secondario che ha invece il fine di colorare unicamente le cellule batteriche.
Riguardo alla natura di tale colorante, i protocolli attualmente in uso possono differire: lo stesso Dottor Leifson, nel suo saggio di presentazione, testò diverse sostanze basiche ed indicò come ugualmente valide, ai fini dei risultati, tanto la stessa Fucsina basica (in forma stavolta di semplice soluzione acquosa) quanto il cristalvioletto oppure il blu di metilene.
Essendo tuttavia proprio il blu di metilene il colorante maggiormente diffuso nella comune pratica clinica, in questo articolo lo si assumerà come riferimento.
Un’importante precauzione su cui richiamiamo l’attenzione del lettore è che, diversamente da quanto accade nelle altre tecniche principali di colorazione in uso nella microscopia ottica, il campione che si vuole trattare con la colorazione di Leifon non dev’essere assolutamente fissato a caldo in via preliminare dopo lo striscio!
In questa metodica infatti la fissazione al calore viene sostituita da quella ad aria secca, che non rischia di denaturare le proteine flagellari e ne lascia quasi intatte le cariche elettrostatiche di superficie con cui dovrà reagire il mordenzante.
Materiale occorrente
- reattivo di Leifson
- blu di metilene (soluzione all’ 1%)
- una spruzzetta con acqua distillata
- un vetrino per osservazioni al microscopio
Procedimento
- se il campione che si desidera analizzare proviene da coltura cellulare, aggiungere qualche goccia di acqua distillata (in base alla sua quantità) e lasciar incubare per venti minuti. In caso contrario, come accade ad esempio per campioni ottenuti da biopsia, questo passaggio può essere evitato;
- strisciare il campione da osservare sul vetrino e successivamente effettuare una fissazione con aria secca, quindi lasciar raffreddare;
- applicare il reattivo di Leifson con l’ausilio di un contagocce e lasciar agire fino alla formazione di una sottile pellicola traslucida, ben visibile, su tutto il campione;
- effettuare un lavaggio del vetrino, per rimuovere il mordenzante in eccesso, con acqua distillata, quindi asciugare;
- applicare il blu di metilene con l’ausilio di un contagocce e lasciar agire per circa un minuto;
- effettuare un lavaggio con acqua distillata per rimuovere il colorante in eccesso ed asciugare.
Il vetrino cosi’ trattato è pronto per l’osservazione al microscopio ottico.
Osservazione del vetrino
Si consiglia di utilizzare ingrandimenti superiori al 10x per l’osservazione del vetrino, variando il revolver del microscopio secondo le finalità dell’analisi.
I flagelli batterici appariranno coloranti di un’accesa tonalità rossa, mentre le cellule batteriche appariranno invece in blu (Fig.2).

Figura 2 – Un possibile risultato della colorazione di Leifson
Quest’ultima condizione può ovviamente variare in base al fatto che si sia usato come secondo colorante il blu di metilene o un altro colorante: nel caso si sia optato per la fucsina basica infatti i batteri risulteranno invece coloranti di rosso (Fig.3).
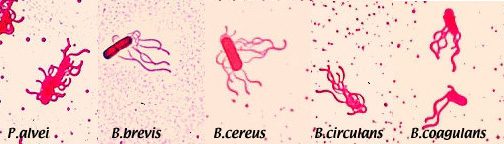
Figura 3 – Come si vede dal’immagine, la posizione dei flagelli, benchè di certo non risolutiva in sè, può comunque aiutare nel processo d’identificazione della specie e classificazione tassonomica, in un unione con altre tecniche.
Sitografia di riferimento:
L’originale dell’articolo del 1930 del Dottor Leifson può essere consultato al seguente link:
Ai link seguenti, possono invece essere consultate altre informazioni generali riguardati i fondamenti delle metodiche di colorazione, per la microscopia ottica, maggiormente utilizzati in microbiologia:
https://www.docsity.com/it/microbiologia-per-medicina/2258467
http://docplayer.it/6340595-Colorazioni-e-test-biochimici-in-microbiologia.html
Riguardo alla natura chimica dell’acido tannico, il principale costituente del mordenzante di Leifson, si rinvia invece a questa pagina:
https://it.wikipedia.org/wiki/Acido_tannico
Riguardo alla natura chimica del blu di metilene, il colorante primario di questa tecnica:
https://it.wikipedia.org/wiki/Blu_di_metilene
Crediti per le immagini
Immagine in evidenza:
Figura1:
Figura 2:
Figura 3: