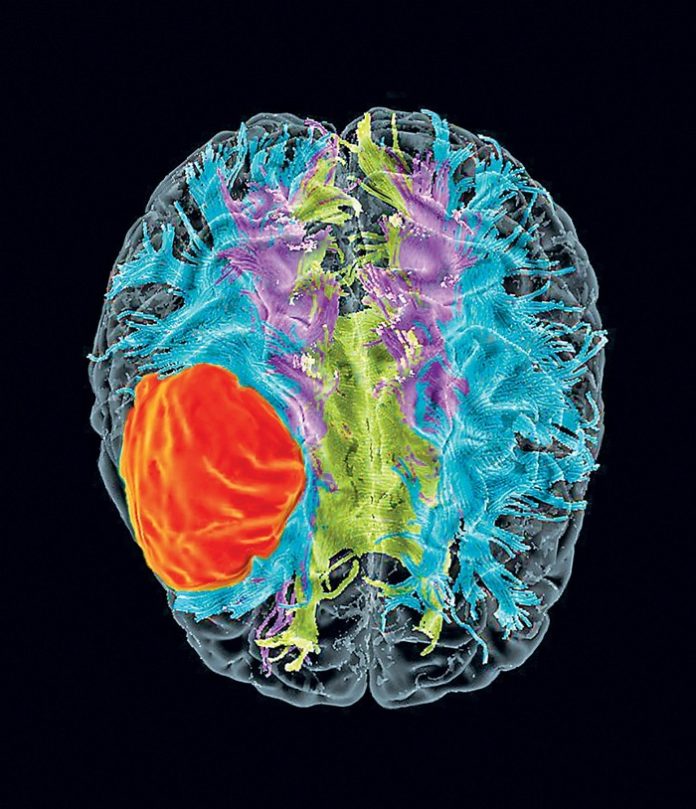
Nel quinquennio 2012-2017 è stato condotto un importante e proficuo studio sul glioblastoma multiforme (Figura 1) ed il suo trattamento non convenzionale con poliovirus modificato geneticamente. Il progetto ha dato il via ad un filone di ricerca particolare, che vede come protagonisti nella lotta contro i tumori proprio i microrganismi.
Il glioblastoma multiforme (GBM) è il tumore cerebrale più aggressivo che si conosca tra le neoplasie della glia. Trattasi precisamente di un tumore del Sistema Nervoso Centrale (SNC) caratterizzato da un elevato grado di malignità ed una notevole velocità di crescita. Il tumore risulta difficilmente trattabile.
La verità è che in 40 anni sono stati fatti pochi progressi nella cura dei tumori cerebrali solidi. L’attuale terapia standard prevede la combinazione di metodiche quali radioterapia e chemioterapia, assai debilitanti. Solo nel 2018 è stato confermato il successo del trattamento di GBM con virus oncolitici, senza alcuna tossicità per l’organismo.
L’era di una nuova terapia
Viroterapia, questo il nome della metodica che si avvale dell’utilizzo di virus ricombinati ad hoc in laboratorio, utilizzata nella cura di diversi tipi di tumore; il linfoma di Burkitt ed il linfoma di Hodgkin in primis.
La nuova tecnologia nasce dall’analisi di una connessione tra regressione del tumore ed infezioni virali non correlate ad esso, teorizzata a lungo a partire dagli anni ’60. Generalmente sono impiegati virus in grado di determinare oncolisi nella cellula infettata quali adenovirus, poliovirus (PV), virus del morbillo ed herpes simplex.
Ognuno di essi ha dimostrato non solo di avere uno spiccato tropismo per le cellule tumorali ma anche di essere estremamente selettivo per un tumore specifico. Il meccanismo d’azione è molto semplice: vengono rilasciati virioni nelle cellule bersaglio, ovvero le cellule tumorali dell’ospite. Successivamente entrano in gioco gli agenti e gli enzimi che danno il via alla lisi della cellula infettata.
Si intuisce facilmente che una delle conseguenze più interessanti di questo processo consiste nella stimolazione di una risposta immunitaria (immunoterapia) nei confronti del tumore stesso. Provocando l’infezione si attirano nel sito neoplastico linfociti, monociti/macrofagi e cellule dendritiche e questo aiuta a sviluppare una sorta di immunità antitumorale.
Immunoterpia e cervello
L’immunoterapia è una metodica che ha riscosso interesse come possibile cura dei tumori solo di recente.
Lo scopo dell’immunoterapia è quello di indurre e/o amplificare la risposta immunitaria dell’organismo. Il sistema immunitario (S.I.) del paziente viene stimolato dagli antigeni tumorali espressi sulla superficie delle cellule maligne. Essi, essendo notoriamente differenti da quelli esposti sulla superficie delle cellule sane, appaiono estranei all’organismo, inducendo così l’attivazione delle cellule natural killer (NK) e dei linfociti T citotossici (CTL).
L’immunoterapia, in questo modo, espone anche le cellule tumorali che si sono nascoste al S.I. (Figura 2), distruggendo definitivamente il tumore.
Tuttavia il cervello è un sito immunologicamente privilegiato, in grado ovvero di tollerare la presenza di antigeni o cellule estranee. Così, senza scatenare necessariamente una risposta anticorpale con conseguente infiammazione, si evita un danno all’ambiente circostante.
Fortunatamente il SNC non è passivo nelle sue interazioni con il sistema immunitario e l’immunoterapia ha successo: le cellule immunitarie periferiche possono attraversare la BEE intatte. Inoltre, si è scoperto che le cellule microgliali sono immunocompetenti ed agiscono come principale difesa per il SNC.

Virus oncolitici: PVSRIPO
Ingegneria genetica, manipolazione virale, agenti ricombinanti. Sì, ma di cosa stiamo parlando?
PVSRIPO è un polio-rhinovirus chimerico non patogeno, con una spiccata attività anti-neoplastica. Manipolato per replicarsi preferibilmente nelle cellule cancerose residue, il virus genera molecole in grado di innescare la risposta immunitaria. Normalmente la replicazione virale di PV è consentita in seguito al legame tra le proteine del capside virale ed recettore di membrana CD155/Necl-5, ampiamente espresso anche nelle cellule tumorali. La traduzione dell’RNA virale, a sua volta, è diretta dal cosiddetto sito di ingresso ribosomiale interno o IRES.
Grazie all’ingegneria genetica è stato possibile sostituire l’IRES di questo virus con quello del Rhinovirus umano di tipo 2 (HRV2) in modo da escludere il fattore “neurovirulenza” dal virus utilizzato come potenziale cura anti-tumorale. Il poliovirus modificato si lega alle cellule bersaglio presentanti la glicoproteina transmembrana CD155 (Figura 3), tra cui, ricordiamolo, le cellule maligne, ma è difatti incapace di replicarsi nei neuroni. Esso è impossibilitato a reclutare i complessi ribosomiali dell’ospite e di tradurre il genoma virale.
In vivo
La ricerca pioneristica della Duke University, che ha raccolto i dati di uno studio durato ben 5 anni (2012-2017) sul trattamento non tradizionale del glioblastoma multiforme e pubblicata sul New England Journal of Medicine nel 2018, è stata utilizzata con successo per un caso clinico molto complesso: un uomo di circa 60 anni, affetto da glioblastoma multiforme ricorrente anche dopo asportazione chirurgica.
Il paziente è stato curato all’University Hospitals (UH) Seidman Cancer Center con una somministrazione intratumorale diretta, dopo un’attenta fase sperimentale per la determinazione della dose terapeutica efficace da somministrare, che non prevedesse, ovviamente, effetti collaterali. Da valutare se la riduzione della massa tumorale è duratura nel tempo.

Perché proprio il glioblastoma multiforme?
Il GBM è contraddistinto da una prognosi dei pazienti sfavorevole ed una mortalità molto alta. Difatti presenta una crescita solitamente silente e asintomatica, diventando diagnosticabile quando oramai si trova in una fase piuttosto avanzata.
Questo tumore è scarsamente sensibile alla chemio e radio-terapia: nella maggior parte dei casi sia le radiazioni che i farmaci chemioterapici inducono le cellule tumorali a sviluppare delle mutazioni che le rendono radio e chemio-resistenti. Inoltre gli effetti potenzialmente pericolosi delle radiazioni, nel caso specifico del cervello, possono causare disturbi cognitivi.
In questo contesto gioca un ruolo determinante anche la barriera emato-encefalica (BEE), che funge da elemento di disturbo per la migrazione dei linfociti infiltranti.
Date le molteplici difficoltà e gli scarsi risultati, la comunità scientifica ha iniziato a chiedersi se non fosse il caso di utilizzare un approccio differente al suo trattamento, che non prevedesse l’utilizzo di farmaci.
L’impiego di un virus geneticamente modificato ha rappresentato un valido esempio di terapia alternativa. In passato altri tentativi verso questa direzione si sono avuti in vitro, utilizzando il fungo medicinale Ganoderma lucidum, di cui abbiamo già parlato. Lo studio ha portato risultati promettenti ed il fungo si è mostrato esente da effetti collaterali.
Carla Caianiello
Fonti:
- Beatty GL, Gladney WL. (2016). Immune escape mechanisms as a guide for cancer immunotherapy. Clinical cancer research; doi: 10.1158/1078-0432.CCR-14-1860
- Desjardins A., Gromeier M., Herndon J. E., Beaubier N., Bolognesi D.P., Friedman A.H., Friedman H.S., McSherry F., M.A., Muscat A. M., Smita Nair S., Peters K.B., Randazzo D. et al. (2018). Recurrent Glioblastoma Treated with Recombinant Poliovirus. The New England Journal of Medicine; doi: 10.1056/NEJMoa1716435
- Fecci P.E., Sampson J.H. (2019). The current state of immunotherapy for gliomas: an eye toward the future. J Neurosurg; doi: 10.3171/2019.5.JNS181762
- https://en.wikipedia.org/wiki/Oncolytic_virus
- https://www.cancer.gov/publications/dictionaries/cancer-drug/def/recombinant-oncolytic-poliovirus-pvs-ripo
- https://www.facebook.com/SocietaItalianadiGeneticaUmana/photos/a.553308238737582/577956252939447/?type=3&theater
- https://www.medimagazine.it/glioblastoma-primo-paziente-trattato-con-poliovirus-geneticamente-modificato/
- Caianiello C. Studio citometrico e immunocitochimico degli effetti indotti dall’integratore a base di Ganoderma lucidum su cellule di glioblastoma umano (U251) in coltura. Tesi sperimentale per la laurea magistrale in Neurobiologia. Università degli Studi di Pavia, a.a. 2016/2017
Buongiorno, vorrei sapere se e dove in Italia ci si possa sottoporre a questa cura sperimentale, grazie!
Ho un familiare con questo tipo di tumore!
Buongiorno, é possibile sapere se in Italia ci sono centri dove ci si può sottoporre a questo tipo di terapia ?
Buon giorno ho mio marito che da 2 mesi gli hanno diagnosticato uno glioblastoma di 4 grado,vorrei sapere dove vengono fatte queste sperimentazioni,vi ringrazio se mi vorrete rispondere tempestivamente Sandra