Introduzione sulle malattie autoimmuni
Le malattie autoimmuni sono patologie che si caratterizzano per una disfunzione del sistema immunitario che aggredisce erroneamente tessuti e strutture del proprio organismo. Quando il sistema immunitario funziona correttamente, è in grado di difendere l’organismo da molecole estranee (antigeni) ritenute in grado di danneggiarlo: ad esempio, quelle associate a batteri, virus e parassiti. Quando invece il sistema immunitario fallisce il suo compito e riconosce il self come estraneo, può produrre cellule immunitarie o anticorpi diretti contro le cellule o tessuti che li hanno prodotti. Ciò causa l’infiammazione e danno tissutale che porta poi alla patologia vera e propria. L’incapacità di distinguere il self da agenti estranei è spesso definita una violazione della tolleranza che è alla base delle malattie autoimmuni, che saranno oggetto di questo articolo.
Tolleranza immunologica
La tolleranza immunologica consiste nell’incapacità del sistema immunitario di rispondere a un determinato antigene, indotta da una precedente esposizione a quello stesso antigene. Quando i linfociti incontrano l’antigene si possono verificare tre condizioni:
- il linfocita viene attivato dando origine a una risposta immunitaria;
- il linfocita può essere inattivato o eliminato, e dare luogo alla tolleranza nei confronti di quell’antigene;
- l’antigene non induce alcuna risposta, né di tipo positivo, né di tipo negativo (anergia).
Esistono due principali modalità di induzione della tolleranza immunologica verso antigeni self: tolleranza centrale e tolleranza periferica.

Tolleranza centrale
La tolleranza centrale si verifica negli organi linfoidi primari (il timo per i linfociti T e il midollo osseo per i linfociti B). I cloni linfocitari immaturi che riconoscono antigeni self durante la loro maturazione vengono eliminati o resi inoffensivi. Infatti i linfociti immaturi, dotati di recettori ad alta affinità per autoantigeni (antigeni self presenti a concentrazione elevata in tali organi), vengono eliminati per apoptosi attraverso un processo noto come selezione negativa o delezione. Invece i linfociti B immaturi che riconoscono con elevata affinità un antigene self presente nel midollo osseo, vengono indotti a modificare la specificità del loro recettore per l’antigene.
Editing recettoriale
Questo processo è chiamato editing recettoriale e consiste nel riarrangiamento genico del recettore per l’antigene del linfocita B autoreattivo, che porterà all’espressione di nuovi recettori che non risulteranno più autoreattivi. Tramite questo meccanismo, la cellula B non muore ma viene resa inoffensiva. Se il processo di editing fallisce, i linfociti B autoreattivi vengono eliminati per apoptosi. La tolleranza centrale è importante per rimuovere i cloni linfocitari auto-reattivi prima che si sviluppino in cellule completamente immunocompetenti.
Tolleranza periferica
Tuttavia i meccanismi di tolleranza centrale non sono perfetti poiché i linfociti, in grado di riconoscere antigeni self, sfuggono alla selezione negativa e possono arrivare in periferia provocando danni tissutali se non sono eliminati o bloccati nei tessuti periferici. La tolleranza periferica è responsabile del mantenimento della tolleranza verso antigeni self tessuto-specifici non presenti a livello timico o midollare. In particolare la tolleranza periferica nei confronti dei linfociti T autoreattivi può verificarsi attraverso tre meccanismi: anergia, delezione e soppressione.
L’Anergia
L’anergia è definita come l’inattivazione funzionale dei linfociti indotta dall’incontro con antigeni self tessuto-specifici. Infatti la piena attivazione dei linfociti T richiede due segnali:
- il riconoscimento dell’antigene presentato da molecole MHC che sono espresse sulla membrana delle cellule APC (cellule che presentano l’antigene);
- vari segnali co-stimolatori o anche definiti “secondi segnali” derivati dalle APC.
I segnali co-stimolatori sono generati dall’interazione di recettori linfocitari, come CD28, con i rispettivi ligandi B7-1 e B7-2 espressi dalle APC. Se il linfocita T riconosce un antigene self in assenza di costimolazione, diventa incapace di rispondere all’antigene. Essi mantengono la capacità di riconoscere self e non self ma non manifestano la loro azione.
Soppressione da parte dei linfociti T regolatori
I linfociti T regolatori sono una sottopopolazione di linfociti T e agiscono bloccando le reazioni autoimmuni. I linfociti T regolatori maturano principalmente nel timo in seguito al riconoscimento di antigeni self, ma possono anche svilupparsi negli organi linfoidi periferici. Essi sono linfociti di tipo CD4+ che esprimono costitutivamente CD25 e un fattore di trascrizione della famiglia FOX, detto FOXP3. FOXP3, insieme anche a IL-2, è essenziale per lo sviluppo e il mantenimento di una popolazione funzionale di linfociti T regolatori. In particolare, si ritiene che le mutazioni del gene Foxp3 siano responsabili di malattie autoimmuni come IPEX (disordine immunologico poliendocrinopico e enteropatico legata all’X). Uno dei meccanismi attraverso cui queste cellule controllano la risposta immunitaria è rappresentato dalla secrezione di citochine immunosoppressive, come IL10 e TGFβ, che inibiscono l’attivazione e le funzioni effettrici dei linfociti.
Delezione dei linfociti T per morte cellulare indotta dall’attivazione
I linfociti T autoreattivi possono essere eliminati attraverso segnali che ne inducano l’apoptosi. Sono stati ipotizzati due diversi meccanismi di apoptosi da attivazione dei linfociti T:
- Un primo meccanismo consiste nel riconoscimento di un antigene self da parte dei linfociti autoreattivi che promuove l’espressione di una proteina pro-apoptotica della famiglia BCL, la proteina BIM, che porta all’attivazione di proteine effettrici che inducono la morte cellulare attraverso la via mitocondriale.
- Un secondo meccanismo utilizza il sistema Fas-FasL. I linfociti esprimono un recettore di morte cellulare denominato Fas(CD95), il cui ligando prende il nome di ligando del Fas(FasL). Il FasL che è espresso principalmente dai linfociti T attivati, può interagire con il recettore Fas espresso dalla stessa cellula o da cellule adiacenti, e questa interazione induce l’apoptosi dei linfociti T autoreattivi.
Cosa sono le malattie autoimmuni?
Una disfunzione dei meccanismi di tolleranza dei linfociti può determinare le malattie autoimmuni caratterizzate da lesioni tissutali. Le malattie autoimmuni possono essere sistemiche cioè estese a tutto l’organismo come il LES oppure organo-specifiche cioè diretta contro un singolo tessuto come il diabete mellito di tipo 1 o la sclerosi multipla.
Secondo un’ipotesi il malfunzionamento del sistema immunitario potrebbe essere scatenato da fattori ambientali (un’infezione o lesioni tissutali), soprattutto nelle persone portatrici di geni che predispongono all’insorgenza di patologie autoimmuni. Infatti sono patologie in cui si riconosce un’eziopatogenesi multifattoriale.
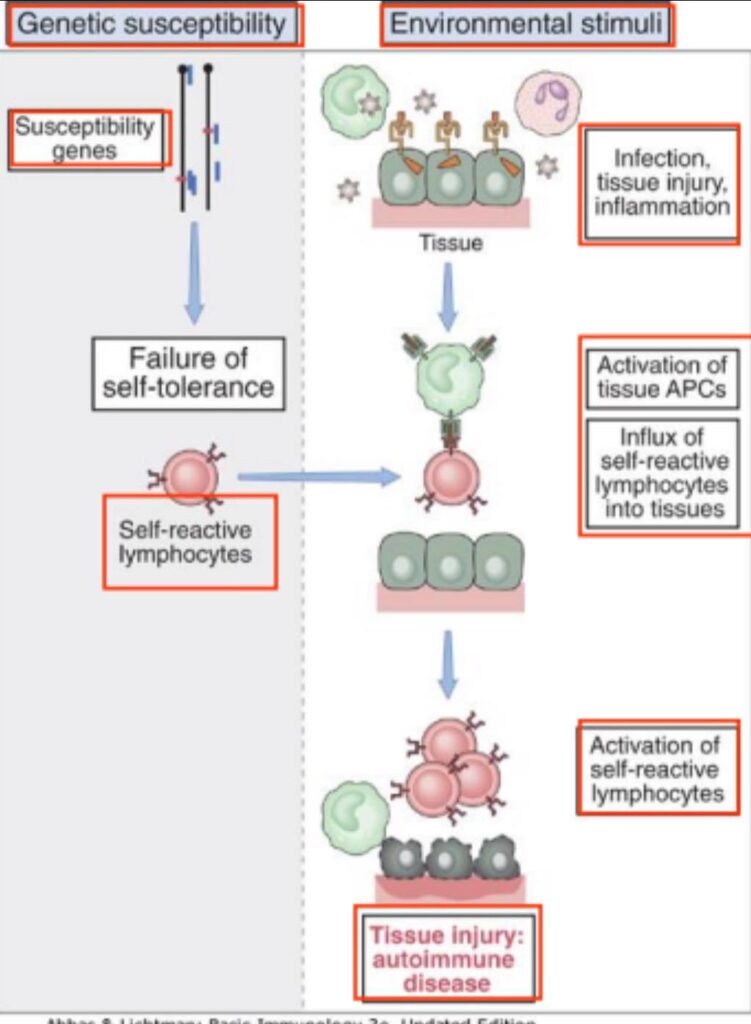
Fin dai primi studi è risultato evidente che le malattie autoimmuni hanno una forte componente genetica. Infatti la maggior parte delle malattie è poligenica ovvero sono determinate dalla mutazione contemporanea di più geni. Tra tutti i geni studiati associati all’autoimmunità, le associazioni più forti sono quelle con i geni MHC, soprattutto con quelle di classe II o HLA nell’uomo. Il meccanismo patogenetico di queste malattie rimane oscuro ma va sottolineato che i soggetti che ereditano specifici alleli HLA hanno un rischio maggiore, rispetto ai soggetti non portatori per quegli alleli, di sviluppare una determinata malattia. Si è potuto osservare che anche geni non MHC siano presumibilmente implicati nello sviluppo di malattie autoimmuni.
Ruolo delle infezioni nell’autoimmunità
Le infezioni batteriche e virali possono favorire lo sviluppo dell’autoimmunità attraverso due principali meccanismi. In primo luogo, le infezioni possono aumentare l’espressione di molecole co-stimolatrici sulle APC. Se l’APC presenta un antigene self, si avrà come risultato la perdita di anergia e questo può portare all’ attivazione dei linfociti T autoreattivi specifici per quell’antigene. In secondo luogo, alcuni antigeni microbici possono essere simili ad alcuni antigeni self attivando i linfociti autoreattivi contro la proteina self. Questo fenomeno è detto “mimesi molecolare”.
Tipi di malattie autoimmuni
Le malattie di tipo autoimmune individuate sono più di 80 e le principali sono:
Lupus eritematoso sistemico(LES): è una malattia autoimmune multisistemica, cioè può coinvolgere qualsiasi organo, ed è caratterizzato dalla produzione di anticorpi anti-nucleo(ANA). Alcuni sono diretti contro varie componenti nucleari e citoplasmatiche, mentre altri riconoscono antigeni di membrana delle cellule ematiche. Non esiste una singola causa specifica responsabile della comparsa del LES, ma la presenza di un numero apparentemente illimitato di autoanticorpi indica che il difetto fondamentale sia un deficit della tolleranza immunologica verso gli antigeni self. Come per la maggior parte delle malattie autoimmuni, alla patogenesi del LES contribuiscono fattori genetici che aumentano il rischio di contrarre la malattia ma anche fattori ambientali come l’esposizione alla luce solare (raggi ultravioletti), infezioni e fumo di tabacco. I sintomi più comuni sono stanchezza, dolori e gonfiori articolari e eruzioni cutanee, in particolare su viso, polsi e mani.
Le malattie autoimmuni hanno un andamento cronico e quindi progrediscono nel tempo, diventando progressivamente più gravi o possono manifestarsi in modo altalenante, con periodi in cui si acuiscono e altri in cui scompaiono (remissione). Infatti gli obiettivi del trattamento sono volti a prevenire le riacutizzazioni, prolungando la sopravvivenza a lungo termine e migliorando la qualità della vita. La terapia si basa sull’utilizzo di:
- Immunosoppressori ovvero molecole che inibiscono la risposta immunitaria e possono limitare i danni provocati dalle disfunzioni del sistema immunitario
- Corticosteroidi che possono contribuire a ridurre rapidamente l’infiammazione
- farmaci antimalarici, per trattare i principali sintomi e prevenire i disturbi della pelle come gli eritemi
- utilizzo dei FANS (farmaci antinfiammatori non steroidei), antidolorifici che riducono infiammazione e dolori ad articolazioni.
Tra le altre patologie troviamo l’artrite reumatoide, diabete mellito di tipo 1, tiroidite di Hashimoto in cui il sistema immunitario attacca per errore la tiroide, causando una riduzione della produzione di ormoni tiroidei, sclerosi multipla che colpisce il sistema nervoso centrale danneggiando la mielina che riveste e protegge i nervi.
Conclusioni sulle malattie autoimmuni
È chiaro che l’obiettivo del trattamento dei pazienti affetti da malattie autoimmuni sia una terapia specifica che faccia regredire completamente la malattia, ma attualmente questo non esiste per nessuna malattia autoimmune. Al contrario, si spera che sia possibile modificare il sistema immunitario dell’ospite per ripristinare la tolleranza. Sebbene ciò sia possibile in alcuni modelli murini non si è ancora dimostrato efficace nell’uomo, nonostante i numerosi tentativi di immunoterapia, comprese le terapie con cellule staminali. Tuttavia, la comprensione delle malattie autoimmuni è migliorata grazie a un enorme numero di studi molecolari che indagano non solo i fattori genetici, ma anche il ruolo dell’epigenetica, dell’ambiente, delle infezioni e del microbiota. L’autoimmunità è una grande sfida tuttavia, la prognosi per i pazienti affetti da queste malattie è notevolmente migliorata negli ultimi dieci anni e si prevedono ulteriori miglioramenti per il futuro.
Fonti
- www.ama.ba
- onlinelibrary.wiley.com
- www.ncbi.nlm.nih.gov
- www.sciencedirect.com
- journals.sagepub.com/doi/10.1177/0192623320948805?url_ver=Z39.88-2003&rfr_id=ori:rid:crossref.org&rfr_dat=cr_pub%20%200pubmed