Cosa si intende per virulenza
L’esito dell’interazione ospite-parassita dipende dalla patogenicità di quest’ultimo, ovvero dalla capacità del microrganismo di infliggere un danno all’ospite e dare malattia, e dalla resistenza o suscettibilità dell’ospite al parassita stesso. La misura quantitativa della patogenicità è indicata con il termine virulenza, espressa come il numero di cellule che suscitano una risposta patologica nell’ospite in un dato periodo di tempo.

Da cosa è determinata la virulenza di un microrganismo?
Né la virulenza del patogeno, né la relativa resistenza dell’ospite sono fattori costanti: l’interazione ospite-parassita è una relazione dinamica tra i due organismi, poiché ognuno modifica l’attività e le funzioni dell’altro tanto che la virulenza del patogeno e la resistenza dell’ospite variano continuamente. La virulenza racchiude due tra le caratteristiche del microrganismo patogeno:
Infettività
Infettività: la capacità di colonizzare e invadere l’ospite, e l’entità della malattia; essa può variare sia tra le varie specie microbiche, che tra ceppi differenti di una stessa specie. Le componenti di un microrganismo che determinano la capacità di causare malattia, senza influenzare di per sé la vitalità, sono dette fattori o determinanti di virulenza. La virulenza è determinata essenzialmente dalla tossicità e dall’invasività del microrganismo.
Tossicità
Con il termine tossicità si intende la capacità di un microrganismo di svolgere il suo ruolo patogenetico attraverso la produzione di tossine che alterano o inibiscono la fisiologia e le funzioni della cellula o la uccidono: le tossine secrete dal batterio della difterite o da ceppi E. coli enteropatogeni (EPEC) sono, ad esempio, importanti fattori di virulenza, ma non sono necessarie per lo sviluppo di questi microrganismi o per la colonizzazione dei loro ospiti.
Invasività
L’invasività è la capacità di un microrganismo di proliferare nei tessuti fino a raggiungere numeri così elevati da inibire le funzioni dell’ospite: un microrganismo, anche se non produce tossine, può essere in grado di determinare una malattia proprio grazie alle sue proprietà invasive. L’invasività è fortemente influenzata dalle proprietà superficiali dei batteri che possono accentuare la capacità di colonizzare e quindi aumentare la virulenza in due modi diversi: promuovendo la loro adesione a cellule specifiche e/o diminuendo la capacità di attrazione sui fagociti.
Ad esempio, il più importante fattore di virulenza di Streptococcus pneumoniae è la capsula polisaccaridica che impedisce la fagocitosi batterica, annullando così il principale meccanismo di difesa utilizzato dall’ospite per prevenire l’invasione. I ceppi capsulati di S. pneumoniae sono capaci di causare danni estesi nell’ospite come risultato del loro elevato grado d’invasività; essi crescono nel tessuto polmonare in numero elevato, dove inducono le risposte dell’ospite che portano alla polmonite lobare. I ceppi non capsulati, invece, vengono rapidamente e facilmente catturati e distrutti dalle cellule fagocitiche.
Altri fattori che determinano la virulenza di un microrganismo
La maggior parte dei microrganismi esplica la propria patogenicità mediante una combinazione dei meccanismi di tossicità e invasività. La virulenza è una proprietà poligenica dei microrganismi; in teoria può essere influenzata da un qualunque aspetto della loro fisiologia: la produzione di tossine e le proprietà superficiali, il tasso di crescita, le esigenze nutrizionali, l’efficienza di assorbimento di micronutrienti (come il ferro), la sensibilità alla temperatura e la resistenza ai danni da sostanze ossidanti o all’attacco da parte di enzimi.
Dose letale50 e dose infettiva50
Inoltre, come avviene negli organismi superiori, l’adattamento di un microrganismo alla sua nicchia ecologica dipende dall’evoluzione di un genoma nel quale si verifichino interazioni equilibrate (co-adattamento) fra i suoi geni, molti, e i loro prodotti. La virulenza di un microrganismo, come la tossicità di una tossina, è generalmente espressa come la dose capace di infettare o di uccidere il 50% degli animali inoculati, e i rispettivi indicatori assumono la denominazione di dose infettiva50 (ID50, Infectious Dose), o dose letale50 (LD50, Lethal Dose).
La virulenza è un processo che può essere studiato mediante l’utilizzo di modelli sperimentali murini d’infezione con ceppi patogeni. In figura x è indicato come anche poche cellule di S. pneumoniae sono sufficienti a provocare un’infezione letale e a uccidere tutti i membri della popolazione saggiata. Al contrario, la LD50 di Salmonella typhimurium, responsabile di gastroenteriti nel topo, anche se meno virulento, è molto più elevata di quella di S. pneumoniae e il numero di batteri richiesti per uccidere il 100% della popolazione è 100 volte maggiore della LD50.
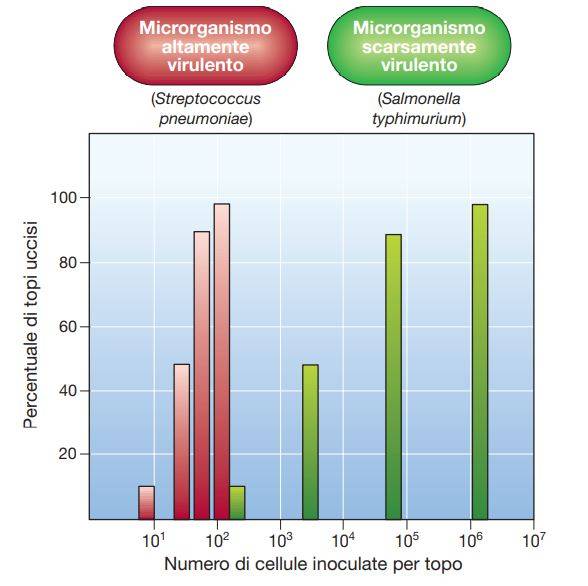
È importante tenere presente che l’efficienza d’infezione viene profondamente influenzata anche da numerosi fattori dell’ospite, tra cui l’età, il sesso, il patrimonio genetico, lo stato nutrizionale, la densità di popolazione e una precedente esposizione al microrganismo. Quando i patogeni vengono coltivati in laboratorio, la loro virulenza può diminuire significativamente fino a scomparire. Questi microrganismi sono detti attenuati. L’attenuazione è un fenomeno associato, probabilmente, al fatto che i mutanti non virulenti crescono più rapidamente e sono selettivamente favoriti dai successivi passaggi in terreno di coltura fresco. L’attenuazione si osserva più facilmente quando le condizioni di coltura non sono ottimali per quella determinata specie. Se una coltura attenuata viene re-inoculata in un animale, in alcuni casi si possono isolare nuovamente microrganismi virulenti, mentre in altri la perdita della virulenza è permanente. I ceppi attenuati possono essere utilizzati per la produzione di vaccini.
Infezioni latenti e stato di portatore
La maggior parte dei microrganismi patogeni è completamente eradicata con la scomparsa della sintomatologia clinica, ma alcuni possono persistere nell’ospite dopo la guarigione, in maniera simbiotica. Le infezioni che possono in seguito riattivarsi (come può verificarsi, ad esempio, nella tubercolosi o nella sifilide) sono dette latenti (silenti); mentre gli ospiti con infezioni asintomatiche non recidivanti (come ad esempio quelle causate dal bacillo tifoideo o da quello difterico) sono definiti portatori sani del microrganismo.
Nelle infezioni latenti il microrganismo permane nel corpo dell’individuo senza che insorga una patologia evidente, ma esso può determinare una malattia mesi o anni più tardi. In alcuni casi è possibile individuare la causa che scatena il riemergere del microrganismo: ad esempio, i farmaci immunosoppressori o citotossici possono riattivare la tubercolosi in un individuo i cui processi immunologici abbiano mantenuto il batterio allo stato latente. Tuttavia, in altri casi non esiste una chiara spiegazione della riattivazione.
Il portatore di un microrganismo patogeno è invece un ospite che, pur albergando il microrganismo è in grado di diffonderlo, e risulta immune alla malattia; questo stato talvolta s’instaura senza che si sia verificata la malattia in precedenza. Lo stato di portatore è spesso instabile e termina dopo alcune settimane; tuttavia, a seguito di alcune malattie, come la febbre tifoide e la gonorrea, gli individui possono rimanere portatori indefinitamente, fornendo così un continuo serbatoio per il microrganismo infettante. Può risultare impossibile eradicare solo con la terapia antibiotica i batteri che formano un’associazione a lungo termine con un portatore: i portatori di Salmonella typhi, infatti, spesso ospitano questo microrganismo nella colecisti, e per gli individui con calcoli biliari che diventano portatori di S. typhi spesso la colecistectomia rappresenta l’unico modo per eliminare lo stato di portatore.
Escherichia coli è presente normalmente in gran numero nel colon: a questo livello i microrganismi non sono patogeni e possono anche essere di beneficio all’ospite che presenta normali condizioni di salute, contribuendo alla sintesi di vitamina K e inducendo un’immunità naturale nei confronti di altri batteri gram-negativi. Soltanto quando E. coli oltrepassa la barriera mucosale e invade altre sedi, esso determina malattia: la penetrazione di E. coli nel peritoneo attraverso una breccia meccanica della parete intestinale, il suo ingresso nella vescica urinaria, o l’invasione del torrente ematico, sono tutti eventi associati a malattia.
Alcuni patogeni virulenti come lo streptococco di gruppo A e Neisseria meningitidis sono in grado di colonizzare un numero molto elevato di soggetti per lunghi periodi di tempo senza alcun effetto patogeno. In questi casi gli individui colonizzati possono avere già un’immunità specifica nei confronti di questi microrganismi, oppure l’invasione viene impedita dalle difese non specifiche dell’ospite e, nel frattempo, si sviluppa l’immunità specifica. Alcuni microrganismi, infine, possono rimanere nei tessuti dell’ospite per tutta la vita, determinando danni minimi fino a quando il sistema immunitario dell’ospite è integro, ma provocando gravi malattie sintomatiche se quest’ultimo è compromesso.
Fonti
- Baker, M.D., Acharya, K.R. (2004), «Superantigens: structure-function relationships», International journal of Medical Microbiology, 293, pp. 529-537.
- Davis, B.D., Dulbecco, R., Eisen, H.N., Ginsberg H.S., Microbiologia, parte III, cap. 26, Zanichelli, Bologna, 1993.
- Dehò, G., Galli, E., Biologia dei microrganismi, 2a ed., Casa Editrice Ambrosiana, Milano, 2014.
- Isselbacher, KJ., Braunwald, E., Wilson, J.D., Martin, J.B., Fauci, A.S., Kasper, D.L., Harrisοn -Principi di Medicina Interna, parte VI, sezione VI, McGraw-Hill, Milano, 2004.
- Medini, D., Serruto, D., Parkhill, J., Relman, D.A., Donati, C., Moxon, R., Falkow S., Rappuoli,R. (2008), «Microbiology in the post-genomic era», Nature Reviews Micro-biology, 6, pp.419-429.
- Madigan, Μ.T., Martinko, J.M., Parker J., Brock. Biologia dei microrganismi, vol. 2, capp. 25 e 26, Casa Editrice Ambrosiana, Milano, 2003.
- Mecsas, J., Strauss E.J. (1996), «Molecular mechanisms of bacterial virulence: type III secretion and pathogenicity islands», Emerging Infectious Diseases, 2, pp. 261-288.
- Reading, N.C., Sperandio, V. (2006), «Quorum sensing: the many languages of bacteria»,FEMS Microbiol Lett. 254(1), pp.1-11