Generalità sulle penicilline
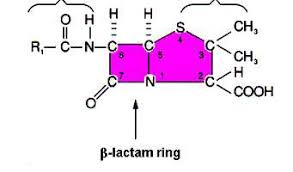
Le penicilline sono una classe di molecole molto ampia appartenente agli antibiotici beta-lattamici o lattamine, tutti N-acilderivati dell’acido 6-aminopenicillanico (6-APA), un composto biciclico ottenuto dalla fusione di un anello beta-lattamico e un anello tiazolidinico a cinque atomi. Isolata per la prima volta da Sir Alexander Fleming, la penicillina ha dato inizio all’impiego della terapia antibiotica nel trattamento delle infezioni batteriche.

Capostipite di questa classe di antibiotici è la penicillina G o acido 6-benzil-carbonilaminopenicillanico, definita semplicemente benzilpenicillina. Da sempre impiegata nella pratica clinica, la penicillina G è prodotta naturalmente per fermentazione del Penicillium notatum Westling.
Principio attivo delle penicilline
Eventuali sostituzioni di gruppi funzionali sul nucleo “penam” o sulla catena laterale acilica, ne modificano le proprietà farmacocinetiche e farmacodinamiche.
Per quanto riguarda le proprietà farmacocinetiche, queste mirano ad aumentare la compliance del paziente, a migliorare il metabolismo della molecola, la sua escrezione o la durata (emivita) nel flusso sanguigno. Allo stesso modo, le proprietà farmacodinamiche definiscono la funzione della molecola, lo specifico meccanismo molecolare che ne permette l’attività. Proprio il miglioramento di queste proprietà modificano l’effetto terapeutico della molecola del farmaco.
Le penicilline di rilievo terapeutico attualmente in uso, tuttavia, sono quelle semi-sintetiche. Queste ultime si ottengono dall’acido 6-amino-penicillanico prodotto attraverso fermentazione, il quale, una volta estratto e purificato dal mezzo di fermentazione, è sottoposto a eventuali reazioni chimiche volte a migliorare resa ed effetto farmacologico. L’anello beta-lattamico è, infatti, il principale responsabile dell’effetto farmacologico delle penicilline.
Meccanismo d’azione della penicillina
Come anticipato, le penicilline sono antibiotici beta-lattamici e come tali agiscono inibendo la sintesi della parete batterica attraverso il legame con le proteine bersaglio della parete cellulare, “penicillin binding proteins o PBPs”.
Nello specifico, l’inibizione della sintesi della parete cellulare di peptidoglicano, caratteristica solo di cellule procariote, avviene mediante l’inibizione della transpeptidazione. Quest’ultimo è un processo enzimatico, mediato dalle serinoproteasi, fondamentale nella formazione del reticolo di peptoglicani che assicura rigidità della parete e la forma caratteristica del batterio.
Proprio l’anello beta-lattamico funge da analogo strutturale del dimero destro-alaninico, substrato naturale delle transpeptidasi batteriche. La loro attività terapeutica si manifesta promuovendo, con i recettori delle serinoproteine PBPs, un legame covalente irreversibile per acilazione dell’ossidrile serinico.
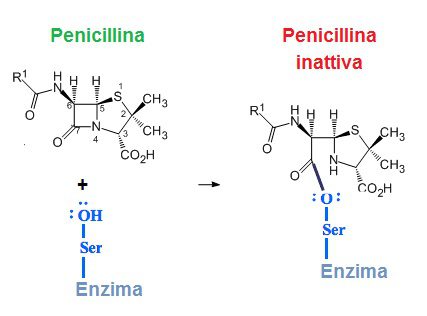
L’effetto ultimo è quello battericida per aumento della pressione osmotica interna che porta a lisi per repressione indiretta sul genoma delle idrolasi mureiniche e morte cellulare per alterazione fisiologica e morfologica della cellula.
I batteri gram-positivi e gram-negativi differiscono sia per l’accessibilità ai siti bersaglio sia per la pressione osmotica intracellulare, che nei gram-positivi è di 20 atmosfere contro le 6 atmosfere dei gram-negativi. Proprio queste differenze rendono i gram-negativi resistenti alla maggior parte delle penicilline.
Relazione struttura-attività (SAR)
Le penicilline possono essere raggruppate secondo lo spettro d’azione che varia per eventuali sostituzioni sul nucleo di base “penam”.
Penicilline, spettro ristretto inibite da penicillinasi
Le penicilline a spettro ristretto gram + comprendono la penicillina G, V, propicillina, fenbenicillina. Di queste, solo la penicillina G naturale, è suscettibile all’acidità gastrica, ma anche all’alcalinità intestinale per idrolisi del gruppo amidico. Di conseguenza, la molecola è assunta unicamente per somministrazione endovenosa o intramuscolare per evitare che i succhi gastrici, aprendo l’anello, inattivino la molecola. Allo stesso tempo, la penicillina G ha una scarsa diffusione nel fluido cerebro-spinale, una buona facilità di assorbimento e di escrezione renale. Infatti, l’emivita varia dalle 4 alle 6 ore.

La presenza di una catena laterale voluminosa e un ossigeno elettronattrattore in alfa al gruppo fenossicarbossilico, migliorano la stabilità dell’anello beta-lattamico delle penicilline V, propicillina e fenbenicillina. La resistenza all’idrolisi gastrica non consente l’apertura dell’anello e il riarrangiamento ad acido penillico. Inoltre, le sostituzioni sul gruppo NH2 ampliano lo spettro d’azione e migliorano l’effetto farmacologico, anche se mantengono una ridotta emivita e rapida escrezione.

Penicilline, spettro ristretto resistenti alle penicillinasi
Le penicilline semi-sintetiche sono resistenti alle penicillinasi, enzima deputato all’apertura dell’anello beta-lattamico. Infatti, la presenza di radicali acidi produce un elevato ingombro sterico. Tra queste, la meticillina, somministrata per via parenterale, ha una scarsa affinità nel legame farmacoproteico (40%), mentre l’escrezione renale e l’emivita si mantengono rapide al pari della penicillina G.
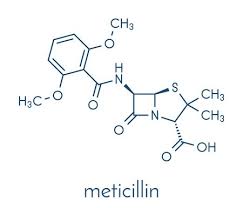
Nello stesso gruppo rientrano le isoxazolin penicilline: oxacillina, dicloxacillina, cloxacillina, flucloxacillina. La presenza dell’atomo d’idrogeno e degli alogeni aumenta l’affinità di legame per le proteine plasmatiche fino al 97% per la presenza di gruppi lipofili non polari, mantenendo una breve emivita. Al contrario della meticillina, questi derivati possono essere assunti per via orale.
Penicilline ad ampio spettro: aminopenicilline
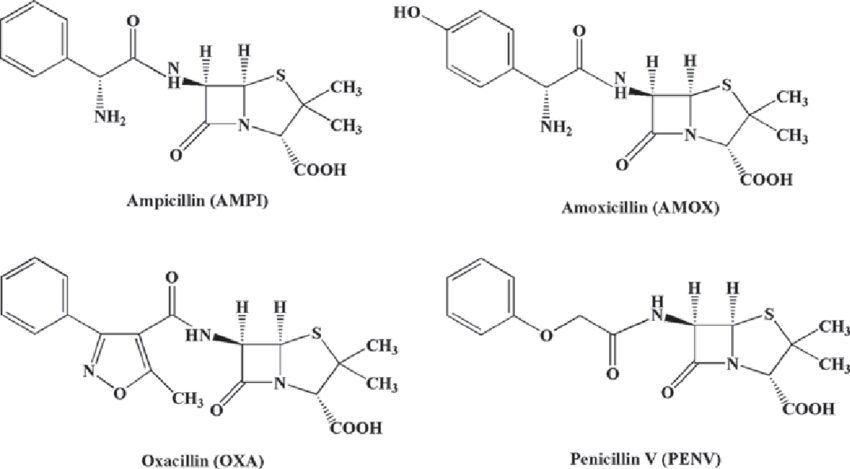
Tra le penicilline attive contro i gram+ e i gram-, la capostipite è l’ampicillina che, con il suo idrossiderivato amoxicillina, è suscettibile all’azione della penicillinasi ma non all’acidità gastrica per la presenza del gruppo aminico. Dal legame farmaco-proteina del 10% ne deriva la rapida eliminazione renale e l’emivita di 1-2h.
Di questa categoria fanno parte i profarmaci dell’ampicillina. Infatti, l’esterificazione di quest’ultima ne aumenta la lipofilia. Il miglioramento dell’assorbimento intestinale è opera di un’esterasi che libera l’ampicillina per rimozione della doppia funzione esterea laterale della molecola, che allo stesso tempo, ne aumenta l’affinità. Le molecole del gruppo sono la pivampicillina, la bacampicillina e la talampicillina.
Gli N- derivati dell’ampicillina presentano un gruppo aminico nella catena laterale che ne aumenta il legame sierico, l’emivita e lo spettro d’azione. In questo momento, i farmaci in commercio sono la metampicillina, etacillina e piperacillina.
Penicilline ad ampio spettro: carbossipenicilline
L’aggiunta alle carbossipenicilline di acido clavulanico e penicillinasi migliorano l’effetto farmacologico. Alla somministrazione per via parenterale della carbossipenicillina seguono elevati picchi ematici e breve emivita per l’elevata idrofilia. Per contro, la resistenza alle beta-lattamasi è molto bassa per la presenza del gruppo carbossilico che ne aumenta lo spettro d’azione.
Strutturalmente simile alla carbossipenicillina è la sulbenicillina, che impiegata per via parenterale ha una buona affinità per le proteine sieriche e distribuzione a livello dei tessuti per la presenza del gruppo solfonico.
Il profarmaco carindacillina, insieme alla pivampicillina, ha un ottimo assorbimento e distribuzione rispetto al farmaco madre, per il miglioramento e bilanciamento della porzione idrofila. Come estere della carbossipenicillina può essere assunto per via orale.
Infine, le forme ritardo come la benzilpenicillina legata alla procaina, ne aumentano l’emivita e l’attività terapeutica.
Applicazioni terapeutiche
Lo spettro ristretto della penicillina G le consente di agire contro gonococchi, meningococchi, spirochete e stafilococchi, i quali con il tempo hanno sviluppato resistenza. Lo sviluppo delle penicilline semi-sintetiche ha ovviato il problema della sensibilità alle penicillinasi e migliorato capacità di penetrare la membrana dei gram-negativi.
Nella pratica clinica, l’ampicillina è il primo antibiotico ad ampio spettro ad aver trovato impiego nelle affezioni respiratorie ed urinarie, come anche le malattie veneree e infezioni del tratto gastro-intestinale. Tra i profarmaci dell’ampicillina, la pivampicillina è tuttora impiegata per le infezioni del tratto genito-urinario e respiratorio. Per contro, la bacampicillina trova impiego sia nelle classiche infezioni da streptococchi emolitici, enterococchi e pneumococchi sia per Escherichia Coli, Salmonella e Neisseria Gonhorrae.
Carbenicillina e sulbenicillina sono attive nei confronti sia di E. coli sia di Pseudomonas aeruginosa.
Resistenza antibiotica
Questi antibiotici non sono immuni da resistenza. Infatti, possono insorgere problemi per idrolisi della catena carbossilammidica ad opera di penicillina amidasi. Da non sottovalutare è la produzione di enzimi che idrolizzano l’anello, le beta-lattamasi. Mutazioni di porine e PBP, dei siti bersaglio, possono compromettere il passaggio attraverso la parete cellulare e la lisi batterica. Infine, l’eliminazione attiva dell’antibiotico dallo spazio periplasmatico dei gram-negativi rende questi chemioterapici altamente resistenti alle terapie.
Tossicità ad effetti indesiderati
Non si riscontrano ad oggi casi di tossicità delle penicilline se i dosaggi terapeutici vengono rispettati. L’aspetto importante è ricoperto dalle reazioni di sensibilizzazione che possono portare a shock anafilattico. Infatti, la molecola dei beta-lattamici mima la struttura chimica di un oligopeptide, scatenando reazioni immunopatologiche igE mediate.

Pertanto l’assunzione del chemioterapico deve essere limitata alle sole infezioni comprovate, onde evitare gravi manifestazioni allergiche per “anamnesi” del nostro sistema immunitario.
Agnese Ciardi
Fonti
- Rossi F., Cuomo V., Riccardi C., 2005, Farmacologia, principi base e applicazioni terapeutiche, Edizioni Minerva Medica
- Artico Marino, 2000, Chimica farmaceutica Volume II, Ciso editore
- Antibiotici, http://www.med.unipg.it
- Penicillina, http://www.treccani.it
1 commento su “Penicilline”