Respirazione batterica aerobica
La respirazione è un processo in cui si ha una completa ossidazione del substrato organico. Rispetto alla fermentazione, che termina il suo ciclo con la formazione di acido purivico e suoi derivati, nella respirazione vi è la completa mineralizzazione (trasformazione in H2O e CO2) del glucosio attraverso il ciclo dell’acido citrico, conosciuto anche come ciclo degli acidi tricarbossilici o ciclo di Krebs.

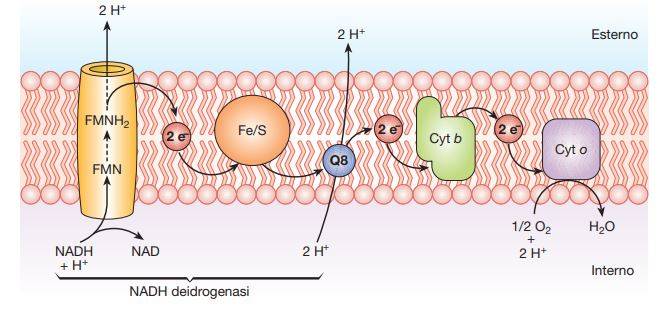
Questo processo permette di impiegare l’energia prodotta dall’ossidazione del NADH a NAD in processi di fosforilazione ossidativa di un numero considerevole di molecole di ADP. Inizialmente il piruvato, prodotto durante la fermentazione e dopo essere stato decarbossilato e ossidato, entra nella via degli acidi tricarbossilici sotto forma di acetil-CoA con produzione di una molecola di NADH. Questa molecola entra nel ciclo di Krebs attraverso la condensazione con una molecola di acido ossalacetico, formando in questo modo acido citrico.
L’acido citrico viene quindi sottoposto a una serie di reazioni di ossidazione e decarbossilazione in modo da produrre in successione prima acido α-chetoglutarico e poi succinil-CoA. Durante questa prima fase del ciclo di Krebs sono prodotte 2 molecole di NADH e persi due atomi di carbonio sotto forma di CO2. Successivamente, dal succinil-CoA viene prodotto nuovamente acido ossalacetico con produzione di una molecola di FADH2 e una di NADH. Inoltre, il succinil-CoA subisce una fosforilazione a livello del substrato che porta al trasferimento di un gruppo fosfato al GDP trasformandolo in GTP (il GTP è un nucleoside trifosfato simile all’ATP).
La resa complessiva dell’intero processo è la generazione di 2 molecole di CO2, 3 di NADH, 1 di FADH2 e 1 di GTP per ogni molecola di acetil-CoA che entra nel ciclo di Krebs. Il ciclo di Krebs consente quindi al batterio di generare un quantitativo di energia superiore a quello prodotto con la sola fermentazione. Infatti, oltre al GTP prodotto dalla fosforilazione a livello del substrato del succinil-CoA, il NADH e il FADH2 vengono ossidati dalla catena di trasporto degli elettroni.

La catena di trasporto degli elettroni
In questa catena, gli elettroni vengono trasferiti dal NADH e dal FADH2 (donatori primari) a un accettore finale quale l’O2 (respirazione aerobia), che viene ridotto a H2O. Nel meccanismo di trasporto degli elettroni sono coinvolti numerosi enzimi che si attivano in modo sequenziale, per cui inizialmente si attiverà la NADH deidrogenasi, poi le flavoproteine, le proteine ferro-zolfo e, infine, i citocromi. La NADH deidrogenasi ossida il NADH a NAD e trasferisce gli ioni H+ a dei trasportatori specifici, le flavoproteine, che si riducono. Queste proteine hanno la capacità di ridursi e ossidarsi in modo reversibile, per cui la forma ridotta delle flavoproteine può riossidarsi attraverso la cessione dei soli elettroni al complesso dei citocromi.
In questi complessi proteici sono presenti delle proteine legate a gruppi prostetici contenenti ferro. Il ferro può subire reversibilmente una serie di ossidazioni da Fe3+ a Fe2+ e di riduzioni da Fe2+ a Fe3+, e quindi può ricevere gli elettroni da un citocromo e trasferirli al successivo. L’ultimo citocromo della catena, tramite una citocromossidasi, trasferisce gli elettroni all’accettore finale che, come si è già ricordato, può essere O2.
Resa energetica
In tutti i passaggi descritti, avviene la liberazione graduale di energia che viene utilizzata per fosforilare l’ADP in ATP. Attraverso questo processo per ogni molecola di NADH ossidata si producono 3 molecole di ATP, mentre il processo di ossidazione del FADH2 è meno efficiente in quanto produce solo 2 molecole di ATP. Quindi per il completo catabolismo aerobio di una molecola di glucosio vengono prodotte 2 molecole di ATP dal processo fermentativo e 36 molecole di ATP dal ciclo di Krebs, con una resa netta globale di 38 molecole di ATP. Il dettaglio del numero di molecole di ATP prodotte in ogni fase del metabolismo aerobio è riportato nella figura 4.
Il ciclo di Krebs, oltre a essere di fondamentale importanza nel metabolismo batterico, è anche una fonte di precursori per alcune vie biosintetiche importanti per il corretto funzionamento della cellula batterica. Questo significa che alcuni intermedi prodotti durante il ciclo di Krebs (ad es. il citrato, l’α-chetoglutarato e l’ossalacetato) possono essere utilizzati come precursori per alimentare delle vie anaboliche come la biosintesi di lipidi e degli aminoacidi (in particolare aspartato e glutammato).
Inoltre, l’ossalacetato può anche essere convertito in fosfoenolpiruvato (PEP) dalla PEP-carbossichinasi ed entrare nel processo di sintesi del glucosio (gluconeogenesi). Pertanto il ciclo di Krebs è considerato una via anfibolica, ovvero un processo biochimico in cui gli intermedi di reazione prodotti possono entrare a far parte di processi metabolici collocati sia nelle vie cataboliche che in quelle anaboliche. Risulta quindi evidente come il ciclo di Krebs sia di fondamentale importanza per la cellula batterica anche senza voler considerare il suo ruolo nel metabolismo energetico.

Respirazione batterica anaerobica
Nel panorama microbico esiste un numero elevato di batteri che sono in grado di eseguire un tipo di respirazione aerobia e batteri che possiedono un sistema di trasporto degli elettroni in grado di utilizzare materiali inorganici diversi dall’ossigeno libero per la produzione di ATP (respirazione anaerobia). In base quindi alla respirazione possiamo distinguere microrganismi aerobi obbligati (aerobi stretti), aerobi-anaerobi facoltativi e anaerobi obbligati (anaerobi stretti).
Nel caso della respirazione anaerobia gli accettori terminali di elettroni possono essere nitrati, solfati, CO2 e anche alcuni metalli. In particolare, alcuni batteri possono produrre ATP riducendo il nitrato (NO3 – ) a nitrito (NO2 – ), attraverso una serie di reazioni note come riduzione dissimilativa del nitrato. Questo tipo di reazione è però poco efficiente in quanto genera poche molecole di ATP e il nitrito che si forma è notevolmente tossico per il batterio. Un altro processo che coinvolge il nitrato è la sua riduzione ad azoto atmosferico (N2), in un processo noto come denitrificazione.
La denitrificazione avviene in alcune specie dei generi Pseudomonas, Bacillus e Paracoccus. Microrganismi più specializzati, come i Desulfovibrio, possono ridurre il solfato (SO4 2– ) a idrogeno solforato (H2S, batteri solfato-riduttori), altri possono utilizzare la CO2 riducendola a metano (CH4, batteri metano-riduttori). In generale, la respirazione anaerobia non è efficiente per quanto riguarda la sintesi di ATP come la respirazione aerobia, in quanto durante la fosforilazione ossidativa, con accettori terminali come il nitrato, il solfato e la CO2, si produce un quantitativo di energia inferiore a quello prodotto con la respirazione aerobia e di conseguenza un numero inferiore di molecole di ATP.
Tuttavia, in condizioni di anaerobiosi la respirazione anaerobia è più efficiente della fermentazione e permette di produrre ATP mediante la catena di trasporto degli elettroni. I batteri non presentano un metabolismo esclusivamente di tipo aerobio o solo anaerobio ma alcuni microrganismi, a seconda delle condizioni ambientali, possono ricavare energia per la sintesi di molecole di ATP attivando sia la respirazione sia la fermentazione (batteri aerobi-anaerobi facoltativi, batteri microaerofili e batteri aero-tolleranti). I batteri anaerobi obbligati sono batteri che possono vivere solo in assenza di aria e per i quali la presenza dell’ossigeno atmosferico risulta letale. Questi batteri possono trarre energia solo attraverso la fermentazione o attraverso la respirazione anaerobia (in cui gli accettori finali sono la CO2, il NO3 – e il SO4 2– ). Ricordiamo tra gli anaerobi obbligati i generi Bacteroides (costituenti principali della normale flora microbica intestinale dell’uomo) e Clostridium.
In questi ultimi anni si è osservato che nella flora microbica intestinale esistono batteri definiti ossigeno intolleranti, ossia batteri che non soltanto non si sviluppano, ma muoiono entro breve tempo se vengono posti a contatto con tracce anche minime di ossigeno (Fusobacterium e Peptostreptococcus). I batteri aerobi-anaerobi facoltativi sono batteri che a seconda delle esigenze ambientali possono vivere anche in assenza di ossigeno atmosferico ma la cui moltiplicazione è notevolmente più veloce in sua presenza. Sono batteri che possono utilizzare sia la fermentazione che la respirazione per la produzione di energia. In particolare, i batteri aerobi-anaerobi facoltativi comprendono molti generi di interesse medico (Vibrio, Spirillum, Aerobacter, Salmonella, Shigella fra i gram-negativi; Staphylococcus e molti bacilli fra i gram-positivi).
I batteri microaerofili sono batteri che non possono moltiplicarsi in presenza di ossigeno (20%), ma al contrario del gruppo precedente crescono più facilmente a concentrazioni di ossigeno inferiori (2-18%). A tale classe appartengono batteri quali Streptococcus, Lactobacillus e Campylobacter. I batteri aerotolleranti sono batteri che non richiedono ossigeno e non presentano alcun tipo di metabolismo in grado di utilizzarlo, ciò nonostante sono in grado di sopravvivere se esposti all’aria, poiché possono attivare dei processi di tipo esclusivamente fermentativo (Klebsiella, Mycobacterium tuberculosis, ecc.).
Fonti
- Berg, J.M., Tymoczko, J.L., Stryer, L., Biochimica, 7a ed., Zanichelli, Bologna, 2012.
- Downs, D.M. (2006), «Understanding microbial metabolism», Annual Review of Microbiology, 60, p. 533.
- Hurst, C.J. et al. (a cura di), Manual of Environmental Microbiology, 2a ed., ASM Press, 2002.
- Nelson, D.L., Cox, M., I principi di biochimica di Lehninger, 5a ed., Zanichelli, Bologna, 2012.
- Russel, J.B., Cook, G.M. (1995), «Energetics of bacterial growth: balance of anabolic and catabolic reactions», Microbiological Review, 59, p. 285