L’utilizzo dei mutanti batterici applicato ai diversi metodi di biologia cellulare e molecolare ha rivoluzionato lo studio della patogenesi batterica. La patogenesi, ovvero la capacità di un microrganismo di indurre malattia, ha inizio con l’adesione del microrganismo stesso alle cellule dell’ospite, seguita dalla colonizzazione delle superfici, che può portare a un danno cellulare localizzato, dall’invasione dei tessuti e dalla proliferazione, con conseguente distruzione della struttura tissutale dell’organismo ospite, dalla produzione di esotossine, che possono agire localmente o in punti distanti, e infine dall’induzione di reazioni infiammatorie, allergiche e fibrotiche dell’ospite, che possono causare alterazioni temporanee o permanenti dei tessuti.
Adesione e colonizzazione delle superfici
Prima di determinare un danno, un microrganismo patogeno deve poter raggiungere i tessuti dell’ospite e moltiplicarsi: il più delle volte il primo contatto tra l’ospite e il parassita avviene a livello della superficie cutanea o mucosa. Allo scopo di impedire lo sviluppo del processo infettivo durante tale contatto, l’ospite ha sviluppato meccanismi di difesa altamente efficaci che operano a livello dell’interfaccia tra il corpo e il mondo esterno. Molti di questi meccanismi iniziali di difesa non sono diretti nei confronti di una particolare specie di microrganismo.
Le barriere meccaniche, inclusi lo spesso strato corneo della cute e le secrezioni ghiandolari, tendono a prevenire l’infezione ad opera di qualsiasi patogeno potenziale. Le barriere chimiche, come l’acidità gastrica e le vescicole, rappresentano un ambiente ostile per la maggior parte dei microrganismi. La normale microflora, composta di organismi non patogeni che colonizzano le superfici mucose, rende più difficile la colonizzazione ad opera di patogeni, a causa della competizione per le risorse ambientali e la produzione di sostanze ad attività antibatterica (batteriocine). Meccanismi comportamentali e neurologici, come ad esempio il vomito e la tosse, aiutano a prevenire le infezioni delle vie respiratorie inferiori.
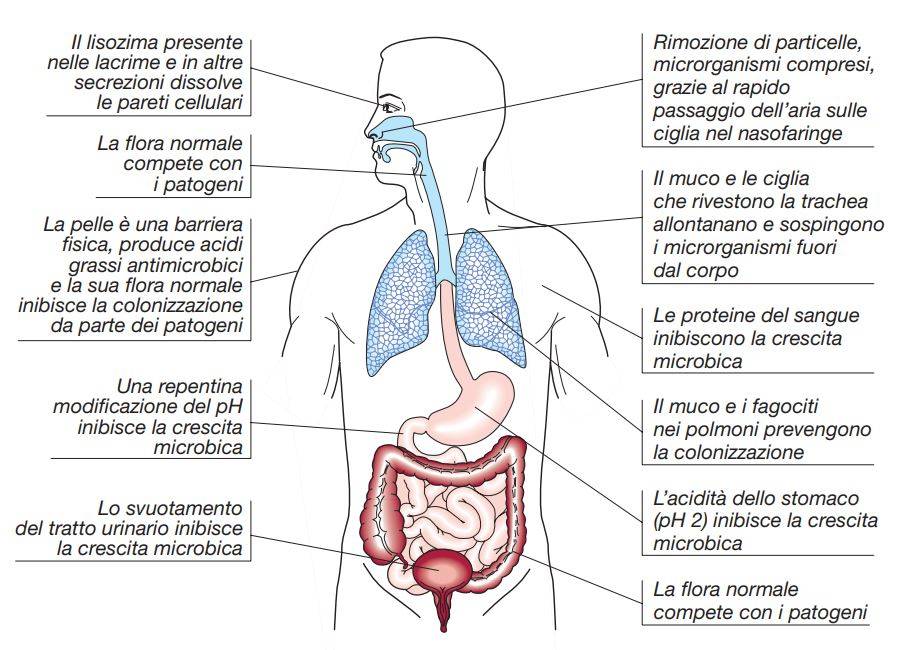
Si è imparato a riconoscere l’importanza di questi meccanismi osservando le malattie che derivano dalla loro compromissione. Alterazioni delle secrezioni bronchiali che si osservano nella fibrosi cistica (FC) conducono spesso a infezioni polmonari croniche da P. aeruginosa. Una lesione cutanea, conseguente alla puntura di un insetto o al morso di un animale, a ustione o a lesioni da trattamento, a traumi o a incisioni chirurgiche, consente l’ingresso di patogeni o di agenti opportunistici. L’eradicazione della normale flora intestinale conseguente a terapia antibiotica può rendere patogeni microrganismi come Clostridium difficile.
L’ospite ha sviluppato anche un sistema di difesa organismo-specifico a livello delle superfici mucose. Nell’epitelio dell’intestino, della mucosa nasale e a livello di altre sedi che confinano con l’ambiente esterno, risiedono macrofagi specializzati e linfociti che rivestono un ruolo importante nel sistema di difesa. Questo tessuto linfoide associato alla mucosa sembra svolgere un ruolo decisivo nell’intrappolare gli antigeni consentendo che questi vengano in contatto con i linfociti a livello della mucosa. In alcune aree questi tessuti sono riconoscibili anatomicamente: tra queste vi sono le tonsille orofaringee e, nel tratto gastrointestinale, le placche di Peyer e l’appendice.
L’elaborazione di immunoglobuline di superficie rappresenta il fulcro di questo sistema di difesa, in particolare si tratta di IgA secretorie che prevengono l’adesione e la penetrazione dei microrganismi. I patogeni hanno sviluppato un insieme di strategie per superare questa frontiera ben organizzata tra l’ospite e il mondo esterno: i microrganismi in grado di avviare un processo infettivo spesso aderiscono in maniera specifica alle cellule epiteliali, attraverso interazioni proteina-proteina tra molecole presenti sulla superficie del patogeno e della cellula ospite. Un microrganismo infettante non aderisce a tutte le cellule epiteliali con la stessa efficienza, ma interagisce in maniera selettiva con le cellule della particolare regione del corpo alla quale ha normalmente accesso.
Ad esempio, le fimbrie dei ceppi E. coli UPEC che invadono le vie urinarie contengono recettori specifici per i carboidrati (lectine) che si legano agli oligosaccaridi contenenti mannosio presenti nelle glicoproteine dell’epitelio della vescica, impedendo così che il flusso dell’urina ne faccia fuoriuscire i microrganismi. Altre strutture proteiche presenti sulla superficie di questi e di altri batteri patogeni capaci di interagire con le cellule ospiti e di dare inizio al processo di adesione sono i pili, strutture filamentose che si estendono dalla superficie della cellula batterica e presenti in numero variabile.
Neisseria gonorrhoeae, l’agente eziologico della gonorrea, una malattia trasmessa sessualmente, aderisce molto più saldamente alle cellule dell’epitelio urogenitale che a quelle di altri tessuti, attraverso una proteina di superficie chiamata Opa. Opa interagisce in maniera altamente specifica con la proteina CD66 presente sulla superficie delle cellule ospiti ed espressa soltanto nelle cellule epiteliali umane. Quindi, l’inizio del processo infettivo da parte di N. gonorrhoeae è strettamente dipendente da un’interazione ligando-recettore.
Questo principio si estende alla specificità dell’ospite. In molti casi, un ceppo batterico che infetta normalmente l’uomo aderisce molto più efficacemente alle cellule umane di un dato tessuto che non alle cellule del corrispondente tessuto in un altro animale, ad esempio il ratto, e viceversa. Gli studi sulle diarree causate da E. coli hanno fornito molte informazioni sulle interazioni tra batteri patogeni e cellule epiteliali delle mucose. La maggior parte dei ceppi di E. coli non è patogena e fa parte del microbiota dell’intestino cieco e del colon. In genere nell’organismo sono presenti, nello stesso momento, diversi ceppi, e molti batteri non patogeni attraversano l’organismo per venire poi eliminati nel materiale fecale. Soltanto alcuni ceppi di E. coli sono enteropatogeni, ovvero possiedono la capacità di colonizzare l’intestino tenue, produrre enterotossine e dare inizio a diarrea e altre malattie.
Questi ceppi possiedono specifiche strutture di superficie dette CFA (fattori antigenici di colonizzazione), costituite da proteine organizzate in fimbrie e coinvolte nell’adesione specifica alle cellule dell’intestino tenue. I ceppi non patogeni di E. coli raramente possiedono le proteine CFA. Anche la composizione genetica dell’ospite può influenzare la sensibilità o la resistenza alla colonizzazione batterica. Ad esempio, i sierotipi K88 e K99 di E. coli colonizzano il tratto intestinale di alcuni maialini, ma non di altri o di altre specie, che risultano, infatti, prive di recettori di membrana.
Biofilm batterici
Alcune macromolecole responsabili dell’adesione dei batteri alla cellula ospite non sono legate covalentemente alla superficie batterica: esse sono rappresentate generalmente da polisaccaridi sintetizzati e secreti dal batterio. Il rivestimento costituito da polimeri, che forma uno strato denso, ben definito intorno alla cellula, è noto come capsula, la rete a trama larga di fibre polimeriche che si estende dalla superficie della cellula è nota come glicocalice, mentre una diffusa massa di fibre polimeriche, apparentemente staccata dalla cellula, è chiamata strato mucillaginoso.
Queste strutture possono essere importanti per l’adesione non soltanto ai tessuti dell’ospite, ma anche tra le cellule batteriche stesse. Inoltre, questi strati di natura polisaccaridica possono proteggere i batteri dai meccanismi di difesa dell’ospite come la fagocitosi. Molti batteri patogeni, quali ad esempio E. coli, P. aeruginosa e S. aureus producono un’abbondante matrice mucopolisaccaridica extra-cellulare che prende il nome di slime o glicocalice. Lo slime (letteralmente melma) favorisce l’adesività batterica e la produzione del biofilm.
Il biofilm è definito come una comunità (vegetazione) di germi inclusi in un substrato di polimeri organici (EPS: sostanza esopolimerica) che aderisce a una superficie naturale o artificiale. Negli ultimi anni si è avuta sempre più ampia dimostrazione che i biofilm batterici rappresentano un importante fattore di morbidità e mortalità nella maggior parte delle malattie infettive. Circa l’80% della biomassa microbica del mondo risiede nello stato di biofilm, e il National Institutes of Health (NHI) stima che oltre il 75% delle infezioni microbiche che avvengono nel corpo umano sia sostenuto dalla formazione di biofilm.
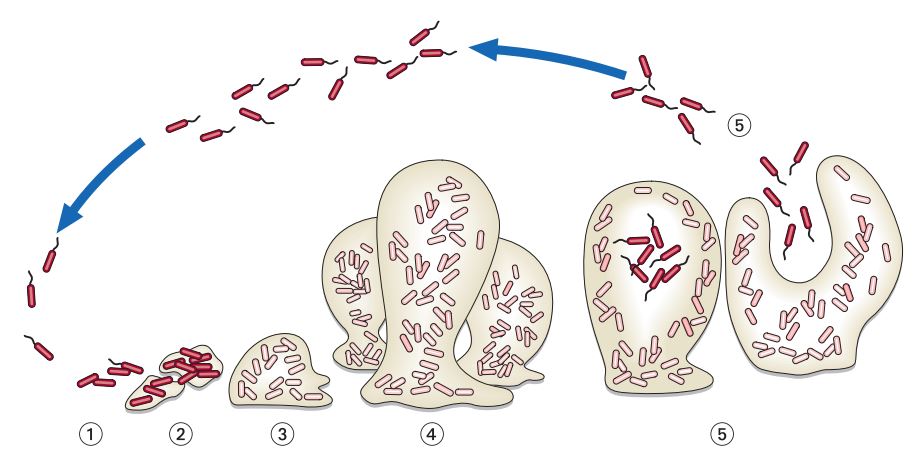
Questa struttura è un fattore di virulenza in infezioni quali la carie dentale, le periodontiti, le colecistiti, le osteomieliti, le prostatiti, le cistiti, le endocarditi, l’otite media acuta, la sinusite, la fibrosi cistica e riacutizzazioni infettive delle bronco-pneumopatie croniche ostruttive. Il biofilm svolge, inoltre, un ruolo primario nel promuovere la colonizzazione di corpi estranei come dispositivi medici impiantabili quali: protesi o cateteri vascolari e urinari, valvole cardiache e protesi ortopediche. Uno dei principali ruoli del biofilm è proteggere i microrganismi dall’azione degli antibiotici mantenendo vitali i germi al suo interno e interferire con i meccanismi di difesa dell’ospite quali la fagocitosi, l’attività degli anticorpi e del complemento.
Il lento metabolismo, la ridotta velocità di replicazione delle cellule, la bassa tensione di ossigeno, l’effetto di adsorbimento aspecifico da parte della matrice polisaccaridica, la riduzione del pH e dell’osmolarità sono tutte condizioni che producono una resistenza fenotipica a molte classi di farmaci, tra cui principalmente aminoglicosidi, β-lattamici, fluorochinoloni e glicopeptidi. Una delle principali spiegazioni per l’ampio interesse dimostrato nello studio dei biofilm microbici in ambito biomedico è proprio la continua emergenza e la severa minaccia di batteri antibiotico-resistenti.
La formazione di biofilm, come pure la produzione di numerosi altri fattori di virulenza, sono fortemente influenzate da pathway di quorum sensing (QS), termine utilizzato per descrivere come i batteri comunicano tra loro nel tentativo di modificare, in maniera coordinata, l’espressione genica all’interno della popolazione. Numerosi studi hanno dimostrato che l’inibizione di determinati pathway di QS può portare alla formazione di biofilm che presentano differenze morfologiche nella struttura della biomassa. Inoltre, è noto che le comunità batteriche sessili dei biofilm differiscono notevolmente rispetto alle loro controparti planctoniche; esse sono descritte come entità complesse e dinamiche che verosimilmente rappresentano il tentativo evolutivo dei batteri di sopravvivere alle innumerevoli pressioni ambientali. Le caratteristiche del biofilm giustificano le difficoltà incontrate nella terapia di infezioni croniche, quali ad esempio la fibrosi cistica e la bronchite con le sue esacerbazioni.
L’uso degli antibiotici ha infatti efficacia solo sulla frazione planctonica dei patogeni in causa e la conseguente diminuzione della carica microbica rende ragione del successo temporaneo della terapia e della remissione dei sintomi. La mancata eradicazione delle cellule batteriche del biofilm mantiene attivo il focus infettivo che resta destinato a perpetuare il quadro clinico. Questo processo spiegherebbe così l’eziopatogenesi delle riacutizzazioni. Appare quindi evidente il motivo delle intense ricerche volte alla scoperta di molecole e agenti biologici capaci di disgregare il biofilm o di impedirne la formazione, tra cui alcune molecole antinfiammatorie, detergenti tipo SDS, antibiotici e sostanze chimiche quali EDTA e N-acetilcisteina (NAC), citrato ferrico di ammonio, analoghi degli acil-omoserina-lattoni (AHL), sostanze naturali come i furanoni alogenati e batteriofagi, che si spera di poter utilizzare con successo in terapia.
Invasione, crescita e moltiplicazione del parassita nell’ospite
Per alcuni microrganismi, la patogenicità è associata unicamente alla produzione di tossine e i patogeni non necessitano di penetrare nei tessuti dell’ospite per esplicare i loro effetti. Tuttavia, la maggior parte dei patogeni, per iniziare il processo infettivo, penetra nell’epitelio mediante un meccanismo definito invasione. Nel punto di ingresso, generalmente a livello di piccole rotture o lesioni della pelle o della superficie mucosa, inizia spesso la proliferazione. L’invasione dei tessuti dell’ospite può quindi essere facilitata dalla produzione di proteine extracellulari che agiscono localmente per facilitare la crescita e la diffusione del patogeno e/o per danneggiare le cellule dell’ospite; tali proteine sono definite invasine.
La diffusione dei microrganismi può ad esempio essere facilitata dalla secrezione di enzimi degradativi come la collagenasi (Clostridi), che degrada la trama di collagene che sostiene i tessuti favorendo la diffusione, o di enzimi che piuttosto che favorire la diffusione favoriscono la localizzazione o la protezione, come l’attivatore del plasminogeno (Streptococchi). Vi sono però alcuni batteri che invadono i tessuti anche in assenza di un danno fisico. N. meningitidis e N. gonorrhoeae sono in grado di invadere rispettivamente l’epitelio orofaringeo e genitourinario per endocitosi dalle cellule epiteliali, trasportati al loro interno in vacuoli e liberati nello spazio submucoso, da dove invadono i tessuti sottostanti (in un processo definito transcitosi).
H. influenzae penetra nell’organismo passando attraverso le giunzioni delle cellule epiteliali. Le Salmonelle inducono i macrofagi gastrointestinali dell’ospite (contenuti ad esempio nelle placche di Peyer) per essere da loro fagocitate, resistono all’azione dei fagolisosomi e successivamente proliferano passando nel torrente ematico. Anche Shigella ed E. coli enteroinvasivi (EIEC) sono assunti per endocitosi dalle cellule intestinali. Alcuni dei geni che determinano l’invasività nei batteri enteropatogeni sono portati da elementi genetici extracromosomici come plasmidi che codificano per proteine batteriche superficiali.
Per altri patogeni, inclusi alcuni batteri (Rickettsia rickettsii e Yersinia pestis) e parassiti (Plasmodium e Trypanosoma), può essere necessario l’intervento di un vettore artropode in grado di provocare soluzioni di continuo che ne permettano l’ingresso in circolo. Se un microrganismo patogeno riesce ad accedere ai tessuti, può crescere e moltiplicarsi dando avvio alle manifestazioni patogenetiche. L’inoculo iniziale raramente è sufficiente per provocare danni all’ospite; per indurre la malattia il patogeno deve potersi riprodurre, e per questo deve trovare le sostanze nutritive e le condizioni ambientali appropriate. La temperatura, il pH e il potenziale ossido-riduttivo sono alcuni dei fattori ambientali che influenzano la crescita di un microrganismo, ma la disponibilità di sostanze nutritive, all’interno dei tessuti dell’ospite, è un fattore estremamente importante.
Sebbene per il microrganismo infettante l’ospite possa sembrare un paradiso nutrizionale, non tutte le sostanze necessarie sono presenti in quantità sufficienti. I nutrienti solubili come gli zuccheri, gli aminoacidi e gli acidi organici sono spesso presenti in quantità limitate: sono quindi favoriti i microrganismi in grado di utilizzare composti complessi, come il glicogeno. Non tutte le vitamine e gli altri fattori di crescita sono presenti in quantità sempre sufficiente e in tutti i tessuti. Brucella abortus, ad esempio, può crescere molto lentamente nella maggior parte dei tessuti del bestiame infettato, ma prolifera molto rapidamente nella placenta, provocando aborti. Ciò è dovuto al fatto che nella placenta vi è un elevato contenuto di eritritolo, un nutriente che promuove la crescita di questo microrganismo.
Anche alcuni oligoelementi possono essere presenti in quantità così limitata da influenzare la colonizzazione del patogeno. A tale proposito esistono numerose evidenze riguardanti il ruolo svolto dal ferro nella crescita microbica. Alcune proteine specifiche, presenti nell’ospite, come la transferrina e la lattoferrina, legano il ferro molto efficientemente e lo trasportano in tutto il corpo. L’affinità di queste proteine per il ferro è talmente elevata che i microrganismi infettanti si possono ritrovare spesso in carenza di ferro; la somministrazione in un animale infettato di sali di ferro solubili, attraverso la dieta o per iniezione, aumenta enormemente la virulenza di alcuni patogeni. Molti batteri, inoltre, producono composti in grado di chelare il ferro, chiamati siderofori, che consentono al microrganismo di ottenere ferro dall’ambiente. Alcuni di questi siderofori, isolati da batteri patogeni, sono composti ad altissima affinità per il ferro, tanto che riescono a rimuoverlo dalle proteine dell’ospite. L’aerobactina, ad esempio, un sideroforo prodotto da alcuni ceppi di E. coli, codificato da geni localizzati sul plasmide Col V, è in grado di rimuovere facilmente il ferro legato alla transferrina.
Dopo la penetrazione, il microrganismo spesso rimane localizzato e comincia a moltiplicarsi, producendo un focolaio d’infezione. In alternativa, i microrganismi possono attraversare i vasi linfatici e depositarsi nei linfonodi. Se un microrganismo raggiunge i vasi sanguigni, può essere distribuito nei vari distretti del corpo, concentrandosi, generalmente, nel fegato e nella milza. La diffusione di un patogeno tramite il sangue e il sistema linfatico può determinare un’infezione generalizzata (sistemica) dell’ospite, con il microrganismo che prolifera in vari tessuti. Se invece si verifica una crescita massiva dei microrganismi nei tessuti, essi possono riversarsi in gran numero nel flusso sanguigno, determinando una condizione patologica nota come batteriemia.
Cambiamenti adattativi della virulenza
L’infezione ha un impatto rilevante sia sui microrganismi sia sull’ospite. È sempre più evidente che il microrganismo si adatta alle modificazioni dell’ambiente attraverso complessi meccanismi regolatori, attivando i fattori di virulenza necessari per l’invasione e la sopravvivenza nei tessuti dell’ospite. Gli adattamenti osservati che influenzano la sopravvivenza in un ospite, e quindi la virulenza, includono i cambiamenti nella formazione di fimbrie e flagelli, nella quantità di altri antigeni di superficie, nella formazione di porine, nella secrezione di tossine ed enzimi, nella chemiotassi e nell’assimilazione di sostanze nutritive.
Anche se la maggior parte dei fattori di regolazione ambientale è ancora in gran parte sconosciuta, da lungo tempo è noto che il ferro svolge un ruolo decisivo nel regolare la formazione della tossina difterica e di altri determinanti di virulenza, come la tossina Shiga-like di E. coli enteroemorragico (EHEC), che vengono espressi in un ambiente in cui sia presente una bassa concentrazione di ferro libero, condizione che si riscontra appunto nell’ospite per lo stretto legame del ferro con la transferrina e altre proteine.
La temperatura ha un notevole effetto sulla formazione di molte proteine di superficie; le specie di Yersinia, Shigella e Bordetella, infatti, esprimono fattori di virulenza a 36 °C, temperatura cui è probabile che i microrganismi siano esposti al momento dell’infezione. Coltivare Shigella a 30 °C piuttosto che a 36 °C diminuisce in modo notevole la virulenza di questo batterio. Molti di questi fattori di virulenza batterica sono controllati da sistemi regolatori a due componenti: una componente proteica rileva i cambiamenti ambientali e li segnala, spesso mediante fosforilazione, a una seconda proteina che in modo coordinato regola l’espressione di un gruppo di geni, i prodotti dei quali facilitano la sopravvivenza nell’ambiente.
Tra i vari meccanismi di regolazione coordinata in corso di caratterizzazione, possiamo menzionare quello sotto il controllo del gene toxR di Vibrio cholerae che coordina la formazione di tossine, fimbrie e varie proteine situate sulla membrana esterna. Insieme ai meccanismi di regolazione genica, che influenzano le quantità dei vari prodotti genici attraverso la repressione o l’induzione immediatamente reversibili, altre importanti strategie adottate dai batteri per meglio adattarsi ai continui cambiamenti microambientali riscontrati nell’ospite nel corso del ciclo infettivo sono rappresentate dalla variazione di fase, cioè l’oscillazione reversibile tra stati di espressione alternativa di un gene, e dalla variazione antigenica, ovvero la capacità di elaborare versioni strutturalmente differenti dei principali antigeni di superficie. Tali meccanismi consentono alle cellule batteriche di modificare l’espressione dei determinanti di virulenza, favorendo la selezione e la crescita preponderante delle varianti maggiormente patogene per l’ospite.
Tropismo
Al fine di infettare in maniera efficiente, molti patogeni occupano nell’ospite una nicchia altamente specifica, presentando quindi un tropismo per una particolare sede corporea o tipo cellulare. Il tropismo specie-specifico e tessuto-specifico è spesso determinato dalle adesine espresse sulla superficie delle cellule batteriche, oltre che da capacità intrinseche del batterio. Questa forma di tropismo ha molte implicazioni per il ciclo vitale dell’agente patogeno, per il sistema immunitario dell’ospite e per il processo patologico. Il patogeno Helicobacter pylori, ad esempio, produce l’enzima ureasi, che, scindendo l’urea per formare lo ione ammonio e biossido di carbonio, consente al microrganismo di vivere in un ambiente neutro, nell’ambito dell’epitelio gastrico altamente acido.
È noto che il SNC è protetto in maniera unica dalle alterazioni dell’ambiente ad opera della barriera ematoencefalica (BEE), un sistema di giunzioni serrate a livello dei capillari, che resiste all’ingresso di cellule infiammatorie, di patogeni e di macromolecole negli spazi sub-aracnoidei. Tuttavia, alcuni agenti patogeni hanno sviluppato meccanismi altamente specializzati, anche se non ancora del tutto compresi, che consentono di oltrepassare questa barriera. Alcuni batteri capsulati, infatti, provenienti dal torrente circolatorio, possiedono componenti di superficie che consentono loro di attraversare le giunzioni capillari della BEE. Il grado di specializzazione richiesto per questi meccanismi è dimostrato dalla capacità, da parte di alcuni sierotipi, nell’ambito della stessa specie, di causare .
Il sierotipo III dello streptococco di gruppo B, ad esempio, è responsabile della grande maggioranza dei casi di meningite causati da questo microrganismo, anche se altri sierotipi provocano una malattia molto più invasiva al di fuori del SNC. Questa differenza sembra essere dovuta soltanto alla disposizione della componente glucidica del polisaccaride capsulare; altri sierotipi dello streptococco di gruppo B, infatti, raramente causano meningite, in quanto le loro capsule pur possedendo gli stessi quattro componenti glucidici, li esprimono con una disposizione strutturale diversa.
Fattori di virulenza
I batteri patogeni producono una serie di proteine extracellulari che promuovono la patogenesi, ovvero favoriscono lo stabilirsi e il mantenimento della malattia. Queste proteine sono dette “fattori di virulenza”. Patogeni diversi producono fattori di virulenza diversi, che spesso, però, hanno caratteristiche molecolari o meccanismi d’azione simili. La maggior parte dei fattori di virulenza sono enzimi che intervengono nella colonizzazione e diffusione e favoriscono la crescita batterica.
La ialuronidasi, prodotta da streptococchi, stafilococchi e da alcuni clostridi, è un enzima che promuove la diffusione dei microrganismi nei tessuti dell’ospite, in quanto capace di degradare l’acido ialuronico, un polisaccaride che svolge funzione di collante nei tessuti. Gli streptococchi e gli stafilococchi producono, inoltre, un vasto assortimento di proteasi, nucleasi e lipasi, che servono per depolimerizzare le macromolecole dell’ospite, proteine, acidi nucleici e lipidi rispettivamente. I clostridi producono una collagenasi, o tossina k, che degradando la trama di collagene che sostiene i tessuti favorisce la diffusione dei microrganismi.
Alcuni microrganismi producono enzimi fibrinolitici che dissolvono i coaguli di fibrina che si formano in corrispondenza di una lesione tissutale per delimitare l’infezione, favorendo quindi l’invasione. Una di queste sostanze fibrinolitiche, prodotta da Streptococcus pyogenes, è conosciuta come streptochinasi. Alcuni microrganismi sintetizzano invece enzimi che promuovono la formazione di coaguli di fibrina, che fanno sì che il microrganismo, piuttosto che diffondere, rimanga localizzato e protetto. Il più studiato di questi enzimi è la coagulasi, prodotta da S. aureus, che induce la formazione di un deposito di fibrina sui cocchi stessi, proteggendoli, quindi, dall’attacco delle cellule ospiti.
Le esotossine sono proteine rilasciate nell’ambiente circostante da un microrganismo in crescita che possono diffondere dal focolaio d’infezione verso altre parti del corpo e provocare danni lontano dal sito di produzione. La maggior parte delle esotossine ricade in una delle tre seguenti categorie: tossine citolitiche, tossine A-B e tossine superantigeniche.
Tossine citolitiche
Le tossine citolitiche sono enzimi che attaccano i costituenti cellulari. Vari patogeni producono proteine capaci di ledere la membrana citoplasmatica delle cellule animali, provocandone la lisi e la morte. Anche se agiscono su più tipi cellulari, l’attività delle tossine è particolarmente evidente sui globuli rossi, da qui il nome di emolisine. La produzione di emolisine è facilmente evidenziabile in laboratorio strisciando il microrganismo su una piastra di agar sangue. Durante la crescita delle colonie, l’emolisina rilasciata dal batterio lisa gli eritrociti circostanti, creando una tipica zona di emolisi (come ad esempio quelle prodotte da S. pyogenes).
È stato dimostrato che alcune emolisine attaccano i fosfolipidi della membrana citoplasmatica della cellula ospite. Poiché il fosfolipide lecitina (fosfatidilcolina) è spesso utilizzato come substrato, questi enzimi sono detti anche lecitinasi o fosfolipasi. Un esempio è dato dalla α-tossina di Clostridium perfringens, una lecitinasi capace di dissolvere i lipidi di membrana causando la lisi cellulare. Poiché la membrana citoplasmatica di tutti gli organismi contiene fosfolipidi, le citolisine dotate di attività fosfolipasica, alcune volte, distruggono le membrane tanto dei batteri quanto delle cellule animali.
La streptolisina O, una citolisina prodotta dagli streptococchi, colpisce invece gli steroli della membrana citoplasmatica, in particolare il colesterolo alterando di fatto la rigidità della membrana citoplasmatica. Tra le tossine citolitiche ricordiamo, infine, le leucocidine, agenti litici capaci di lisare i globuli bianchi del sangue riducendo così la resistenza dell’ospite.
Esotossine di tipo tossine A-B
Le esotossine di tipo tossine A-B, invece, sono costituite da due subunità legate covalentemente: la componente B si lega generalmente a un recettore presente sulla superficie cellulare, in modo tale da permettere il trasferimento della subunità A attraverso la membrana della cellula bersaglio, dove la sua azione provoca un danno cellulare.
Tossine superantigeniche
Le tossine superantigeniche, infine, sono molecole che hanno la capacità unica di legare contemporaneamente le molecole del complesso maggiore di istocompatibilità di classe II (MHC II) con i recettori presenti sulle cellule T e formano un complesso trimolecolare che induce fortemente la proliferazione dei linfociti T determinando una forte reazione infiammatoria locale con rilascio di citochine che possono portare a estesi danni vascolari ed epiteliali fino allo shock tossico.
Il principale bersaglio dei superantigeni sono le cellule T-CD4+ che indotte determinano un’incontrollata stimolazione della risposta T helper di tipo I. Anche alcune componenti strutturali dei patogeni sono spesso responsabili di molti aspetti patogenetici caratterizzanti l’infezione. I lipopolisaccaridi dei batteri gram-negativi agiscono come potenti endotossine (“endo” in questo caso è riferito al fatto che sono parte della membrana batterica e non un prodotto di secrezione) in grado di causare la sindrome settica. Si ritiene, inoltre, che costituenti della parete cellulare dei batteri gram-positivi, quali acidi teicoici e frammenti di peptidoglicano, possano evocare una risposta infiammatoria simile nell’ospite. Il patogeno anaerobio Bacteroides fragilis possiede un polisaccaride capsulare che promuove la formazione di ascessi da parte dell’ospite.
Fonti
- Baker, M.D., Acharya, K.R. (2004), «Superantigens: structure-function relationships», International journal of Medical Microbiology, 293, pp. 529-537.
- Davis, B.D., Dulbecco, R., Eisen, H.N., Ginsberg H.S., Microbiologia, parte III, cap. 26, Zanichelli, Bologna, 1993.
- Dehò, G., Galli, E., Biologia dei microrganismi, 2a ed., Casa Editrice Ambrosiana, Milano, 2014.
- Isselbacher, KJ., Braunwald, E., Wilson, J.D., Martin, J.B., Fauci, A.S., Kasper, D.L., Harrisοn -Principi di Medicina Interna, parte VI, sezione VI, McGraw-Hill, Milano, 2004.
- Medini, D., Serruto, D., Parkhill, J., Relman, D.A., Donati, C., Moxon, R., Falkow S., Rappuoli,R. (2008), «Microbiology in the post-genomic era», Nature Reviews Micro-biology, 6, pp.419-429.
- Madigan, Μ.T., Martinko, J.M., Parker J., Brock. Biologia dei microrganismi, vol. 2, capp. 25 e 26, Casa Editrice Ambrosiana, Milano, 2003.
- Mecsas, J., Strauss E.J. (1996), «Molecular mechanisms of bacterial virulence: type III secretion and pathogenicity islands», Emerging Infectious Diseases, 2, pp. 261-288.
- Reading, N.C., Sperandio, V. (2006), «Quorum sensing: the many languages of bacteria»,FEMS Microbiol Lett. 254(1), pp.1-11