Caratteristiche generali
I funghi ascomiceti, dopo i basidiomiceti, raffigurano uno dei phyla più vasti; non a caso, comprendono un numero di specie pari a 64.000, che costituisce il 75% delle specie rilevate. A livello morfologico, i miceti appartenenti a questo gruppo sono notevolmente differenti tra loro.
Inoltre, una loro caratteristica molto particolare è che rientrano nella maggioranza dei miceti che possono stabilire una simbiosi con alghe e cianobatteri. Questa associazione mutualistica è nota con il nome di licheni (Fig. 1).

A questo phylum si associano spesso le cosiddette “muffe” (termine di uso comune) responsabili di patologie, ma nella realtà questo gruppo non è composto solo da funghi patogeni/dannosi per piante ed esseri umani. Infatti, fanno parte degli ascomiceti anche i lieviti utilizzati per realizzare bevande alcoliche e prodotti alimentari (Saccharomyces cerevisiae, Aspergillus oryzae), i tartufi e Morchella esculenta (anche conosciuta come spugnola).
Prima dell’avvento delle tecniche molecolari, la tassonomia dei funghi veniva effettuata attraverso una divisione morfologica. Per questo motivo gli ascomiceti hanno preso il nome dai sacchi specializzati, o “aschi”, che hanno la funzione di contenere le spore sessuate.
Recuperare informazioni fossili di questi miceti è un po’ complesso, ma è noto che le principali stirpi di ascomycota che formano i licheni hanno avuto origine almeno nel Carbonifero. Nel Giurassico e nel Cretaceo hanno subito successive divisioni generando la diversità dei principali gruppi moderni.
Esempi di ascomiceti
Non è semplice orientarsi nel mondo dei funghi, in particolare nel phylum degli ascomiceti. Infatti, questi miceti sono morfologicamente dissimili e comprendono i lieviti unicellulari, i funghi filamentosi e i funghi a coppa più complessi. Quindi, per agevolare la comprensione di cos’è un ascomicete, di seguito verranno mostrati degli esempi a seconda del subphylum a cui appartengono:
- Taphrinomycotina: I funghi appartenenti a questa divisione sono simili ai lieviti e solitamente patogeni sia per gli esseri umani (come ad esempio il Pneumocystis jirovecii) che per le piante (ad esempio Taphrina deformans, che causa la fitopatologia del pesco nota come arricciamento fogliare). Inoltre, solo recentemente non sono più classificati come protozoi.
- Saccharomycotina: include specie unicellulari, come i lieviti, che si riproducono per gemmazione vegetativa. Alcuni esempi sono Saccharomyces cerevisiae (famoso per il suo utilizzo nella produzione di alcolici), Schizosaccharomyces pombe (adoperato come organismo modello in biologia molecolare e cellulare) e la Candida albicans (ben noto come agente eziologico della candidosi).
- Pezizomycotina: comprende tutte le specie che producono un ascocarpo, e include alcuni funghi della carie del legno. Alcuni esempi sono Neurospora crassa (utilizzato come organismo modello negli studi sulla metilazione del DNA), Aspergillus niger (meglio noto come “muffa nera”) e fitopatogeni (Fig. 2) come Fusarium culmorum, Fusarium graminearum, Microdochium majus. Oltre a questi, ci sono anche funghi commestibili, solitamente dal valore molto elevato, come i tartufi e la spugnola.

Riproduzione ascomiceti
Nel ciclo vitale del fungo la parte della riproduzione (Fig. 3) è stata quella più impiegata dai micologhi per la tassonomia. Precisamente, il nome del phylum Ascomycota deriva dalle strutture riproduttive che caratterizzano questi funghi sono degli “aschi” (o sacchi), che racchiudono da quattro a otto ascospore.
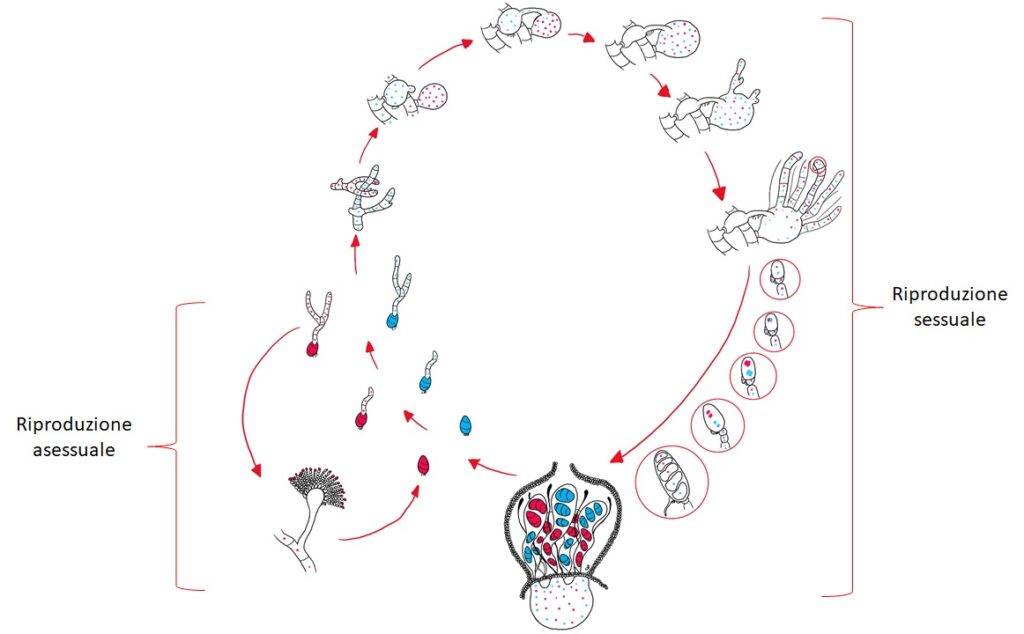
I funghi ascomiceti si riproducono tramite spore unicellulari (gemmazione) o multicellulari (prodotte dalle ife). Tali strutture possono essere originate per riproduzione asessuata o sessuata.
Riproduzione sessuata
La riproduzione sessuata fornisce alla progenie fungina il grande vantaggio biologico della diversità genotipica come risultato del crossing over o della mescolanza di porzioni di coppie cromosomiche durante la meiosi. Questa diversità genotipica permette un’alta variabilità per le selezioni adattative che possono aiutare la sopravvivenza in condizioni mutevoli.
La riproduzione sessuata inizia con lo sviluppo di ife speciali (ascus) da uno dei due tipi di ceppi di accoppiamento: il ceppo “maschile” produce un anteridio, mentre il ceppo “femminile” sviluppa un ascogonio. Alla fecondazione l’anteridio e l’ascogonio si combinano mediante il processo detto plasmogamia, senza fusione nucleare. Successivamente a questa unione, nascono speciali ife ascogene in cui migrano coppie di nuclei: una del ceppo “maschio” e una del ceppo “femmina”. In ogni asco avviene la cariogamia tra due o più ascospore aploidi, e cioè fondono i loro nuclei.
E’ importante tenere presente che un corpo fruttifero (ascocarpo – Fig. 4 -) ha migliaia di aschi, i quali, dopo che il nucleo diploide produce dei nuclei aploidi per meiosi, rilascerà migliaia di ascospore. Dopo il rilascio, le spore arriveranno a contatto con il substrato di crescita adeguato, germineranno e formeranno ife che si diffondono nell’ambiente e danno inizio a nuovi miceli.

Riproduzione asessuata
La riproduzione asessuata degli ascomiceti è frequente e comporta la produzione di conidiofori che rilasciano conidiospore aploidi. Le spore asessuali si formano direttamente da un’ifa senza divisione meiotica. Questa modalità di generare ascospore è molto comune in questo phylum, seppure è una riproduzione che può avvenire anche nei basidiomiceti (in forma nettamente minore, tant’è che è considerata inusuale); verrà descritta in maniera generale riferendoci ai Deuteromiceti, chiamati anche funghi imperfetti oppure funghi mitosporici.
In aggiunta a ciò, è importante specificare che le specie posizionate in questo gruppo di miceti (di cui non si conosce la riproduzione sessuata), il 90% presenta affinità con gli ascomiceti. Si noti che i Deuteromiceti non sono un phylum, bensì solo un assemblaggio di organismi che non si sa dove inquadrare con precisione nell’ordine tassonomico; nella maggior parte dei casi la collocazione è possibile con tecnologie molecolari o solo quando viene scoperta la riproduzione sessuale.
Strutture di riproduzione asessuata
Comunemente la riproduzione avviene tramite la genesi di spore immobili (conidi) prodotte per mitosi (cioè asessualmente) da cellule conidiogene che possono essere libere, come nel caso dei lieviti con la gemmazione, o più comunemente formate su ife di supporto separate (conidiofori) e/o cellule che possono essere prodotte in o su strutture fruttifere organizzate (conidiomi).
La conidiogenesi che forma i conidi può essere (Fig. 5):
- Blastica: la parete della cellula conidiogena si espande all’apice dell’ifa a formare la parete del conidio, per poi creare un setto basale. Questo processo è simile alla gemmazione e può essere simpoidale (i conidi rimangono attaccati all’ifa materna mediante un peduncolo), anellidica (i conidi si staccano dalla cellula produttrice lasciando una “cicatrice”) e fialidica (la struttura produttrice è simile ad una fialide).
- Tallica (o artrica): l’ifa, dopo aver formato dei setti trasversi, si frammenta e rilascia dei conidi. Può essere artrica (l’ifa si struttura con dei setti che si spezzeranno per schizolisi) o solitaria (la settazione avviene all’apice dell’ifa).

I conidiofori (le ife fertili che portano i conidi) possono essere singoli oppure presentarsi aggregati in corpi fruttiferi (conidiomi – Fig. 6-). Questi ultimi possono essere:
- Acervuli: cellule conidiogene e conidifori aggregati a forma di coppa o lenticolari. Solitamente sono immersi nel tessuto dell’ospite.
- Picnidi: conidiomi sferici e solitamente ostiolati.
- Sporodochi: cellule conidiogene e conidiofori molto aggregati che possono ricordare dei cuscini.
- Sinnemi: i conidiofori in sporulazione sono raccolti in fasci nella parte apicale o laterale.

Identificazione
Caratteristiche microscopiche
Dai corpi fruttiferi ottenuti dalla riproduzione sessuata possiamo considerare il numero e la conformazione degli aschi. Anche la diversa morfologia dell’ascospora (clavata, ovoidale, circolare, ecc.) permette la classificazione del fungo in esame.
Negli ascomiceti è possibile esaminare le spore prodotte per via asessuata. In questo caso vengono osservati il colore, la forma e, quando possibile, la modalità di formazione (conidiogenesi).
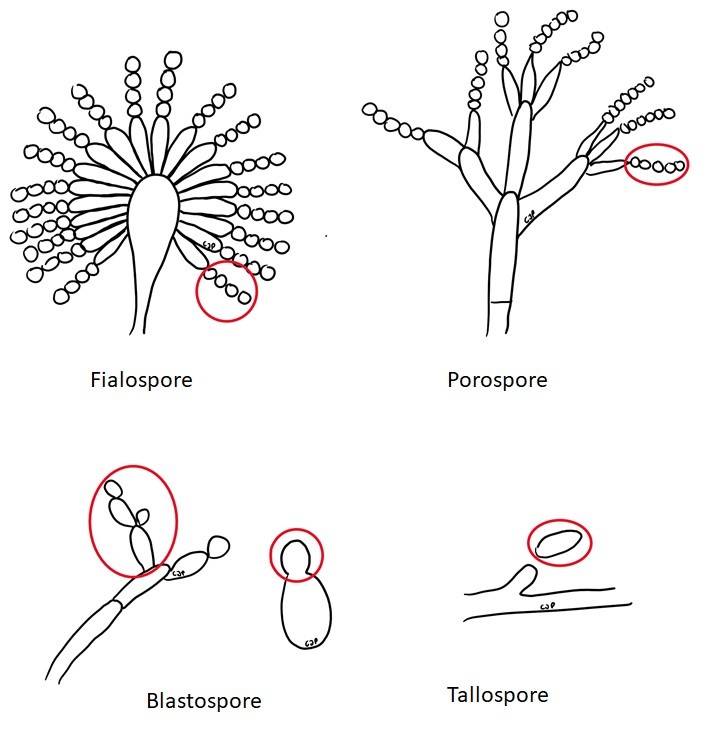
I conidi (Fig. 5 e Fig. 7) si possono differenziare in:
- Oloblastici (olotallici), originati da conidiogenesi ologena, quando presentano entrambi gli strati della parete continui con il conidioforo,
- Enteroblastici (enterotallici), originati dalla conidiogenesi enterogena, quando la parete esterna del conidio è continua con solo lo strato più interno della parete della cellula conidiogena oppure ne è completamente indipendente.
- Fialospore, che sono le spore originate da una cellula terminale del conidioforo con una forma di fiasco.
- Porospore, che sono ascospore prodotte attraverso un poro microscopico del conidioforo.
- Blastospore, cioè conidi prodotti per gemmazione.
- Tallospore, ovvero sono cellule del tallo (ifa) che diventano conidiospore.
Conidiogenesi
La conidiogenesi si può differenziare in:
- Progressiva (percorrente): il conidioforo prolifera in seguito alla generazione del conidio.
- Petrogressiva: la cellula conidiogena, dopo la formazione della spora, si accorcia oppure resta stazionaria.
- Simpodiale: il locus conidiogeno è subapicale e si sposta lateralmente al formarsi del conidio successivo.
- Sincrone: i conidi si originano contemporaneamente.
- Solitaria: i conidi si sviluppano singolarmente (solitari).
- In successione: le spore creano catene o false catene, oppure teste conidiche. Nel dettaglio le formazioni si riconoscono per:
- Catena: i conidi sono in continuità (sia in maniera ologena che enterogena).
- Falsa catena: i conidi sono insieme dalla successione imperfetta.
- Acropeta: il conidio più giovane è all’apice della catena.
- Basipeta: il condi più giovane è alla base della catena.
Caratteristiche macroscopiche
Al fine di identificare un ascomicete attraverso le caratteristiche macroscopiche, possiamo osservare il corpo fruttifero o l’ascocarpo (Fig. 8). Inoltre, con questa struttura possiamo differenziarlo anche dai basidiomiceti che producono il basidiocarpo.
A seconda della specie si hanno diverse strutture per diffondere le spore (ascocarpo):
- Cleistotecio (ascoma chiuso), distinto da una forma sferica o globosa, è chiuso da uno strato esterno membranoso, sterile e protettivo. Gli aschi sono solitamente disposti in maniera disordinata. Questa struttura la si può trovare sia sottoterra sia sul suolo, e a seconda della forma si hanno:
- Pulverotecio, solitamente con la produzione di spore polverulenti.
- Pticotecio, che presenta numerose pieghe interne, e spesso è una struttura semichiusa.
- Stereotecio, che ha solitamente un rivestimento esterno compatto e duro (tipico dei tartufi).
- Apotecio, che ha una struttura aperta, solitamente a coppa come ricettacolo di accumulo di spore. A seconda della specie, la struttura assume forme differenti, con strutture sessili o con gambo, e si può trovare sulla superficie del terreno oppure semi-ipogea. Questa tipologia di struttura si può presentare da sola oppure come fruttificazioni collettive (ad esempio la spugnola potrebbe essere considerata una di queste). Gli aschi, insieme ai parafisi, sono disposti a palizzata e in maniera ordinata. Invece la struttura di sostegno (sterile), detta excipulum, è suddivisa in medullare (che ha il compito di sostenere l’imenio) ed ectale (il rivestimento esterno).
- Peritecio, che è una struttura aperta, normalmente all’apice, ed è caratterizzato da un’apertura detta ostiolo, dal quale escono le spore. Hanno una forma ostiolata, a fiasco o globosa. Nel ventre (o interno cavo) si trova il tecio (o imenio) con allineati gli aschi monotunicati (aschi con una parete esterna). Può avere una struttura libera o incorporata (ascostroma) in uno stroma.
- Pseudotecio, contraddistinto da una struttura simile a quella del peritecio, con la differenza che produce degli aschi bitunicati, cioè con una doppia parete esterna (la ectotunica), solitamente rigida, e una membrana interna (la endotunica), flessibile. Come il peritecio, di solito sono sistemati in colonie.

Identificazione delle colture
Il principale metodo di identificazioni per gli ascomiceti è la loro coltivazione su terreni specifici. Generalmente sono il MEA, il PDA (per esempio Microdochium spp. e Fusarium spp.), l’OA, il CREA, il CYA (es. Penicillium spp. e i Saccharomyces) lo YES, l’UNO, il TSA (per Candida albicans), il MY50G e il CzP (come nel caso dell’Aspergillus spp.). Ovviamente ogni specie predilige un terreno rispetto ad un altro. Inoltre, alcuni generi necessitano di aggiunte di sostanze al substrato di crescita, come ad esempio il saccarosio. Nel caso degli xerofili come Eurotium e Xeromyces, il primo richiede un’aggiunta del 20% di saccarosio e il secondo del 50% di glucosio.
Successivamente vengono incubati tra i 18°C e i 30°C a seconda della temperatura ottimale di sporulazione del fungo che stiamo studiando e con differenti luci (per esempio UV nel caso di alcuni Fusarium spp. e Microdochium spp.).
Dopo un periodo di incubazione specifico a seconda della specie (per esempio una settimana per i Fusarium spp., il Microdochium majus e M. nivale – Fig. 9-), è possibile studiare la conformazione della colonia e la produzione di altre sostanze (come gli alcaloidi).

Per lo studio della colonia formatosi si osservano:
- Colore delle ife e delle spore
- Forma: irregolare, rizoide, filamentosa, ecc.
- Margine: intero od ondulato
- Profilo: piatto, convesso oppure umbonato.
- Superficie: liscia, rugosa, lucida od opaca.
- Consistenza: compatta, sfaldabile, pastosa o mucosa
- Disposizione delle spore e delle ife.
Fonti
- Conrad L. Schoch, Gi-Ho Sung, Francesc López-Giráldez, Jefferey P. Townsed, Jolanta Miadlikowska, Valérie Hofstetter, Barbara Robbertse, P. Brandon Matheny, Frank Kauff, Zheng Wang et al., 2009, “The Ascomycota Tree of Life: A Phylum-wide Phylogeny Clarifies the Origin and Evolution of Fundamental Reproductive and Ecological Traits”, Systematic Biology, Vol. 58, n. 2, pp. 224-339
- Richard J. Bennett e B. Gillian Turgeon, 2016, “Fungal Sex: The Ascomycota”, ASM Journals Microbiology Spectrum, Vol. 4, n°5
- Maria Prieto e Mats Wedin, 2013, “Dating the Diversification of the Major Lineages of Ascomycota (Fungi)”, PloS one, Vol. 8, n° 6
- David A. Schisler, Wojciech J. Janisiewicz, Teun Boekhout, Cletus P. Kurtzman, 2011, “Chapter 4 – Agriculturally Important Yeasts: Biological Control of Field and Postharvest Diseases Using Yeast Antagonists, and Yeasts as Pathogens of Plants”, The Yeasts (Fifth Edition), pp. 45-52
- Jules J. Berman, 2012, “Chapter 36 – Ascomycota”, Taxonomic Guide to Infectious Diseaases, pp. 199-208
- Robert A. Zabel e Jeffrey J. Morrell, 2020, “Chapter Three – The characteristics and classification of fungi and bacteria”, Wood Microbiology (Second Edition) Decay and Its Preventation, pp. 55-98
- 24.3C: Ascomycota – The Sac Fungi, 2021, Biology, LibreTexts
- Thomas J. Volk, 2001, “Fungi”,Encyclopedia of Biodiversity, pp. 141-163
- Università degli studi di Torino, Dipartimento di Biologia Vegetale, “Chiave interattiva per l’identificazione dei funghi dell’aria e degli alimenti”