Le tossine batteriche sono molecole prodotte da batteri, come suggerisce lo stesso nome, queste molecole nocive possono essere suddivise in Esotossine ed Endotossine. Le Endotossine vengono liberate nell’organismo alla morte del batterio, l’esotossine invece sono di natura proteica, e vengono prodotte sia dai batteri Gram positivi che Gram negativi e stimolano l’organismo alla produzione di anticorpi specifici. Le anatossine fanno parte delle esotossine, questo particolare questo tipo di tossine ha perso la propria tossicità, mantenendo comunque la caratteristica di antigene.
Generalità
Le esotossine si ritrovano negli estratti cellulari e nel terreno di coltura; come quasi tutte le proteine sono termosensibili, e sono quindi velocemente inattivate dal calore per denaturazione della loro struttura molecolare.
Sono suddivise in tre gruppi, in base al tipo di azione svolta:
- Neurotossine: interferiscono con la normale trasmissione degli impulsi nervosi
- Citotossine: aggrediscono enzimaticamente le cellule dell’ospite, uccidendole
- Enterotossine: attraverso una stimolazione anormale sono responsabili del funzionamento anomalo delle cellule dell’apparato gastroenterico
Come agiscono le Esotossine Citolitiche?
Agiscono formando dei canali nelle membrane plasmatiche, le cellule dunque muoiono per lisi osmotica avendo perso acqua e sali; un batterio con esotossine citolitiche è Staphylococcus aureus.
Come agiscono le Esotossine Neurotrope?
Tipici esempi di esotossine Neutrotope sono la tossina botulinica, che agisce sul sistema nervoso periferico impedendo il rilascio dell’acetilcolina e provocando la morte per paralisi flaccida, e la tossina tetanica che agisce sul sistema nervoso centrale ed in particolare sulle sinapsi, bloccando la liberazione di neurotrasmettitori inibitori dell’impulso nervoso; di conseguenza, si ha morte dell’ospite per paralisi spastica.
Come agiscono le Esotossine enterotossiche?
Le tossine enterotossiche o entropatogene agiscono a livello intestinale. Ad esempio l’esotossina del colera attiva un enzima che porta ad una sovrapproduzione di AMP ciclico, alterando gli scambi idrici ed elettrolitici della cellula. Questo particolare tipo di esotossine provoca vomito e diarrea, e nel caso del colera alla morte dell’individuo per severa disidratazione. Agiscono formando dei canali nelle membrane plasmatiche.
Struttura chimica
Tutte le esotossine, sono proteine nelle quali si possono distinguere due domini strutturali, uno dei quali, detto dominio A, è responsabile dell’attività tossica essendo un enzima capace di trasferire un residuo di adenosina dal NAD a una macromolecola della cellula bersaglio, la cui funzione risulta permanentemente inibita. L’altro dominio detto B, è responsabile dell’interazione con i recettori cellulari e, quando non fa parte della stessa catena polipeptidica del dominio A, è chimicamente legato a esso da ponti di solfuro. Alcune esotossine possiedono un solo dominio B, mentre altre ne possiedono fino a cinque e oltre; in questo caso i domini B sono catene polipeptidiche indipendenti dal dominio A. La distinzione tra l’attività tossica e quella di interazione con la cellula bersaglio, ha consentito la sintesi delle immunotossine, le quali hanno elevata e selettiva attività tossica nei confronti delle cellule bersaglio e sono state impiegate nel trattamento di sindromi neoplastiche.
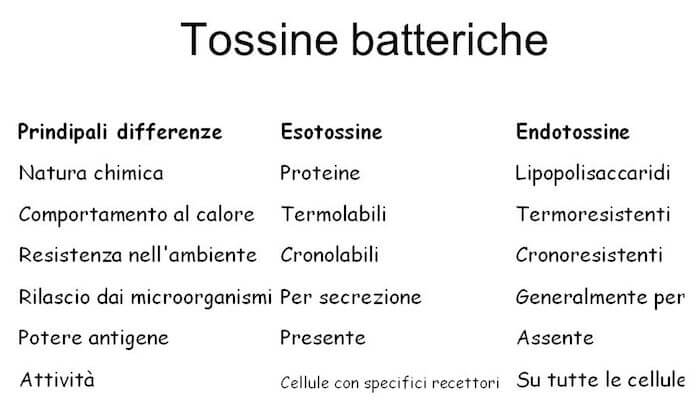
Differenze tra endo- ed esotossine
Principali caratteristiche e differenze tra endo- ed esotossine (Fig.1):
Esotossine
- Escrete da cellule viventi e ritrovate ad elevate concentrazioni nei terreni
- Polipeptidi PM 10.000-900.000
- Relativamente instabili: tossicità spesso rapidamente distrutta col calore >60°
- Altamente antigeniche, stimolano la formazione di alti titoli di antitossina che neutralizza la tossina
- Convertibile in antigene (anatossina) da formalina, acidi, calore ecc.
- Altamente tossiche, fatali per animali da laboratorio in mg o meno
- Non producono febbre nell’ospite
Endotossine
- Parte integrante della parete dei gram-negativi
- Complesso lipopolisaccaridico (LPS), Il lipide A è la porzione responsabile della tossicità
- Stabile al calore >60° per ore senza perdere tossicità
- Non stimola la formazione di antitossina la parte polisaccaridica (molto variabile) stimola la produzione di anticorpi
- Non è convertibile in anatossina
- Debolmente tossico per animali anche a dosi di mg
- Spesso causa febbre
Siti di attività delle esotossine
Esotossine che agiscono a livello delle strutture della superficie cellulare
Tossina esfoliativa: prodotta da Staphylococcus aureus, causa fondamentale della cosiddetta sindrome della cute pseudoustionata da stafilococco,diffondendo attraverso i capillari del derma, lo strato granuloso dell’epidermide nel quale la tossina si fissa.
Tossine emolitiche: si inseriscono nella porzione lipidica della membrana, causando la formazione di pori che alterano profondamente gli scambi della cellula con l’ambiente, causandone la morte.
Esotossine che agiscono inibendo la sintesi proteica cellulare
I principali esempi di esotossine che agiscono inibendo la sintesi proteica cellulare sono rappresentati dalla tossina difterica, dalla tossina A di Pseudomonas aeruginosa e dalla tossina di Shiga. La tossina viene introdotta nella cellula per endocitosi mediata dal recettore e, dopo l’interruzione del ponte disolfurico ad opera di sostanze riducenti intra-cellulari, il componente A viene traslocato nel citosol attraverso la membrana della vescicola endocitica. Il componente A possiede un’attività catalitica ADP-ribosilante, il bersaglio dell’attività ADP-ribosil-trasferasi del componente A della tossina difterica è rappresentato dal fattore di allungamento 2 (EF-2) che interviene nella sintesi della catena peptidica a livello della traslocazione sul ribosoma. Il complesso EF-2-ADP-ribosio che ne risulta è inattivo e di conseguenza la sintesi proteica viene bloccata, portando a morte la cellula.
Esotossine che agiscono alterando il contenuto intra-cellulare di AMP-ciclico
Le tossine che agiscono alterando il contenuto intra-cellulare di AMP-c agiscono con due fondamentali meccanismi. Un primo gruppo di tossine agisce alterando la funzionalità delle proteine G, famiglia di proteine coinvolte nelle cascate dei cosiddetti “secondi messaggeri” che utilizzano lo scambio di guanosina difosfato come interruttore molecolare per avviare o interrompere alcune reazioni biochimiche all’interno della cellula. Il secondo gruppo di tossine è caratterizzato da un’attività adenilato-ciclasica intrinseca e sono quindi in grado di sintetizzare autonomamente AMP-c una volta pervenute all’interno della cellula bersaglio.
Batteri patogeni produttori di esotossine
I piu’ importanti patogeni produttori di esotossine sono: il Corynebacterium diphteriae, responsabile della difterite; i batteri (del genere Clostridium) responsabili del tetano, del botulismo, della gangrena gassosa; alcuni stipiti di streptococchi emolitici del gruppo A, produttori di emolisine e della tossina eritrogenica responsabile dell’eruzione eritematosa nella scarlattina; gli stafilococchi produttori della tossina alfa, con potere emolitico e necrotizzante; il bacillo di Shiga (Shigella dysenteriae), produttore di un’esotossina con proprietà necrotizzanti sulla mucosa dell’intestino crasso, responsabile dei sintomi della dissenteria bacillare.
Dr. Giosuè Ruggiano
Fonti:
- Esotossina – Wikipedia
- Tossine batteriche: Anatomia – Medicina generale | Pazienti.it
- Patogenicità e virulenza (unige.it)
- Figura 1:Tossine batteriche (chimica-online.it)
- esotossina su Enciclopedia | Sapere.it
- Immagine iniziale: batteri con facce di mostri su sfondo bokeh 1102758 – Scarica Immagini Vettoriali Gratis, Grafica Vettoriale, e Disegno Modelli (vecteezy.com)