La barriera emato-encefalica (BEE) è una delle tante strutture poste a protezione del cervello. La sua funzione specifica è quella di regolare, in maniera selettiva, il passaggio di sostanze/microrganismi potenzialmente pericolosi dal circolo sanguigno al cervello e viceversa. In questo modo protegge il Sistema Nervoso da eventuali danni, intossicazioni ed infezioni. In particolare essa limita il transito di molecole con grosso peso molecolare (>500 Da) come farmaci e tossine ed impedisce l’ingresso degli agenti patogeni.
Struttura barriera emato-encefalica
La barriera ematoencefalica si presenta come una struttura caratteristica, compatta e unitaria. La funzione sigillante è garantita dalla presenza delle giunzioni cellulari strette, o tight junction, tra le cellule endoteliali delle pareti dei capillari cerebrali che la compongono.
Le giunzioni strette, dette anche occludenti o serrate, rappresentano delle vere e proprie specializzazioni di membrana in grado di saldare letteralmente due cellule adiacenti, senza lasciare spazi tra loro (Figura 1). Esse sono tipiche delle pareti dei vasi cerebrali, degli epiteli di rivestimento, come la pelle, e degli epiteli intestinali ed assicurano che sostanze non idonee non passino dal sangue al parenchima, dal lume alla lamina, da una cellula all’altra o che semplicemente filtrino tra due ambienti senza controllo.

L’endotelio dei capillari cerebrali è quindi continuo e privo di fenestrature, requisiti indispensabili per la protezione dei neuroni e del tessuto cerebrale in generale.
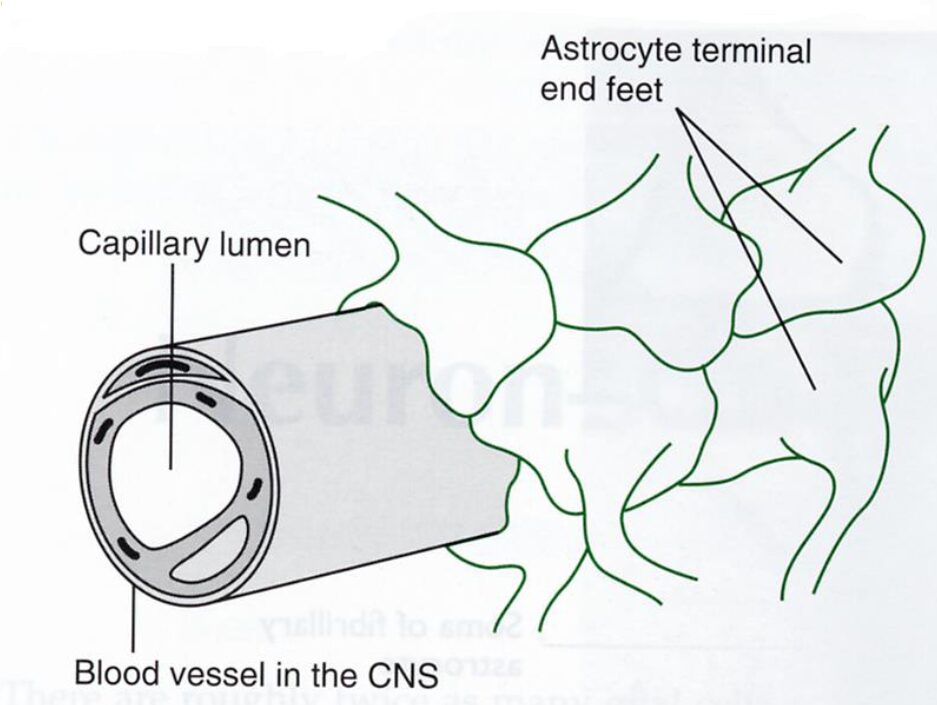
Contribuiscono alla formazione della BEE anche i prolungamenti astrocitari (Figura 2), la cui presenza isola ulteriormente il tessuto nervoso ed aumenta la capacità di filtraggio della barriera stessa. I processi astrocitari, difatti, terminano con dei rigonfiamenti, chiamati pedicelli o peduncoli, che si appongono ai capillari della BEE. Essi, disposti in file regolari lungo i vasi sanguigni, evitano un contatto diretto tra la parete del vaso ed il tessuto nervoso circostante, impedendo ulteriormente il flusso di sostanze non lipofile o con PM alto dal sangue allo spazio interstiziale, e quindi ai neuroni.
Questa particolare disposizione dei processi astrocitari viene chiamata glia limitans.
Ruolo degli astrociti
Gli astrociti hanno una funzione tutt’altro che marginale, difatti il contatto diretto con i capillari cerebrali formanti la barriera emato-encefalica permette loro di regolare:
- la formazione delle giunzioni serrate fra le cellule endoteliali della BEE rilasciando TGFα (transforming growth factor) e GDNF (glial derived neurotrophic factor);
- il flusso e la pressione dei vasi sanguigni cerebrali;
- l’omeostasi encefalica dell’acqua attraverso le acquaporine;
- il contenuto chimico dello spazio extracellulare;
- la diffusione dei neurotrasmettitori;
- la concentrazione extracellulare di molte sostanze che possono interferire con la corretta funzione neuronale (es: ioni potassio);
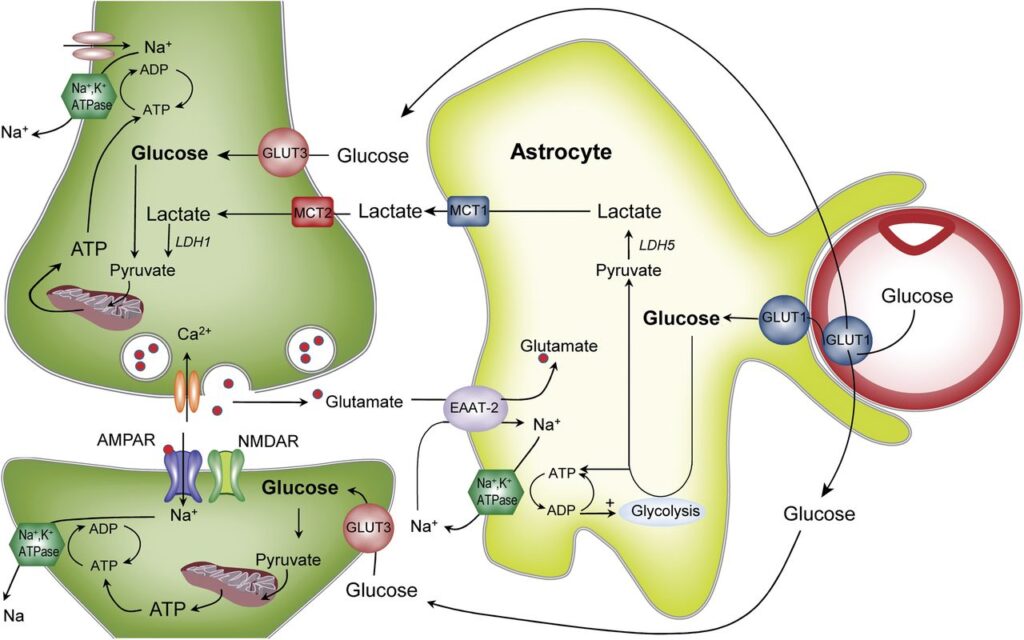
Inoltre i processi astrogliali sono ricchi di trasportatori del glucosio: gli astrociti accumulano glucosio sotto forma di glicogeno (Figura 3) per poi rifornire i neuroni su richiesta.
Infine, oltre a contribuire alla formazione della BEE, gli astrociti contribuiscono anche a delimitare il confine, a ridosso della pia madre, tra il tessuto nervoso e le meningi e, ancora, tra il tessuto nervoso ed il liquido cefalorachidiano (liquor o LCR) a livello delle cavità dei ventricoli e del canale ependimale. Il liquor è il fluido trasparente prodotto a livello dei plessi coroidei, nei ventricoli cerebrali, che occupa lo spazio subaracnoideo e bagna per intero l’encefalo ed il midollo spinale. Quando un’infezione si estende al liquor, molto rapidamente raggiungerà anche il Sistema Nervoso Centrale (SNC) provocando gravi danni. Per tale motivo la presenza di una barriera risulta essere strettamente necessaria.
Funzione della barriera emato-encefalica
La BEE funge quindi da vero e proprio divisorio tra sangue periferico/cerebrale e parenchima circostante.
Per questo motivo è selettivamente permeabile: essa blocca il passaggio di tossine ed altri composti dannosi e di gran parte delle molecole idrofile. Un esempio? Gli zuccheri. Il glucosio è una fonte di nutrimento per i neuroni ed è indispensabile per il loro funzionamento. Tuttavia, per poter attraversare la BEE necessita di specifici trasportatori (Figura 3). Assurdo ma vero, anche alcuni neurotrasmettitori, essendo molecole polari, non possono oltrepassare la BEE. Tra questi la dopamina, la cui mancanza per neurodegenerazione a livello della substantia nigra dei nuclei della base determina la sintomatologia tipica del morbo di Parkinson. Per la cura di questa malattia sembra essere molto utile la somministrazione di L-dopa, precursore della dopamina stessa, che invece riesce ad entrare nel SNC grazie ad un carrier. Da qui L-dopa è metabolizzata in dopamina, riattivando la via nigro-striatale.
Anche gli anticorpi risultano troppo grandi per attraversare la barriera emato-encefalica, per questo nel cervello vi sono cellule immunitarie residenti: la microglia.
L’efficacia di questa barriera dipende, ovviamente, dal mantenimento di tutte le caratteristiche biochimiche, biofisiche, anatomiche e funzionali della stessa.
Scoperta
Fu il microbiologo Paul Ehrlich, nel XIX secolo, il primo ad intuire l’esistenza di una vera e propria barriera che isolava un organo così importante come il cervello dal resto del corpo.
Dopo innumerevoli studi sulla colorazione istologica notò come alcune sostanze, una volta iniettate in tessuti animali, “coloravano” per l’appunto organi, cellule e/o parti di esse, rendendole visibili al microscopio. L’unica eccezione era rappresentata dal cervello, che sembrava incapace di assorbire qualsiasi pigmento.
Quando però Ehrlich, assieme ad uno dei suoi studenti, introdusse il pigmento di anilina direttamente nel liquor scoprì che in questo caso solo il cervello si tingeva mentre tutti gli altri tessuti rimanevano incolore. La spiegazione più ovvia, per loro, era la presenza di una lamina esterna che contornava l’encefalo e che non si lasciava penetrare dal colore.
Solo con l’invenzione del microscopio elettronico a scansione si confermò definitivamente l’esistenza di una membrana protettiva attorno al cervello: la barriera emato-encefalica.
Punti deboli della barriera emato-encefalica
L’integrità della BEE è influenzata da numerosi fattori; tra questi lo stato di salute e l’età del soggetto. Uno stato infiammatorio, ad esempio, causato da un’infezione batterica (meningite), indebolisce la BEE, determinando una ridotta selettività della stessa. In tal caso un trattamento iniziale con penicillina può avere senso (Figura 4). L’antibiotico in questione non è liposolubile, quindi è impossibilitato ad attraversare la BEE, a meno che le meningi non siano infiammate. Nei bambini, invece, la BEE deve ancora definirsi ed assestarsi del tutto, per cui è ancora molto immatura e permeabile.

Anche negli adulti esistono regioni cerebrali in cui la BEE è poco sviluppata (o totalmente assente): quelle in prossimità della “chemoreceptor trigger zone” (CTZ). Trattasi di un’area ricca in recettori, da cui il nome, posizionata nel bulbo del tronco encefalico. Nella CTZ la barriera emato-encefalica manca mentre nelle zone circostanti è maggiormente permeabile e poco selettiva. Un vero e proprio passaggio sicuro per molte tossine, microrganismi e sostanze che normalmente non riescono ad oltrepassarla. Un esempio è dato dal neurotrasmettitore dopamina (Figura 2).
Infine, diversi studi hanno confermato che gli ultrasuoni sono in grado di creare uno spiraglio temporaneo nella BEE, senza frantumare la barriera stessa. Il sistema è molto semplice: somministrazione per via ematica di microbolle di gas per poi indirizzare gli ultrasuoni nelle zone interessate, ad esempio un’area tumorale. La frequenza delle onde innescherà vibrazioni grazie alle quali le microbolle si interporranno tra le cellule endoteliali della BEE, creando un varco. In futuro questa scoperta potrebbe risultare davvero utile, vista la difficoltà di molti farmaci di raggiungere il SNC.
Infezioni del SNC
Il nostro cervello è esposto ad un’infinità di stimoli potenzialmente dannosi ed è soggetto a numerose infezioni. Per questo è ben protetto da eventuali traumi e lesioni dalla scatola cranica e dalle meningi. Inoltre è immerso nel liquor, che funge da ulteriore protezione in grado di attutire gli urti. In aggiunta, a sorveglianza e difesa del SNC dagli agenti infettivi vi è la microglia, l’insieme delle cellule immunitarie del nostro cervello. Infine il tessuto cerebrale è circondato ed isolato dalla barriera emato-encefalica che, per la sua composizione e selettività, non permette la comunicazione diretta del tessuto cerebrale con il flusso sanguigno.
Nonostante ciò durante uno stato infiammatorio nel SNC proprio la BEE subisce un danno anatomo-funzionale: le tight junction delle cellule endoteliali che compongono i vasi sanguigni da cui essa origina si allentano e la capacità di filtraggio dell’endotelio non fenestrato viene meno. Questo porta ad una vera e propria disfunzione dell’intera struttura e ad un aumento di sostanze e microrganismi in ingresso.
Le infezioni cerebrali sono comunque molto rare, ma sempre difficili da trattare. Hanno più che altro origine batterica e virale e più raramente sono causate da funghi, parassiti e protozoi. Non si escludono altre cause, come nel caso delle encefalopatie spongiformi trasmissibili dovute ai prioni.
Batteri e virus penetrano nel SNC tramite il circolo sanguigno, spesso veicolati da macrofagi ( es: T. gondii e HIV), in seguito a traumi oppure risalendo il nervo olfattivo ( è il caso della rabbia e dell’encefalite da Naegleria fowleri). Anche focolai infettivi contigui (es: otite) e difetti congeniti possono essere causa di infezione. I parassiti, invece, tendono a farsi strada irritando il tessuto cerebrale o bloccando il flusso del LCR con le cisti.
Infezioni batteriche
La meningite è l’esempio principe di infezione batterica che interessa il SNC e che determina modificazioni di permeabilità della BEE. Trattasi dell’infiammazione delle meningi, ovvero le tre membrane che rivestono e proteggono l’encefalo ed il midollo spinale (dura madre, aracnoide, pia madre). Può essere di natura non infettiva (neoplastica o da farmaci) oppure causata da virus e batteri. In quest’ultimo caso tra gli agenti patogeni responsabili più frequenti vi sono Streptococcus agalactiae, Staphylococcus pneumoniae, Neisseria meningitidis, Listeria monocytogenes ed Haemophilus influenzae di tipo B.
Il superamento della barriera emato-encefalica è sicuramente favorito dalla presenza di almeno uno di questi fattori:
- carica batterica alta;
- fimbrie;
- capacità di aderire ai monociti;
- endocitosi;
Infezioni virali
L’infezione secondaria da polyomavirus JC nei soggetti immunodepressi è causa di leucoencefalopatia multifocale progressiva (PML). La malattia è caratterizzata da sintomi che peggiorano gradualmente e che culminano in difficoltà cognitive e di movimento (similmente alla sclerosi multipla). Il virus, infatti, una volta riattivato, presenta un certo tropismo per gli oligodendrociti, le cellule nervose deputate alla formazione della guaina mielinica che avvolgono gli assoni dei neuroni del SNC, aumentando così la velocità di propagazione del segnale. La demielinizzazione riduce drasticamente la rapidità conduttoria degli impulsi elettrici lungo la fibra nervosa da cui i segni tipici della malattia.
Anche il virus dell’herpes simplex, allo stesso modo, può provocare una meningoencefalite per riattivazione di un’infezione latente o in seguito ad un’infezione primaria.
È possibile che anche l’HIV possa attraversare e causare danni alla BEE: si parla difatti di encefaliti e demenza da HIV. In entrambi i casi il virus, all’interno dei monociti circolanti attivati, riesce ad oltrepassare la barriera e a diffondersi nel tessuto cerebrale. Le particelle virali risvegliano la microglia dormiente che risponde con un’aggressiva risposta immunitaria. L’infiammazione che ne deriva, per quanto meccanismo di difesa dell’organismo, può portare a gravi danni se violenta o non controllata.
Infezioni da funghi e parassiti
Con l’inalazione di spore di Aspergillus spp si contrae l’aspergillosi, una malattia quasi esclusiva dell’apparato respiratorio. Gli aspergilli sono funghi (muffe) assai diffusi nell’ambiente e una volta nei polmoni riescono, per via ematogena, ad arrivare ad altri organi vitali come il cervello. In questo caso si parla di aspergillosi diffusa invasiva extrapolmonare, tipica di pazienti il cui Sistema Immunitario è già di per sé compromesso.
La forma larvale della Taenia solium, il parassita meglio conosciuto come “verme solitario”, può migrare nel cervello ed infettare il SNC dando origine ad una sintomatologia molto varia: dal mal di testa all’epilessia, dall’ostruzione del flusso del liquor alle alterazioni della coscienza. Si parla di neurocisticercosi: i cisticerchi di T. solium raggiungono il SNC passivamente e si insediano provocando lesioni nella BEE e nelle regioni cerebrali.
Il protozoo Trypanosoma brucei è responsabile invece della Tripanosomiasi africana umana, conosciuta anche come “malattia del sonno”. Nello stadio tardivo i sintomi della malattia sono molto simili a quelli di un’infezione meningoencefalitica e quindi anche in questo caso l’integrità della BEE è compromessa. Uno dei disturbi neurologici tipici della malattia, da cui il nome, è una sonnolenza incontrollabile dovuta al fatto che T. brucei sintetizza naturalmente il tryptophol, una sostanza in grado di indurre il sonno negli esseri umani.
La barriera emato-liquorale
Va distinta dalla barriera emato-encefalica la barriera emato liquorale (BEL), un’ulteriore membrana protettiva che circonda il SNC. La BEL è assai diversa dalla prima barriera ma in ogni caso rappresenta un confine tra sangue periferico/cerebrale e liquido cefalorachidiano.
Date le caratteristiche morfo-funzionali della struttura, formata solo dall’ependima del plesso coroideo ed il tessuto connettivale dell’aracnoide, essa presenta una maggiore permeabilità ed è molto meno selettiva della BEE. Di conseguenza consente più agevolmente il passaggio, dal sangue al liquor, di sostanze idrofile o di grosso peso molecolare, cui solitamente è impedito l’ingresso nel SNC.
Carla Caianiello