L’acetilcolina è una piccola molecola scoperta nel 1914 da un neurologo britannico, di nome Hanry Hallet Dale, il quale è stato insignito del premio Nobel per la medicina per i suoi studi sui neurotrasmettitori. Nel 1921 Otto Loewi studiando il cuore di una rana comprese che la stimolazione del nervo vago determinava il rilascio di una sostanza che determinava bradicardia e riduzione della forza di contrazione muscolare. Questi effetti erano molto simili a quelli che si ottenevano somministrando acetilcolina. Qualche anno più tardi è stato dimostrato che la trasmissione nervosa di alcuni nervi, tra cui il vago ed i nervi motori era mediato dal rilascio di acetilcolina. L’acetilcolina è stata quindi classificata come neurotrasmettitore, ovvero una molecola chimica che permette la trasmissione degli impulsi nervosi. Il sistema di trasmissione nervosa mediata da acetilcolina è chiamata trasmissione colinergica.
Struttura e sintesi
L’acetilcolina è un estere che si forma dalla reazione tra l’acetil-coenzima A e la colina. La colina è un sale d’ammonio quaternario, un nutriente essenziale, denominato anche Vitamina J. La sua assunzione avviene normalmente attraverso la dieta consumando carne, pesce, uova, latticini, verdure e noci. Inoltre la colina è sintetizzata anche dal fegato, attraverso una reazione di metilazione della fosfatidiletanolamina con successiva conversione in fosfatidilcolina, dalla quale è idrolizzata la colina. Il quantitativo di colina prodotto dal fegato, tuttavia non è sufficiente all’organismo, pertanto è fondamentale anche l’assunzione tramite la dieta. L’aceticolina è sintetizzata nei neuroni colinergici grazie all’enzima colina acetil-transferasi. La reazione di sintesi avviene trasferendo il gruppo acetile dell’acetil-coenzima A (prodotto dai mitocondri) alla colina, con formazione di acetilcolina. La molecola è quindi immagazzinata in vescicole che la rilasciano nella sinapsi in seguito a stimolo nervoso, determinando l’attivazione della trasmissione colinergica alle cellule effettrici.
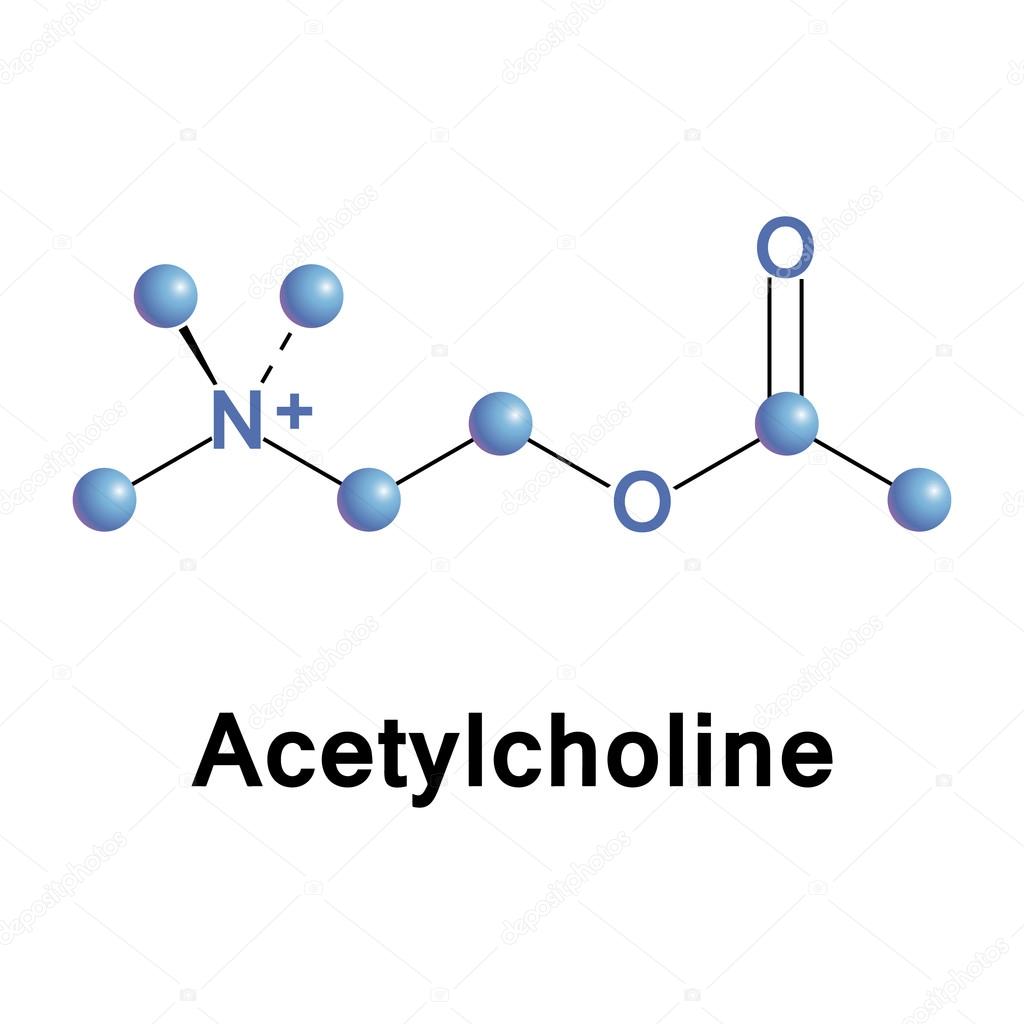
Degradazione
L’acetilcolina, come citato, è un importante neurotrasmettitore del sistema nervoso centrale e periferico. La sua sintesi è accompagnata da un processo di degradazione che permette di mantenerne i livelli in un range fisiologico. Il rilascio dell’acetilcolina nello spazio intersinaptico innesca un meccanismo biochimico che consente l’attivazione del neurone post-sinaptico e la trasmissione del segnale alle cellule effettrici. Dopo aver stimolato ed attivato il neurone postsinaptico, l’acetilcolina è degradata da enzimi chiamati acetilcolinesterasi. Questi enzimi sono espressi principalmente nel sistema nervoso centrale e periferico, ma sono presenti anche in altri distretti in concentrazione più bassa. L’inattivazione avviene per idrolisi e porta a liberazione di colina e acetato. Nel nostro organismo sono presenti anche degli altri enzimi, chiamati butirrilcolinesterasi, che sono in grado di idrolizzare l’acetilcolina allo stesso modo, ma hanno specificità anche per esteri formati da gruppi acilici più lunghi. Le butirrilcolinesterasi sono importanti per esempio nell’inattivazione di alcuni farmaci (succinilcolina).

I neuroni colinergici
Il sistema colinergico è costituito dall’insieme di neuroni che sintetizzano e rilasciano l’acetilcolina. I neuroni colinergici all’interno del sistema nervoso centrale sono distribuiti in diversi distretti, tra cui midollo spinale, striato, lobi frontali, tubercolo olfattivo. Questi neuroni sono anche presenti all’interno di circuiti locali, fungendo da modulatori di altri sistemi prendendo il nome di interneuroni. Il sistema colinergico modula importanti processi cognitivi nel cervello, come l’apprendimento, la memoria, il sonno e la trasmissione sensoriale. Neuroni colinergici sono presenti anche a livello del sistema nervoso periferico, ed in particolare costituiscono i motoneuroni, responsabili del controllo della contrazione della muscolatura scheletrica. Anche il sistema nervoso autonomo funziona attraverso sinapsi colinergiche: il sistema nervoso parasimpatico utilizza acetilcolina nella trasmissione tra la fibra pre-gangliare e quella post-gangliare, oltre alla giunzione tra la fibra post-gangliare e le cellule effettrici. Il sistema nervoso ortosimpatico utilizza acetilcolina nella sinapsi tra la fibra pre-gangliare e la fibra post-gangliare.
Il sistema colinergico non neuronale
Gli enzimi acetilcolinesterasi sono presenti nel nostro organismo anche in distretti non neuronali, infatti cellule come eritrociti, cellule del sistema immunitario, cellule endoteliali ed epiteliali (vie aeree per esempio), placenta e sangue. Le funzioni del sistema colinergico non neuronale sono definite autocrine, e sono ancora oggetto di studio. A livello ematico per esempio è ormai noto che l’acetilcolina induce vasodilatazione, stimolando le cellule endoteliali e gli eritrociti a produrre e rilasciare nitrossido, un importante vasodilatatore, che stimola il rilassamento delle cellule muscolari lisce dei vasi sanguigni. L’acetilcolina sintetizzata nelle cellule del sistema immunitario ha un ruolo nei processi infiammatori. Se sintetizzata dall’epitelio bronchiale è importante per il funzionamento ciliare ed i processi di riparazione della mucosa. Se rilasciata in zone non sinaptiche esercita la sua funzione diffondendo negli spazi extracellulari, anche a grande distanza, attraverso la cosiddetta “trasmissione di volume”.
I recettori dell’acetilcolina
I recettori dell’acetilcolina presenti nel nostro organismo sono di due tipologie: recettori nicotinici e recettori muscarinici. I primi sono di tipo ionotropico, pertanto si tratta di recettori canale, che se stimolati determinano il passaggio di ioni all’interno delle cellule. L’elevata affinità con cui legano la nicotina ne determina il nome. Questi recettori mediano la neurotrasmissione nella giunzione neuromuscolare, nei gangli autonomi periferici, nel sistema uditivo, nell’ippocampo, nel nucleo accumbens, nello striato. I recettori muscarinici sono di tipo metabotropico, pertanto l’attivazione innesca un processo biochimico intracellulare che coinvolge secondi messaggeri. L’elevata affinità con cui legano la muscarina ne determina il nome. I recettori muscarinici sono localizzati sulle cellule effettrici del sistema nervoso autonomo. Tuttavia la loro presenza non è limitata ad aree destinate all’innervazione, ma sono anche espressi per esempio sulle cellule endoteliali. Nel sistema nervoso centrale aree come l’ippocampo, la corteccia ed il talamo sono ricche di questi recettori.
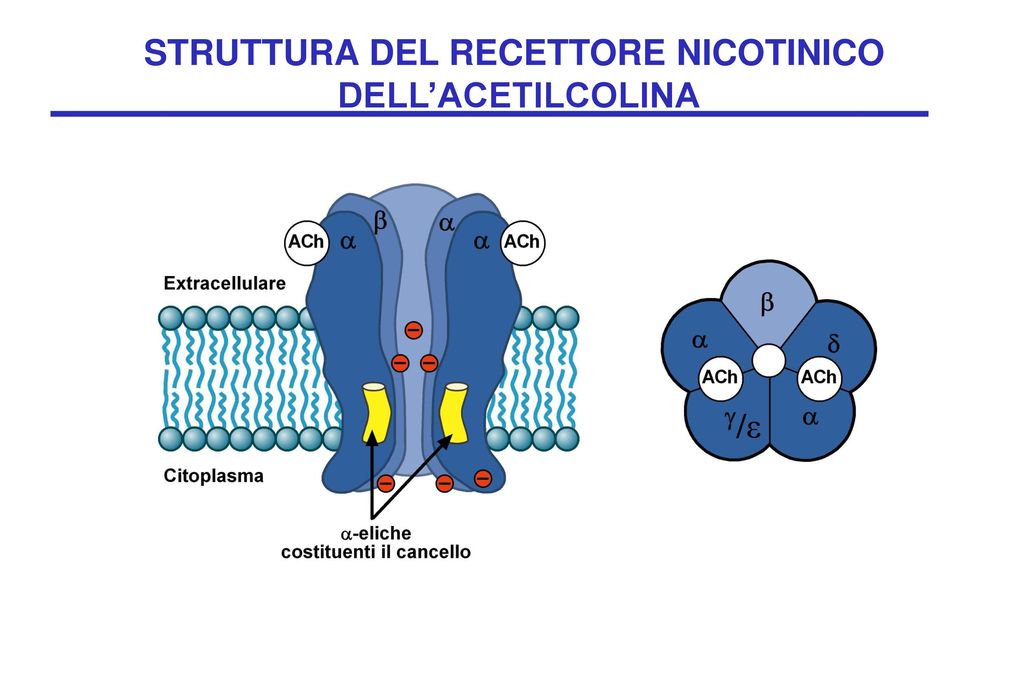
Trasmissione colinergica attraverso recettori nicotinici
I recettori niconitici sono costituiti da diverse subunità (alfa, beta, gamma, delta, epsilon), le quali presentano diverse isoforme. I ricettori di tipo muscolare sono localizzati nella giunzione neuromuscolare e sono fondamentali per la trasmissione di tipo motorio. I ricettori di tipo neuronale sono espressi all’interno dei gangli ed in specifiche aree del cervello. L’attivazione di questi recettori determina correnti ioniche (calcio o sodio) che permettono la depolarizzazione cellulare ed eventualmente la risposta da parte delle cellule effettrici. Mutazioni a carico dei geni che codificano per le varie isoforme delle subunità recettoriali possono portare a patologie di varia natura. Per esempio mutazioni a carico della subunità alfa1 induce una grave patologia, chiamata miastenia gravis. Le diverse subunità dei recettori nicotinici sono modulabili attraverso l’interazione con molecole farmacologiche utilizzabili in caso di particolari scompensi o per indurre rilassamento muscolare.
Trasmissione colinergica attraverso recettori muscarinici
I recettori muscarinici sono suddivisibili in 5 sottotipi, i quali sono localizzati in diversi distretti corporei. La trasmissione muscarinica avviene per mezzo di secondi messaggeri, chiamati G-protein, ed a seconda della tipologia di queste proteine G la trasmissione sarà eccitatoria oppure inibitoria. Il recettore di tipo M1 è localizzato a livello del sistema nervoso centrale, modulando importanti processi cognitivi, ma anche nel sistema nervoso autonomo. Il sottotipo M2 è espresso nel cervello e nel cuore. Il recettore M3 è quello maggiormente diffuso nel nostro organismo e modula importanti processi come la motilità gastrointestinale, la contrazione della muscolatura liscia, la stimolazione secretoria di ghiandole esocrine ed endocrine, la broncocostrizione e molto altro. Il sottotipo M4 agisce nel sistema nervoso centrale e partecipa al controllo della locomozione. Il recettore M5 è espresso prevalentemente nel sistema nervoso centrale.
Avvelenamento da composti organofosforici
L’acetilcolina come descritto precedentemente è metabolizzata a livello sinaptico da enzimi chiamati acetilcolinesterasi. La mancata inattivazione del neurotrasmettitore determinerebbe un’eccessiva stimolazione sinaptica e gravi conseguenze per l’organismo. L’inibizione dell’aceticolinesterasi da parte di alcune molecole farmacologiche e non farmacologiche impedisce l’eliminazione dell’acetilcolina. L’inibizione dell’acetilcolinesterasi può avvenire in diversi distretti dell’enzima, come la tasca acilica, il sito di legame per la colina ed un sito anionico periferico. I composti organofosforici sono in grado di agire sull’acetilcolinesterasi impendendogli di funzionare. In queste condizioni la trasmissione colinergica sarà pertanto prolungata ed incontrollata. Alcuni esempi di queste molecole includono i gas nervini, (tabun, sarin, soman) che sono dei composti utilizzati in diverse guerre determinando numerose vittime. Altri composti organofosforici, come il parathion ed il metilparathion hanno uso tra gli insetticidi, però sono stati vietati appunto per le possibili tossicità acute e croniche che possono scatenare.
Avvelenamento da tossina botulinica
Il microrganismo anaerobio “Clostridium Botulinum” produce delle tossine, definite appunto tossine botuliniche. Queste tossine agiscono a livello della giunzione neuromuscolare bloccando il rilascio di acetilcolina e di conseguenza la contrazione muscolare dei muscoli scheletrici. L’effetto scatenato è definito paralisi flaccida. I bersagli intracellulari di queste tossine sono le proteine SNARE, che hanno la funzione di coadiuvare l’esocitosi delle vescicole contenenti il neurotrasmettiore, l’acetilcolina in questo caso. Le tossine botuliniche sono di vario tipo: A,B,C,D,E,F,G. Si differenziano per il bersaglio proteico che clivano, ma l’effetto rimane il medesimo, ovvero l’inibizione del rilascio di acetilcolina nella giunzione neuromuscolare. L’utilizzo di queste tossine avviene anche per uso medico, per combattere l’eccessiva stimolazione colinergica che affligge pazienti affetti da strabismo, blefarospasmo, piede equino, torcicollo, crampi occupazionali, acalasia esofagea. Sfruttando l’azione delle tossine nel ridurre il rilascio di acetilcolina si ottiene un rilassamento muscolare che contrasta la patologia.
Farmacologia della trasmissione colinergica
I recettori nicotinici possono essere modulati farmacologicamente. I bloccanti neuromuscolari (depolarizzanti e non depolarizzanti) hanno la funzione di inibire la contrazione muscolare della muscolatura scheletrica. L’impiego di questi farmaci avviene per esempio per rilassare la muscolatura tracheale, in modo da facilitare l’intubazione o per il rilassamento muscolare durante un intervento chirurgico. Alcuni esempi di farmaci includono la succinilcolina, il decametonio, che fanno parte della famiglia dei bloccanti neuromuscolari depolarizzanti. I farmaci impiegati per modulare la trasmissione attraverso i recettori muscarinici può essere utile per esempio a livello cardiovascolare. L’acetilcolina determina vasodilatazione, diminuzione della frequenza cardiaca (effetto cronotropo negativo), una riduzione della velocità di conduzione del nodo atrio-ventricolare (effetto dromotropo negativo) ed una diminuzione della forza di contrazione cardiaca (effetto inotropo negativo). Pertanto l’utilizzo di composti antagonisti dei recettori muscarini hanno come scopo la modulazione di questi processi. Il farmaco maggiormente impiegato in questo contesto è l’atropina.
Fonti
- Choline: an essential nutrient for public health – Zeisel S. et al. – DOI: 10.1111/j.1753-4887.2009.00246.x – https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2782876/
- Farmacologia generale e molecolare – Clementi F. et al. – Quinta Edizione
- Le basi farmacologiche della terapia – Goodman & Gilman – Tredicesima edizione
- Structure of neuronal nicotinic receptors – Fasoli F. et al. – DOI: 10.1007/978-3-319-13665-3_1 – https://pubmed.ncbi.nlm.nih.gov/25655885/
- Mammalian nicotinic acetylcholine receptors: from structure to function – Albuquerque et al. – DOI: 10.1152/physrev.00015.2008 – https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2713585/
- Botulinum Toxin in clinical practice – Jankovic J. – DOI: 10.1136/jnnp.2003.034702 – https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1739107/pdf/v075p00951.pdf
- Organophosphorus Nerve Agents: Types, Toxicity, and Treatments – Mukherjee S. et al. – DOI: 10.1155/2020/3007984 – https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7527902/#:~:text=Organophosphorus%20compounds%20(OPCs)%20are%20organic,in%20industrial%20and%20environmental%20applications.
- Cholinergic system and its Therapeutic Importance in Inflammation and Autoimmunity – Halder N. et al. – DOI: 10.3389/fimmu.2021.660342 – https://www.frontiersin.org/journals/immunology/articles/10.3389/fimmu.2021.660342/full
- Neuromodulation and cortical function: modeling the physiological basis of behavior – DOI: 10.1016/0166-4328(94)00113-t – https://pubmed.ncbi.nlm.nih.gov/7748496/