Le cellule staminali precancerose
Nuovi tipi di cellule sembrano essere coinvolte nello sviluppo tumorale: le cellule staminali precancerose. Il termine nasce dal parallelo con la controparte «sana»; le cellule staminali, infatti, sono quelle che danno origine a tutte le cellule di un certo tessuto (es. quelle del midollo). Oltre alla capacità di differenziare in tutti i tipi di cellule presenti in un certo tessuto, le cellule staminali possiedono anche un’altra proprietà: quella di auto rinnovarsi. In altre parole, le cellule staminali possono generare copie di se stesse, che garantiranno per tutta la vita di un individuo una fornitura continua di cellule più differenziate e mature.
Caratteristiche delle cellule staminali precancerose
Quelle precancerose hanno caratteristiche intermedie tra cellule staminali tumorali e cellule staminali normali (Fig.1). Il loro destino finale dipenderà dall’ambiente in cui sono inserite. Un ambiente favorevole alla tumorigenesi determinerà lo sviluppo di queste cellule in cellule staminali tumorali in grado di proliferare praticamente all’infinito e di dare origine ad altre cellule che costituiranno il tumore.
Le cellule staminali precancerose esprimono marcatori quali CD45, CD44 e c-kit, simili alle normali staminali, ma a differenza di queste ultime possiedono numerose alterazioni genetiche (iperdiploidi), sono caratterizzate da instabilità cariotipiche e da diversi cromosomi anormali sub metacentrici e metacentrici, spesso risultanti da traslocazioni robertsoniane.
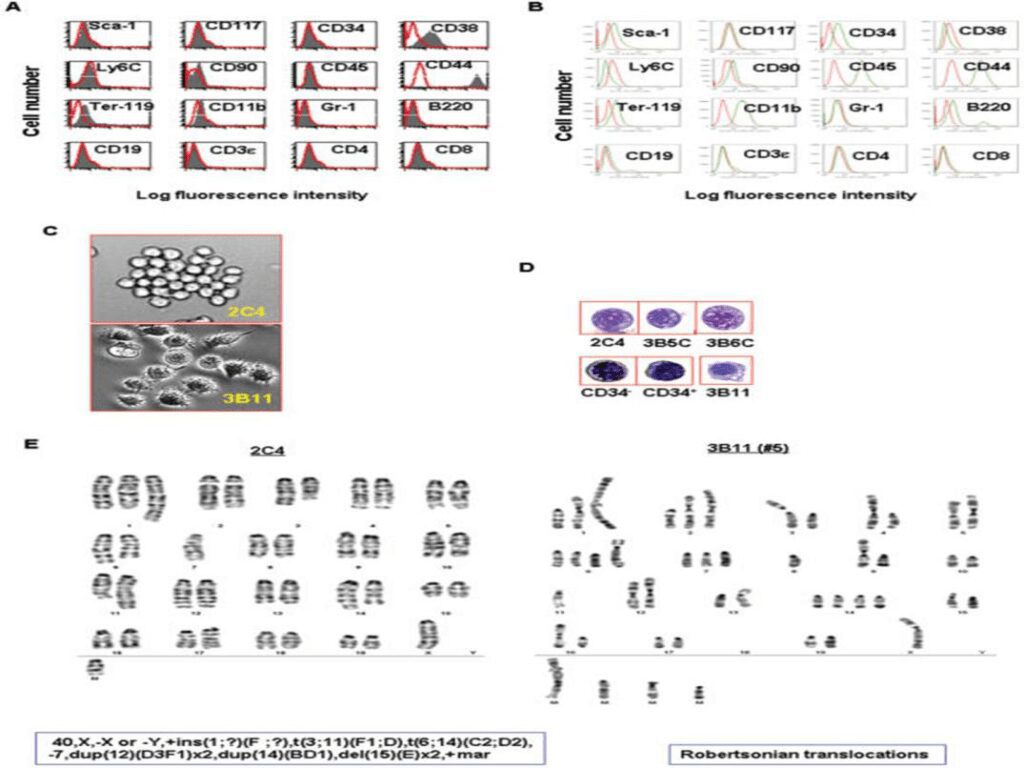
Ruolo dell’ambiente nello sviluppo della neoplasia
Come detto in precedenza, i fattori ambientali ossia l’ambiente cellulare, influenzano la trasformazione delle cellule staminali precancerose in tumore. Studi di laboratorio hanno evidenziato che queste cellule possono dare origine a tumori in topi immunodeficienti ma non in topi immunocompetenti. Ciò può essere dovuto al sistema di sorveglianza immunitario che elimina le cellule staminali precancerose quando iniziano a progredire in cellule staminali cancerose o in cancro.
Si è visto, durante gli esperimenti, che anche la via di somministrazione nei topi delle cellule staminali precancerose influenza il loro destino finale. Sono state scelte la via endovenosa e intraperitoneale: quelle iniettate per via endovenosa avevano dato origine a leucemie e sono state ritrovate anche nella milza, mentre quelle iniettate per via intraperitoneale hanno dato origine a tumori solidi.
Nel loro insieme i risultati suggeriscono alcuni punti importanti per la tumorigenesi delle cellule staminali precancerose; primo, affinchè queste cellule sviluppino un tumore hanno bisogno di un “sostegno” appropriato come per esempio una matrice cellulare di tessuto. Secondo, il sistema immunitario può bloccare l’evoluzione di tali cellule in cancro perché quando iniettate in topi immunocompetenti, non danno origine a tumori. Infine, le cellule staminali precancerose possono rappresentare una fase iniziale di sviluppo di cellule staminali cancerose che possono ulteriormente differenziarsi in cellule maligne o benigne, o rimanere quiescenti.
Cambiamenti genotipici/fenotipici delle cellule staminali precancerose
Per valutare se le cellule staminali precancerose sono in una fase iniziale oncogena si devono osservare i cambiamenti fenotipici e genetici man mano che diventano cancerose. Sembra che il gene PIWIL2 abbia un ruolo nella trasformazione oncogena delle cellule staminali precancerose; esso è espresso nelle cellule staminali germinali del testicolo per la gametogenesi ma non è espresso nelle cellule somatiche adulte e staminali.
Si trova sul cromosoma umano 8 e sul cromosoma 14 di topo e induce la proliferazione delle cellule staminali precancerose attraverso la trascrizione delle proteine quali PL2L, PL2L80, PL2L60, PL2L50. La proteina PL2L60 (RelA/p65) è prevalentemente espressa in vari tipi di tumori umani.
Tale proteina promuove la sopravvivenza e la proliferazione delle cellule tumorali in vitro attraverso l’up-regolazione dei geni Stat3 e Bcl2. Questi, a loro volta, regolano il passaggio del ciclo cellulare dalla fase G0/1 alla fase S e l’espressione nucleare di NF-kB. Le proteine codificate dal gene PIWIL2 contengono domini Piwi e PAZ coinvolti in molteplici funzioni biologiche come l’autorinnovamento delle cellule staminali germinali e il rimodellamento della cromatina.
Nello specifico…
Approfondite indagini hanno rivelato che la tumorigenesi umana è un processo complesso che richiede più fasi. Dato che le cellule staminali sono cellule a lunga vita è possibile che possano accumulare mutazioni che portano alla loro trasformazione maligna e allo sviluppo del tumore. Il destino delle cellule staminali precancerose dipende dagli stimoli ambientali e non è detto che debbano trasformarsi necessariamente in cancro. In alcuni tessuti potrebbero essere responsabili semplicemente di lesioni precancerose reversibili come metaplasia e displasia (ipotesi da verificare).
Inoltre queste cellule geneticamente difettose possono essere soggette a differenziazione DICD (differenziazione morte cellulare indotta) o abortiva, e solo poche di loro sono vive e rilevabili, poiché vanno spontaneamente incontro alla morte a causa dell’elevato numero di alterazioni genetiche. Al contrario, la differenziazione maligna implica una maggiore e incontrollabile sopravvivenza e proliferazione di cellule staminali precancerose, dando origine cosi alle staminali cancerose che svolgono un ruolo critico nello sviluppo, nella progressione, nella metastatizzazione e nella recidiva del tumore.
Metodologie diagnostiche e nuove terapie
Queste cellule sono molto più resistenti alla DICD rispetto alle cellule staminali precancerose e la loro identificazione è un primo passo per comprendere il loro ruolo nella oncogenesi e nella ricerca di marcatori utili per la diagnosi e lo sviluppo di terapie. Le cellule staminali cancerose si pensa siano le cellule meno sensibili alla chemioterapia o radioterapia e sviluppano resistenza ai farmaci.
Ruolo nel carcinoma epatocellulare
Sono probabilmente la fonte di metastasi tumorale e recidiva della malattia. Sembrano essere coinvolte nello sviluppo del carcinoma epatocellulare (HCC). Esso è il tumore maligno più letale e più comune, con una stima di nuovi casi ogni anno che va da 600.000 a 1 milione. L’incidenza continuerà ad aumentare nei prossimi 2-3 decenni, a causa delle numerose infezioni da epatite C (HCV) ed epatite B (HBV). I profondi cambiamenti genetici identificati in HCC includono l’attivazione di proto oncogeni, delezione o mutazione di geni e riattivazione della telomerasi.
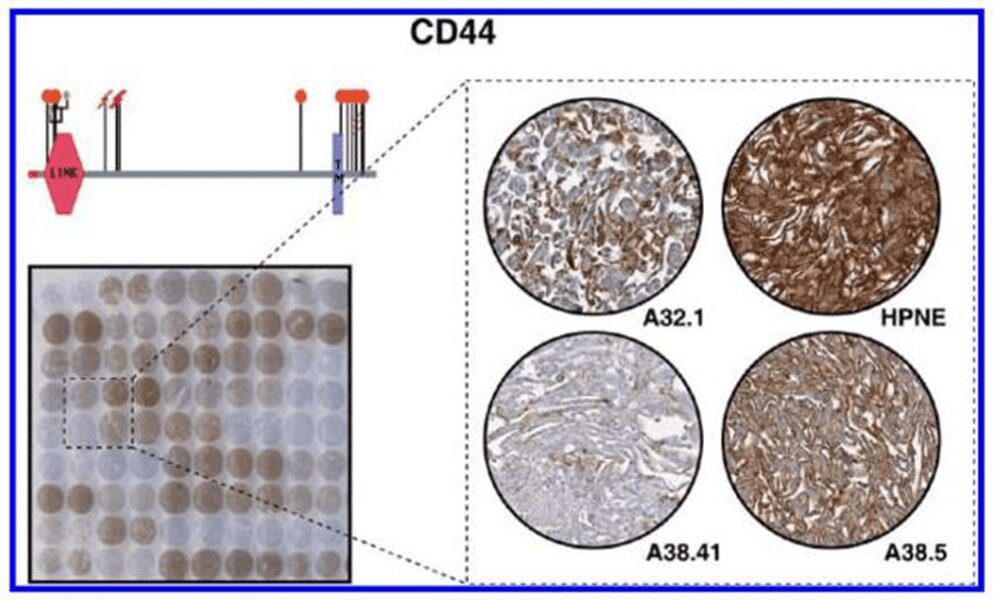
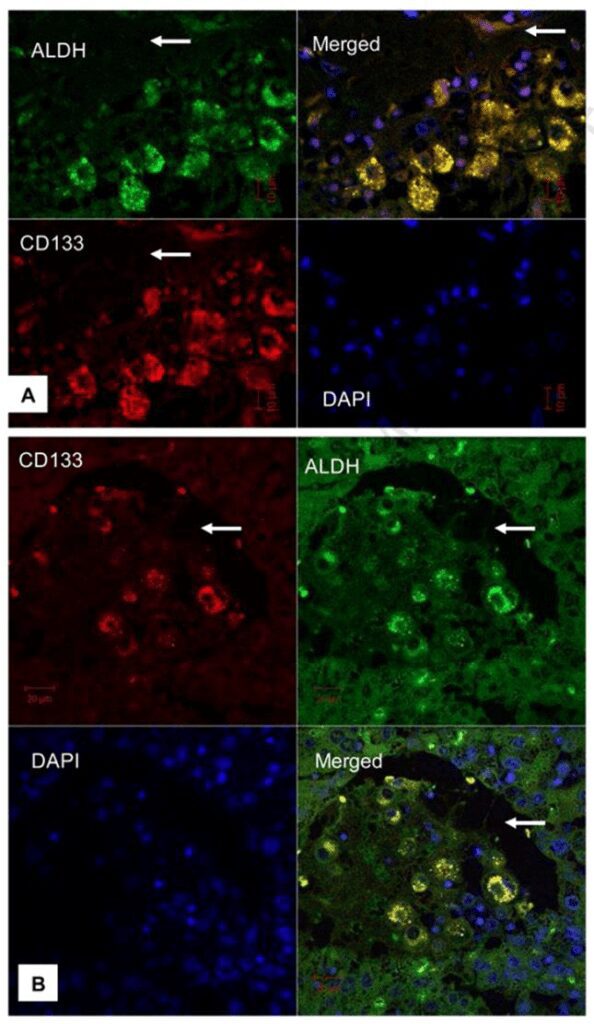
Tuttavia tali cambiamenti genetici non spiegano il quadro completo dello sviluppo del tumore, della progressione, della metastasi e la recidiva e a tal proposito gli studi si sono orientati verso le cellule staminali cancerose. La colorazione immunoistochimica ha messo in evidenza l’espressione, da parte di queste cellule, di determinati tipi di marcatori quali CD44, CD133, CD90 e l’aldeide deidrogenasi (ALDH).
CD44 è una molecola di superficie coinvolta nell’adesione cellula-cellula e nella mediazione in più vie di segnalazione ed è stata utilizzata come marcatore delle cellule staminali cancerose nella leucemia, nel cancro della prostata, pancreas e della mammella.
CD133 è una glicoproteina di superficie cellulare ed è stata utilizzata come marcatore per identificare cellule staminali emopoietiche immature o progenitrici. Inoltre, le cellule del carcinoma epatocellulare positive a questo marcatore sono resistenti alla chemioterapia e possiedono una maggiore capacità di formare tumori.
Il ruolo dell’aldeide deidrogenasi
L’aldeide deidrogenasi (ALDH) è altamente espressa in tessuti embrionali e in cellule staminali adulte isolate dal midollo osseo e dal sangue del cordone ombelicale ed è stata impiegata per identificare le cellule staminali tumorali in vari tipi di tumore. Cellule adulte progenitrici con un’elevata attività di ALDH (Fig. 3) mostrano un elevata capacità proliferativa. CD90 è una glicoproteina ancorata, espressa nel midollo osseo, in cellule staminali mesenchimali ed epatiche; tale proteina è coinvolta nelle interazioni cellula-cellula e matrice-cellula ed è stata identificata nel 90% dei campioni di sangue di pazienti affetti da HCC.
A dimostrazione del fatto che è proprio l’ambiente a segnare il destino delle cellule staminali precancerose, e staminali cancerose dopo, si è visto che i marcatori cellulari sopracitati sono espressi in tessuti infiammati, e quindi potenzialmente tumorigenici. Infatti, tessuti di HCC provenivano da pazienti affetti da HCV e HBV, con o senza fibrosi o cirrosi avanzata; una spiegazione potrebbe essere che le cellule staminali già di per se “difettose”, derivanti dal midollo osseo, possono essere assunte dal fegato infiammato per facilitare la riparazione del tessuto.
Tecniche immunoistochimiche
L’immunoistochimica è diventata una tecnica chiave per valutare l’espressione e la localizzazione subcellulare di questi marcatori di interesse nei tessuti. Essa gioca un ruolo essenziale nelle medicina clinica e nella ricerca di base attraverso i microarrays tissutali (TMAs). Essi sono utili perché possono fornire informazioni diagnostiche su un gran numero di pazienti minimizzando il numero di vetrini da elaborare. Con il metodo TMAs, frammenti di tessuto, prelevati dal paziente, fissati ed inclusi in paraffina, sono utilizzati per allestire un vetrino da colorare con ematossilina-eosina.
Nel dettaglio…
Si ottengono cosi dei “blocchetti” di tessuto (Fig. 2) e con un sistema di “carotaggio”, tramite l’utilizzo di un apposito ago cavo, si ottengono delle piccole carote tissutali che vengono successivamente allineate, secondo una struttura matriciale, in un nuovo blocchetto di paraffina appositamente costruito (blocchetto ricevente o blocco TMA), il quale può contenere centinaia di campioni differenti, posizionati in una sequenza ben definita; si costruisce in questo modo una vera e propria matrice (array) di tessuti. Ogni frammento tissutale è chiaramente identificabile e può essere associato in modo univoco ai relativi dati di tipo patologico e clinico. Con un microtomo sono tagliate poi più sezioni dal blocco TMA, con le quali si allestiscono altrettanti vetrini (da ciascun blocco TMA si possono ottenere e fino a 200/300 sezioni). Terminato l’allestimento dei vetrini, questi vengono analizzati, mediante osservazione microscopica, utilizzando opportune tecniche di valutazione ed indagine (immunoistochimica, immunofluorescenza), a seconda che si voglia andare a studiare la presenza/assenza di una determinata proteina a livello cellulare.
I più recenti progressi
Pertanto sulla base di queste osservazioni sembra che l’eliminazione di queste cellule è essenziale per lo sviluppo di più efficaci trattamenti curativi contro tumori epiteliali aggressivi e ricorrenti. L’uso di combinazioni di farmaci in grado di indurre effetti citotossici sulle cellule staminali precancerose e sulla progenie più differenziata dovrebbe eliminare la massa totale di cellule cancerose e quindi portare ad una guarigione completa senza più recidiva. Diverse terapie normalmente utilizzate per il trattamento dei tumori si basano sull’uso di farmaci anti tumorigenici che sono in grado di eliminare le cellule tumorali.
Tuttavia questi trattamenti in genere sono indirizzati contro l’intera popolazione di cellule tumorali senza fare distinzione tra cellule staminali progenitrici e le loro progenie differenziata ossia le cellule staminali cancerose. Quando si utilizza la combinazione di trattamenti anti-tumorali quali chemioterapia, radioterapia e utilizzo della chirurgia bisogna prendere in considerazione che non sempre sono efficaci nell’eliminare le cellule staminali precancerose progenitrici.
Meccanismi di resistenza
Tale resistenza è dovuta a diversi fattori; esse tendono ad esprimere alti livelli di fattori anti apoptotici come Bcl-2 e le proteine ABC (dall’inglese ATP-binding cassette) ossia una serie di trasportatori di membrana che intervengono nel trasporto di una grande quantità di sostanze attraverso le membrane cellulari, ed una grande quantità di enzimi detossificanti come l’aldeide deidrogenasi.
Questo enzima fa parte di un gruppo di enzimi che hanno un ruolo fondamentale nella detossificazione cellulare, catalizzando l’ossidazione di aldeidi (deidrogenazione) in acidi carbossilici. Quindi esso può contribuire alla detossificazione di una varietà di composti alchilanti chemioterapici e determinare cosi la resistenza al trattamento anti-tumorale; la sua inibizione con piccoli RNA interferenti (siRNA) migliora la sensibilità ai chemioterapici delle cellule staminali del cancro colon rettale positive a marcatori quali CD44. Di interesse terapeutico, è l’uso di cellule staminali geneticamente modificate che possono rilasciare liposomi con all’interno farmaci incapsulati.
Alcuni esempi…
Ad esempio è stato dimostrato che le cellule staminali neurali (NSC) possono essere modificate geneticamente per dare origine a nano particelle in grado di secernere immunoglobuline anti-HER2 (recettore per gli estrogeni), utilizzate per il rilascio selettivo di anticorpi terapeutici diretti contro le cellule del cancro al seno, sia in vitro che in vivo, e inibire la loro crescita. Infine va menzionata anche un’altra scoperta in campo terapeutico che prevede l’utilizzo della melatonina, ormone sintetizzato dalla ghiandola pineale durante la notte. Esso contribuisce alla regolazione dei ritmi biologici, induce il sonno, ha una forte azione antiossidante e sembra contribuire a proteggere l’organismo dal cancro e dalle malattie neurodegenerative.
Numerosi studi hanno dimostrato che la melatonina inibisce la proliferazione delle cellule tumorali mammarie, cellule del cancro della cervice uterina e delle ovaie e la sua azione oncostatica si esplica attraverso la regolazione dell’espressione e dell’attivazione di recettori degli estrogeni attraverso la calmodulina, la modulazione dell’architettura del citoscheletro e della sua funzione e la modulazione dello stato ossidativo intracellulare. È stato osservato che topi esposti alla sostanza cancerogena 7,12-dimetilbenz [α] antracene (DMBA) e sottoposti a restrizioni alimentari (la restrizione alimentare può essere correlata ad un aumento della secrezione di melatonina) non hanno sviluppato adenocarcinoma mammario, mentre topi esposti al DMBA e sottoposti poi ad asportazione della ghiandola pineale, con conseguente non produzione di melatonina, hanno sviluppato il cancro.
Fonti
- Chen L, Shen R, Ye Y, Pu X-A, Liu X, et al (2007) Precancerous Stem Cells Have the Potential for both Benign and Malignant Differentiation. PLoS ONE 2(3): e293. doi:10.1371/journal.pone.0000293
- Lara Rossi, 19 settembre 2012 , Cellule staminali tumorali: viaggio all’origine della malattia. Zanichelli aula di scienze
- Clarke MF, Dick JE, Dirks PB, Eaves CJ, Jamieson CH, et al. Cancer Stem Cells–Perspectives on Current Status and Future Directions: Aacr Workshop on Cancer Stem Cells. Cancer Res.2006;66:9339–44
- Lee JH, Schutte D, Wulf G, Fuzesi L, Radzun HJ, et al. Stem-Cell Protein Piwil2 Is Widely Expressed in Tumors and Inhibits Apoptosis through Activation of Stat3/Bcl-Xl Pathway. Hum Mol Genet.2006;15:201–11
- Singh SK, Hawkins C, Clarke ID, Squire JA, Bayani J, et al. Identification of Human Brain Tumour Initiating Cells. Nature. 2004;432:396–401
- Stingl J, Eirew P, Ricketson I, Shackleton M, Vaillant F, et al. Purification and Unique Properties of Mammary Epithelial Stem Cells. Nature. 2006;439:993–7
- Abraham BK, Fritz P, McClellan M, Hauptvogel P, Athelogou M, Brauch H. Prevalence of CD44+/CD24−/low cells in breast cancer may not be associated with clinical outcome but may favor distant metastasis. Clin. Cancer Res. 2005;11:1154–1159
- Aravalli RN, et al. Molecular mechanisms of hepatocellular carcinoma. Hepatology.2008;48:2047–2063
- Wilentz RE, Rahman A, Argani P, Iacobuzio-Donahue C. Immunohistochemistry and in situ hybridization in pancreatic neoplasia. Methods Mol. Med. 2005;103:67–88
- Levenson VV. Biomarkers for early detection of breast cancer: What, when, and where? Biochim Biophys Acta. 2007;1770:847–856