Vibrio fischeri fu isolato per la prima volta nel 1889 dal microbiologo Bernhard Fischer. Da uno studio del 2007 pubblicato sulla rivista “International Journal of Systematic and Evolutionary Microbiology” è emerso dall’analisi di alcuni geni di V. fischeri, che questi presentassero dei tratti distinti dalla famiglia Vibrionaceae; così è stato inserito un nuovo genere Aliivibrio. Ciononostante all’interno dell’articolo non terremo conto della nuova classificazione tassonomica.

Caratteristiche
Vibrio. fischeri è un batterio Gram – eterotrofo, ha una forma a bastoncello ed è dotato di motilità. La sua diffusione è ubiquitaria, difficilmente in natura si trova allo stato planctonico ma generalmente vive in simbiosi con pesci e piccoli cefalopodi.
Filogenesi
| Dominio | Prokaryota |
| Regno | Bacteria |
| Phylum | Proteobacteria |
| Classe | Proteobacteria Gamma |
| Ordine | Vibrionales |
| Famiglia | Vibrionaceae |
| Genere | Vibrio (Aliivibrio) |
| Specie | V. fischeri (A. fischeri) |
Morfologia delle colonie
V. fischeri è un batterio che crescere in terreni sia solidi sia liquidi. I terreni più utilizzati per la coltivazione di questo batterio sono:
- Marine Agar 2216,
- Marine Broth 2216.
Inoltre è possibile identificare V. fischeri tramite l’uso della PCR.
Patogenesi
V. fischeri non è un batterio patogeno né per l’uomo né per gli animali. Tuttavia dal suo studio si è compreso molto sul modo di comunicare tra i batteri e come questi siano in grado di rispondere come gruppo a particolari stimoli ambientali.
Bioluminescenza
Molte specie batteriche hanno la capacità di emettere luce in una specifica lunghezza d’onda e tale processo è noto con il nome di bioluminescenza. Molti di questi batteri appartengono al genere Photobacterium, Aliivibrio e Vibrio, vivono nell’ambiente marino e difficilmente si trovano allo stato planctonico. La simbiosi permette al batterio di ricevere nutrizione e protezione mentre l’animale sfrutta la bioluminescenza per la predazione, l’accoppiamento o per sfuggire ai predatori. Il calamaro delle Hawaii, Euprymna scolopes, rappresenta l’esempio più noto di simbiosi tra un batterio bioluminescente, V. fischeri e un cefalopode. Il batterio vive all’interno di alcuni organi chiamati sacculi presenti nel mantello dove raggiunge un elevata concentrazione e tramite un processo di controilluminazione, il calamaro riesce a sfuggire ai predatori. (Figura 2)

John Woodland Hastings (1927 – 2014) ottenne risultati importanti sulla bioluminescenza nei batteri, identificò il substrato utilizzato dalla luciferasi batterica, un flavin mononucleotide (FMNH2). L’ossidazione del substrato e dell’aldeide satura a catena lunga permette l’emissione di luce nella lunghezza d’onda del blu-verde. Hastings e gli altri due suoi colleghi osservarono che il fenomeno si manifestava durante la fase esponenziale di crescita in modo ritardato, quindi l’emissione di luce era correlata alla densità cellulare delle colture. Inoltre riuscirono a comprendere che la regolazione avveniva a livello trascrizionale tramite la somministrazione di un’inibitore della trascrizione. (Figura 3)

Utilizzarono come inibitore trascrizionale la rifampina, compresero così che la molecola che induceva la bioluminescenza era prodotta dal batterio stesso e che questa fosse diffusibile all’interno della coltura. Un altro fattore fondamentale era la concentrazione dell’autoinduttore all’interno della coltura che oltre una certa soglia innescava il fenomeno della bioluminescenza, tale meccanismo è conosciuto con il nome di quorum sensing.
Quorum sensing
Il meccanismo adottato dai batteri nel secernere, percepire e rispondere a delle molecole definite autoinduttori, questo tipo di meccanismo comunicativo intracellulare viene definito quorum sensing. Il nome del fenomeno ci anticipa parte del funzionamento del meccanismo: quando si raggiunge una determinata densità cellulare e una certa soglia di concentrazione dell’autoinduttore questo permette l’azione coordinata di una popolazione batterica. La regolazione genetica del fenomeno della bioluminescenza in V. fischeri è regolata dall’operone Lux.
L’operone Lux in Vibrio fischeri
Tra i geni principali che contribuiscono al fenomeno della bioluminescenza c’è il gene Lux I che codifica per l’autoinduttore 3-ossoesanoil-omoserin-lattone. L’autoinduttore viene prodotto a livelli basali all’interno del batterio tuttavia ad una bassa concentrazione non innesca la bioluminescenza, affinché si manifesti è necessario che la densità cellulare aumenti. Quando la molecola raggiunge una determinata concentrazione si ha l’attivazione del fattore di trascrizione Lux R che viene codificato dall’omonimo gene. Il fattore di trascrizione si lega al lux box che attiva la trascrizione dei due operoni divergenti; la trascrizione ha un effetto a feedback positivo. Oltre a questi geni è presente il gene Lux CDABE che codifica per l’enzima della luciferasi che tramite l’ossidazione della flavin-mononucleotide produce il fenomeno della bioluminescenza. (Figura 4)
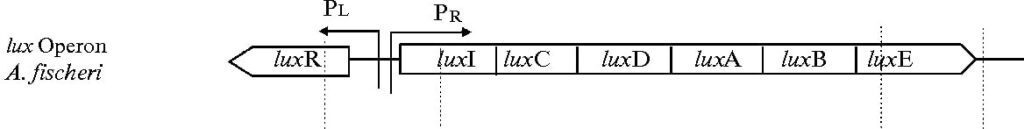
Gli altri sistemi di quorum sensing in V. fischeri
Quello descritto precedentemente è solo uno dei principali sistemi di quorum sensing tuttavia sono presenti altri due sistemi che coadiuvano all’espressione di altri auto-induttori per permettere il fenomeno della bioluminescenza. Il secondo sistema di quorum sensing si basa sui geni ainS che codifica per C8-HSL (N-ottanoil-omoserina lattone) e il gene ainR che codifica per il recettore istidina-chinasi capace di rilevarlo ed indurre una risposta. N-ottanoil-omoserina lattone ha la capacità di aumentare il fattore di trascrizione LuxR. Oltre al secondo sistema ne è presente un terzo che interagisce con il secondo. Il recettore del terzo sistema presenta come recettori LuxQ/P che rispondono all’autoinduttore furanosil-borato-diestere, queste si autofosforilano e donano il fosfato a delle fosfotrasferasi Lux U e Lux O. Quest’ultimo fosforilato induce l’espressione di qrr (smallRNA) che a propria volta inibisce la traduzione dell’ mRNA di litr inibendo la trascrizione di Lux R e inibendo così la bioluminescenza.
Fonti
- “Reclassification of Vibrio fischeri, Vibrio logei, Vibrio salmonicida and Vibrio wodanis as Aliivibrio fischeri gen. nov., comb. nov., Aliivibrio logei comb.nov., Aliivibrio salmonicida comb. nov. and Aliivibrio wodanis comb. nov.” Henryk Urbanczyk, Jennifer C. Ast, Melissa J. Higgins, Jeremy Carson and Paul V. Dunlap. International Journal of Systematic and Evolutionary Microbiology (2007), 57, 2823–2829
- “Cellular Control of the Synthesis and Activity of the Bacterial Luminescent System.” Kenneth H. Nealson, Terry Platt, and J. Woodland Hastings. Journal of Bacteriology, October 1970, p. 313-322
- “Detection and Quantification of Vibrio fischeri Autoinducer from Symbiotic Squid Light Organs.” Katherine J. Boettcher and Edward G. Ruby Journal of Bacteriology, Feb. 1995, p. 1053–1058
- “Modulation of Luminescence Operon Expression by N-Octanoyl-L-Homoserine Lactone in ainS Mutants of Vibrio fischeri” Alan Kuo, Sean M. Callahan, and Paul V. Dunlap. Journal of Bacteriology, Feb. 1996, p. 971–976
- “Bacterial bioluminescence: Isolation and genetic analysis of functions from Vibrio fischeri” Joanne Engebrecht, Kenneth Nealson, Michael Silverman. Volume 32, Issue 3, P773-781, March 01, 1983
- “Cell density-dependent modulation of the Vibrio fischeri luminescence system in the absence of autoinducer and LuxR protein.” P V Dunlap and A Kuo. J Bacteriol. 1992 Apr; 174(8): 2440–2448.
- “Aliivibrio logei KCh1 (Kamchatka isolate): Biochemical and bioluminescence characteristics and cloning of the lux operon” S. A. Khrulnova, I. V. Manukhov, A. P. Zarubina & G. B. Zavilgelsky. Microbiology volume 79, pages349–355(2010)
Fonti immagini
- https://de.wikipedia.org/wiki/Bernhard_Fischer_(Mediziner)
- https://featuredcreature.com/hawaiian-bobtail-squid-and-its-crazy/
- https://en.wikipedia.org/wiki/John_Woodland_Hastings
Ismael Sanchez Polanco