Caratteristiche
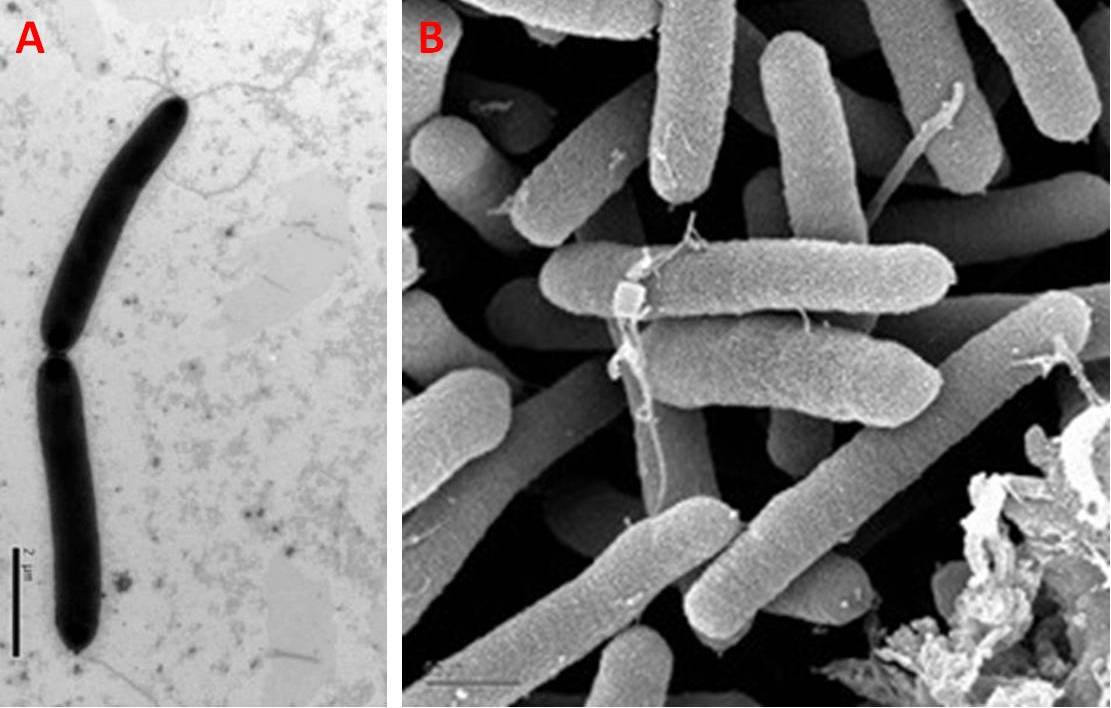
Pseudomonas syringae è un batterio Gram-negativo di forma bastoncellare (Fig. 1), ossidasi negativo, dotato di flagelli polari, e raffigura un patogeno delle piante. Il nome della specie deriva dalla pianta da cui venne isolato per la prima volta, ovvero Syringa vulgaris (lillà comune).
Secondo delle analisi filogenetiche e genomiche comparative di 494 genomi provenienti dai batteri del genere Pseudomonas, P. syringae appartiene a un ampio gruppo evolutivo che comprende molteplici pathovars (pv), ovvero ceppi aventi proprietà uguali o simili, differenziati da altri ceppi della stessa specie o sottospecie sulla base della patogenicità distintiva di uno o più ospiti di piante. Per citarne alcuni, abbiamo P. syringae pv. aceris (che attacca l’acero), P. syringae pv. actinidiae (patogeno del kiwi), P. syringae pv. aesculi (che infetta il castagno) P. syringae pv. aptata (che contamina la barbabietola) P. syringae pv. atrofaciens (che ha come tropismo il grano), P. syringae pv. japonica (infettivo per l’orzo), P. syringae pv. syringae (che attacca il pruno, il lillà e le leguminose).
P. syringae forma polimeri di levano, un carboidrato composto da ripetizioni di unità di fruttosio, e produce le proteine di nucleazione del ghiaccio (INA, codificate dal gene p153), che inducono la cristallizzazione dell’acqua in ghiaccio, con conseguente danneggiamento delle piante infette legato alla perforazione delle cellule. Inoltre, un cospicuo numero di ceppi sintetizza la siringomicina E, una molecola formata da un anello di nove amminoacidi attaccati a una coda di acidi grassi (lipodepsipeptide) (Fig. 2). Questa molecola è dotata di attività fitotossica, antibatterica e antifungina, il cui bersaglio primario è la membrana cellulare, su cui genera dei canali ionici.
Le patologie provocate da questo batterio sono favorite soprattutto dalla frescura (la temperatura ottimale è 12-25° C) e dall’umidità, che facilitano la proliferazione e la diffusione, anche se le condizioni idonee possono variare in base al pathovar. P. syringae risiede sulla superficie o all’interno dei semi e si propaga tra le piante mediante la pioggia, le api, gli insetti, gli uccelli e le pratiche colturali. Malgrado sia un patogeno vegetale, in circostanze svantaggiose può vivere come un saprofita nella fillosfera (superficie della pianta che rappresenta l’habitat dei microorganismi).

La prima segnalazione di P. syringae pv. actinidiae, su cui ci focalizzeremo maggiormente, risale al 1989, in Giappone, e riguarda le piante di Actidinia deliciosa (kiwi); tra l’altro, il microorganismo è stato ritrovato in Turchia e in alcuni stati europei (Francia, Spagna, Portogallo e Svizzera). Nel 1992 si verificarono i primi casi di cancro dell’Actidinia (la malattia provocata dal batterio) in Veneto ed Emilia-Romagna, e dal 2007 l’infezione si è diffusa in altre regione come Lazio, Calabria, Campania, Friuli e Piemonte, e riguarda le piante di A. chinensis (kiwi a polpa gialla) e A. deliciosa. Dal 2012 la patologia è localizzata nella provincia di Mantova, in Lombardia.
Filogenesi
Dominio Prokaryota
Regno Bacteria
Phylum Proteobacteria
Classe Gammaproteobacteria
Ordine Pseudomonadales
Famiglia Pseudomonadaceae
Genere Pseudomonas
Specie P. syringae
Uno sguardo al ruolo del batterio negli ecosistemi
Oltre ad essere causa di fitopatologie, P. syringae ha un impatto notevole sul tempo atmosferico e sugli ecosistemi, e tale proprietà è connessa alla sua capacità di proliferare in una vasta gamma di ambienti come chiome di piante, nuvole, neve, pioggia, rifiuti vegetali, laghi, oceani, fiumi e biofilm associati a piante selvatiche e coltivate. In aggiunta a ciò, raffigura il microorganismo che contribuisce maggiormente alla bioprecipitazione, e la sua attività di catalizzare il congelamento dell’acqua a temperature calde ha suscitato interesse nel suo ruolo nel ciclo dell’acqua.
La parola “bioprecipitazione” indica la precipitazione indotta dai batteri, e tale processo può essere spiegato in poche fasi nel ciclo idrologico (Fig. 3); nella prima fase i microorganismi come P. syringae si disperdono nell’atmosfera e sono pronti per agire sul vapore acqueo e sui germi cristallini (microparticelle che partecipano alla genesi dei cristalli di ghiaccio nell’atmosfera). Nella seconda fase i batteri provvedono alla nucleazione del ghiaccio grazie all’intervento di proteine specifiche (INA), con conseguente formazione delle nuvole e condensazione del vapore acqueo. Nella terza fase le nuvole diventano troppo pesanti e la gravità induce la caduta di pioggia, neve e altre forme di precipitazione sulla superficie terrestre. Questo ciclo prosegue e potenzialmente può avere una maggiore influenza sulla creazione delle nuvole e sugli andamenti climatici. Ciò è fondamentale perché gli organismi come i batteri che sono in grado di guidare gli schemi di precipitazione di diverse zone possono essere essenziali per prevedere gli andamenti del tempo. Inoltre, questo processo permette di approfondire la nostra comprensione del ciclo idrologico e il modo in cui esso condiziona gli ecosistemi in base alla composizione della comunità microbica. P. syringae influisce sull’ambiente e sul tempo atmosferico di una specifica area grazie alla sua importanza nella bioprecipitazione.
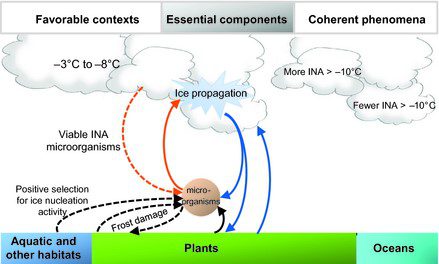
Si pensa che P. syringae abbia due funzioni considerevoli nella formazione delle nuvole che influenzano la bioprecipitazione. La prima è collegata all’attività di nucleazione del ghiaccio a temperature calde, la seconda riguarda il fatto che il batterio promuove il congelamento del vapore acqueo a una portata abbastanza grande da consentire alla gravità di agire sulle gocce presenti nelle nuvole. Ciò causa la precipitazione sotto forma di pioggia o neve. Tutto questo è rilevante perché molte precipitazioni che provengono dalle altitudini medio-alte sono il risultato di questo processo di congelamento delle gocce d’acqua, che si verifica attraverso la nucleazione dei minerali o della vita microbica (come P. syringae) collocati nelle nuvole.
La scoperta del ruolo di P. syringae nella bioprecipitazione risale al 1970 grazie a David Sands, il quale constatò che gli stessi batteri del genere Pseudomonas, responsabili del danno da congelamento nelle piante, si trovavano anche nelle precipitazioni di quell’area. Nonostante sia chiaro come questi batteri cooperano alla bioprecipitazione, l’impatto che P. syringae ha sull’ambiente e sul clima su una scala globale è ancora oggetto di dibattito.
All’inizio di questa sezione abbiamo elencato il consistente numero di ambienti in cui si trova P. syringae, e tale peculiarità è significativa dal momento che quei luoghi sono caratterizzati da un alto contenuto di acqua e vapore acqueo. Pertanto, P. syringae è assai importante per il riciclo dell’acqua in molti ecosistemi differenti, e ciò è dovuto alle sue abilità di nucleazione. C’è da dire che questo batterio ha la capacità di cambiare la quantità di precipitazioni in un determinato ecosistema, limitando la diversità delle piante in base al livello di tolleranza acquatica di una data specie vegetale. Una minore concentrazione di P. syringae nell’atmosfera comporta un aumento del vapore acqueo, poiché non subisce il processo di condensazione e congelamento che possono potenzialmente risultare in precipitazione dalle nuvole. Entrambi questi fattori possono controllare la diversità degli ecosistemi che dipendono da P. syringae, al fine di guidare una porzione sostanziosa del loro ciclo idrologico regionale. Tale diversità dinamica non influisce solo sulle specie di piante, bensì anche sulle specie animali con livelli trofici più alti che dipendono da queste piante per l’energia.
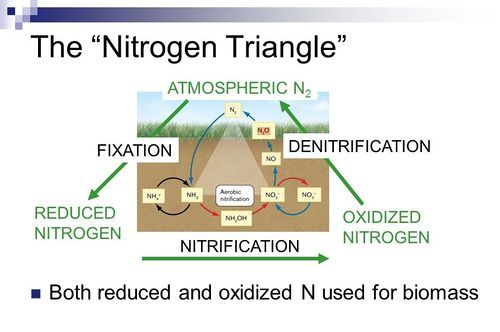
Gli effetti ecologici dell’influenza da parte di P. syringae sul ciclo dell’acqua possono diffondersi in altri cicli naturali importanti, come nel ciclo dell’azoto (Fig. 4), che si compone di tre fasi: fissazione dell’azoto atmosferico (N₂) nel terreno sotto forma ione ammonio (NH₄), trasformazione dell’NH₄ in ione nitrito (NO⁻₂) e ione nitrato (NO⁻₃) (nitrificazione), e riconversione dello NO⁻₃ in N₂ (denitrificazione). Elevate concentrazioni di P. syringae possono velocizzare la fase di nitrificazione e rallentare quella di denitrificazione, e ciò è riconducibile al fatto che l’alta quantità del batterio nell’atmosfera può indurre un incremento delle precipitazioni in seguito alla nucleazione del ghiaccio. Di conseguenza si ha l’innalzamento della quantità di deflusso dell’azoto nei sistemi idrici locali (fiumi, laghi, torrenti), proveniente dai fertilizzanti agricoli (urea, nitrato di calcio, nitrato di sodio, fosfato di ammonio, solfato di ammonio). In questo modo si verifica la crescita dei livelli di intermedi reattivi dell’azoto in questi sistemi idrici; tale evento non impatta solamente sul ciclo dell’azoto, ma anche sugli organismi che vivono in questi laghi e torrenti.
Morfologia delle colonie
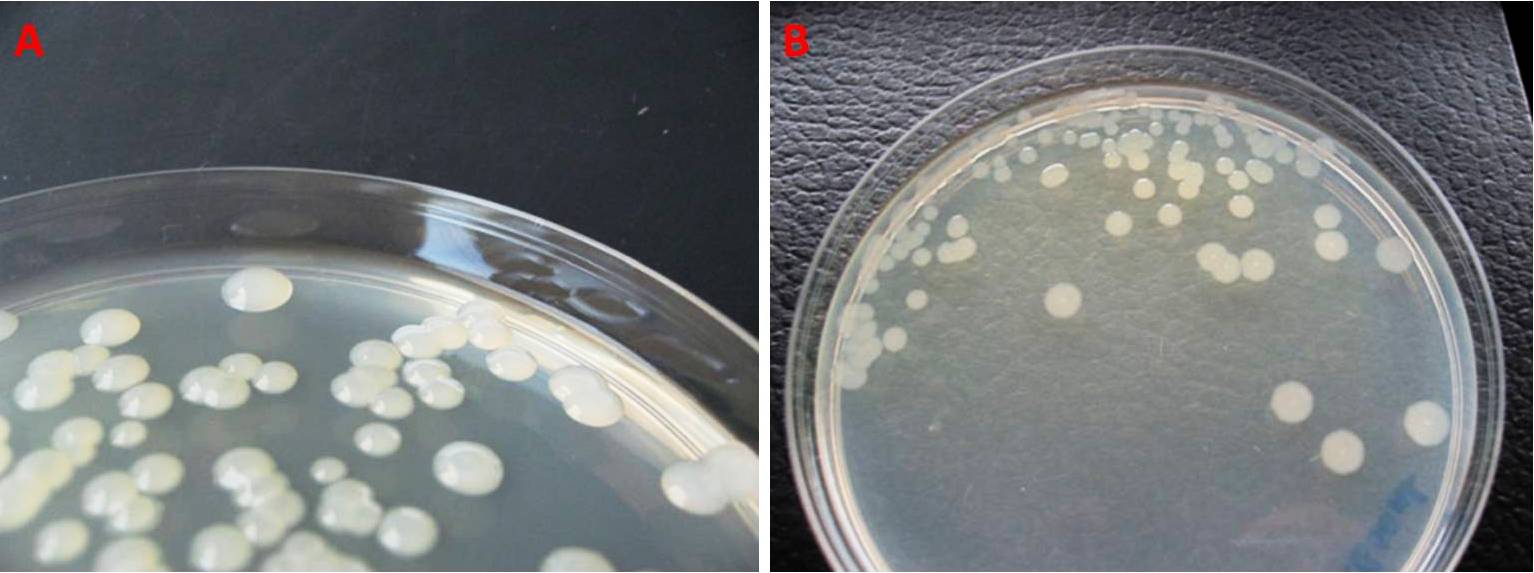
Sul Nutrient-Sucrose Agar (NSA, un terreno semiselettivo contenente saccarosio, cristalvioletto e cicloesimide) P. syringae crea delle colonie lisce, rialzate o convesse, rotonde e di colore bianco perlaceo (Fig. 5A). Quelle fresche appaiono lucide, per poi acquisire un pallido colore avorio.
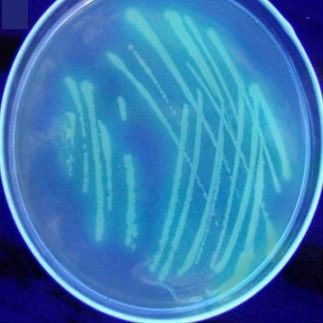
Sul King’s B Medium (formato da peptone, glicerolo, potassio idrogeno fosfato bibasico e magnesio solfato eptaidrato) integrato con antibiotici, invece, si sviluppano delle colonie levigate, piatte, dai contorni lobati, un pigmento intermedio tra bianco perlaceo e giallastro, e un diametro di 4-5 mm (Fig. 5B). Alcuni pathovars (come P. syringae pv. phaseolicola) producono un sideroforo fluorescente, la pioverdina, che può essere evidenziato ai raggi ultravioletti (UV) (Fig. 6).
Patogenesi
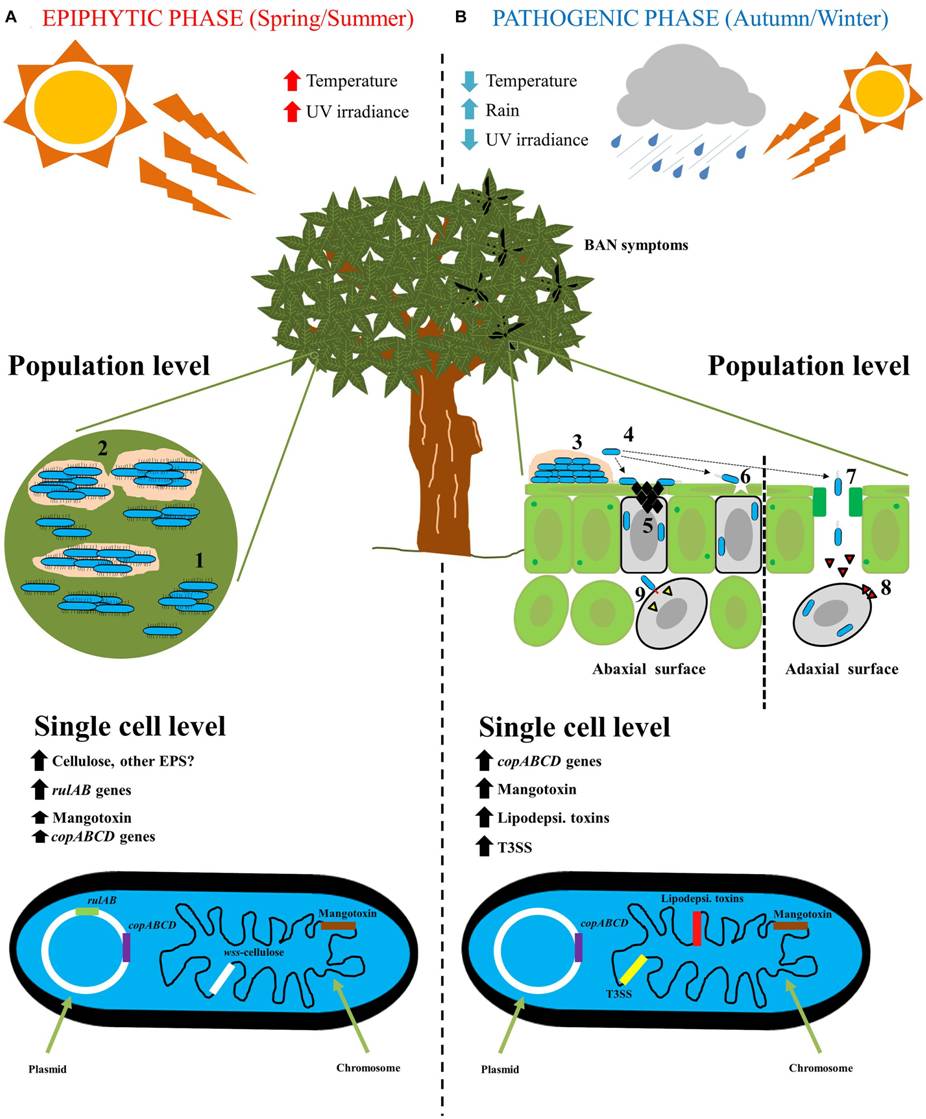
P. syringae può trascorrere l’inverno sia sui tessuti delle piante infette, per esempio aree di necrosi o gommosi (la linfa che fuoriesce da ferite o tumuli), sia su tessuti di piante all’apparenza in salute. In primavera l’acqua piovana, o quella proveniente da altre fonti, spinge il microorganismo sulle foglie o sui boccioli dove prolifera e sopravvive per l’intera estate. Questa raffigura la fase epifita del ciclo biologico del batterio, il quale si moltiplica e si propaga senza provocare alcun danno. La malattia comincia nel momento in cui P. syringae penetra negli stomi di una foglia o nelle macchie necrotiche presenti sulle foglie e sui tessuti legnosi. A questo punto il patogeno ha la possibilità di sfruttare gli spazi intercellulari come sito di crescita inducendo la formazione delle chiazze e dei tumori. Il batterio riesce a tollerare temperature leggermente al di sotto del gelo, che incrementano la gravità dell’infezione in alberi come il pesco, l’albicocco e l’amareno.
P. syringae attua specifici meccanismi di patogenicità che possiamo suddividere in quattro categorie:
- Capacità di invadere le piante attraverso l’utilizzo dei pili e dei flagelli, che permettono al batterio di scivolare verso una pianta bersaglio. Considerando che P. syringae non è in grado di rompere le pareti cellulari della pianta, entra attraverso le ferite. In questa fase di ingresso la mosca Scaptomyza flava rappresenta un valido aiuto per il batterio, in quanto crea dei buchi nelle foglie durante la deposizione delle uova;
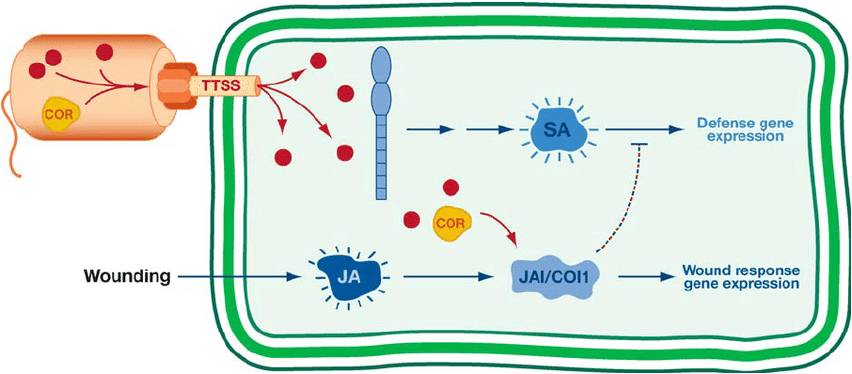
- Superare la resistenza dell’organismo ospite mediante dei fattori di virulenza chiamati proteine effettrici del sistema di secrezione di tipo III (T3SS), le quali manipolano la risposta immunitaria dell’ospite allo scopo di facilitare l’infezione. La principale famiglia di proteine effettrici T3SS è il cluster genico hrp, codificante per l’apparato di secrezione Hrp (hypersensitive response and pathogenicity effector proteins). Queste vengono secrete nel citoplasma delle cellule vegetali per i seguenti scopi: 1) Interferire con l’immunità stimolata dai pattern molecolari associati ai patogeni (PAMPs); 2) Produrre fitormoni e/o fitotossine che servono per sopprimono le risposte difensive della pianta. Una di queste è la coronatina, implicata nella riapertura degli stomi in seguito alla loro chiusura in risposta ai PAMPs e nel contrastare le reazioni mediate dall’acido salicilico dopo l’inizio dell’infezione (Fig. 7); 3) Rilasciare polisaccaridi extracellulari al fine di impedire l’accesso di antibiotici e legare il calcio; 4) Attivare una pompa di efflusso multiresistenza ai farmaci, che consente di espellere i composti antimicrobici permettendo una colonizzazione efficace;
- Sintesi di polisaccaridi che conducono alla genesi del biofilm (uno substrato mucopolisaccaridico), essenziale al patogeno per aderire alla superficie delle cellule vegetali. In aggiunta a ciò, P. syringae produce delle molecole di comunicazione (quorum sensing) attraverso le quali percepisce la presenza di altre cellule batteriche nelle vicinanze. Se queste molecole superano un livello soglia, i batteri cambiano il loro schema di espressione genica per creare il biofilm ed iniziano ad esprimere geni codificanti per fattori di virulenza. Tra l’altro, secernono dei composti altamente viscosi come polisaccaridi e DNA per plasmare un ambiente protettivo in cui moltiplicarsi;
- Proprietà di nucleazione del ghiaccio (di cui avevamo già discusso in precedenza) grazie all’espressione di peculiari proteine (INA). Queste, dopo essere state sintetizzate, traslocano sulla membrana esterna del batterio, che le adopera per determinare i danni da congelamento nelle piante. Tali danneggiamenti riguardano gli epiteli, e rendono disponibili ai batteri i nutrienti presenti nei tessuti sottostanti della pianta. P. syringae può indurre il congelamento dell’acqua a temperature di -1,8° C, anche se sono più frequenti i ceppi che effettuano questo processo a temperature più basse (al di sotto di -8° C).
La figura 8 fornisce un riassunto del ciclo biologico di P. syringae.
Per concludere questa parte, descriviamo una malattia causata da P. syringae pv. actidiniae, ovvero il cancro batterico dell’Actidinia, che colpisce diverse specie di questa pianta, tra cui A. deliciosa, A. chinensis, A. arguta e A. kolomikta. Il microorganismo invade la pianta introducendosi nei sistemi vascolari; dal floema (tessuto che trascina ormoni e zuccheri derivati dalla fotosintesi) si addentra nel cambio e infine raggiunge lo xilema (tessuto responsabile del trasporto di acqua e sali minerali). Da qui riesce ad arrivare alle radici e arrecare danni a tutti gli organi vegetativi della pianta comportando gravi ripercussioni economiche legate alla qualità scadente dei frutti, alla riduzione della produzione e alla commercializzazione fallita. I sintomi tipici della patologia sono i seguenti:
- Alterazione dei fiori e dei boccioli che acquisiscono un colore bruno o nero, e la conseguente caduta prematura (Fig. 9);
- Comparsa sulle foglie di zone di necrosi marroni scuro, dai contorni irregolari e circondate da un alone giallo (Fig. 10);
- Generazione di cancri sul tronco e sui rami con rilascio di una cospicua quantità di essudato che all’inizio è biancastro e in seguito diventa color ruggine (Fig. 11);
- Collasso e appassimento dei frutti (Fig. 12).




Identificazione
Per identificare P. syringae si può ricorrere a metodiche come l’esame colturale, i saggi biochimici e le analisi molecolari. Il primo si effettua mediante la semina del campione sui due terreni già nominati in precedenza (Nutrient-Sucrose Agar e King’s B Medium con antibiotici). Il campione può essere, ad esempio, dei fiori o dei boccioli in necrosi, da cui vengono prelevati dei frammenti di tessuto; questi si disinfettano in etanolo al 70%, si tagliano, si frantumano in un mortaio e si sospendono in una soluzione sterile di tampone fosfato salino. Dopo 20 minuti si procede alla semina della sospensione sulle piastre, che si incubano per 3-6 giorni a una temperatura di 24-26° C.
La parte biochimica include le seguenti prove:
- Il test della sintesi del levano facendo crescere le colonie su Nutrient-Sucrose Agar;
- Il test dell’ossidasi applicando le colonie in forma liquida su dischetti impregnati di fenilendiamina (sostanza incolore), che diventa indofenolo (di colore blu-violaceo) se il batterio oggetto d’esame esprime l’enzima ossidasi;
- Il test della produzione del pigmento fluorescente osservando la piastra di King’s B Medium ai raggi UV;
- Il test dell’attività della pectinasi aggiungendo una sospensione batterica su dei pezzi di patate e incubando a 25° C per 24 ore. La positività è data dalla liberazione di zuccheri riducenti (glucosio, fruttosio, galattosio, gliceraldeide);
- Il test dell’arginina diidrolasi facendo crescere i batteri su un terreno di coltura contenente L-arginina per 7 giorni a 25° C. Il test è positivo se il terreno assume un colore che va dal rosa acceso al rosso;
- Il test della reazione di ipersensibilità infiltrando una sospensione batterica in foglie di tabacco. Il saggio è positivo se nel giro di 24 ore i tessuti delle foglie vanno incontro a necrosi.
P. syringae risulta positivo per il primo e l’ultimo saggio, variabile per il terzo (per esempio, P. syringae pv. phaseolicola è positivo, mentre P. syringae pv. actidiniae è negativo), e negativo per gli altri tre.
Passando ai metodi molecolari, quelli che vengono adoperati sono la reazione a catena della DNA polimerasi (PCR) impiegando, ad esempio, i due oligonucleotidi B1 (5′-CTTTCCGTGGTCTTGATGAGG-3′) e B2 (5′-TCGATTTTGCCGTGATGAGTC-3′), che permettono di identificare il gene syrB, necessario per la produzione della siringomicina. In aggiunta a ciò, si può ricorrere anche al sequenziamento degli amplificati delle sequenze codificanti per la subunità ribosomiale 16S (16S rDNA), seguito dall’analisi bioinformatica con BLAST.
Modalità di gestione e prevenzione
La strategia di controllo verso P. syringae praticata in maggior misura sono gli spray battericidi contenenti composti rameici o altri metalli pesanti. I trattamenti chimici con sostanze come la miscela Bordeaux (formata da solfato rameico e ossido di calcio), idrossido di rame e solfato rameico servono allo scopo di impedire la diffusione del batterio uccidendolo durante lo stadio epifita sulle foglie o sulle parti legnose dell’albero. Tuttavia, esistono dei ceppi di P. syringae resistenti. Un’ulteriore tattica di controllo, meno abituale rispetto alla prima, è l’applicazione di antibiotici come la streptomicina.
Un articolo pubblicato su Journal of Plant Physiology nel 2019 ha messo in luce che l’aggiunta di ammonio sulle piante di pomodori comporta dei cambiamenti nel metabolismo del carbonio e dell’azoto conferendo resistenza contro P. syringae. Peraltro, anche un’igiene rigorosa nei frutteti, insieme alla potatura all’inizio della primavera e dell’estate, rende gli alberi più tolleranti verso il microorganismo. I cancri cauterizzanti che si sviluppano nei frutteti possono salvare la vita degli alberi bloccando l’infezione dalla diffusione.
Secondo uno studio del 2020, pubblicato su Microorganisms, una combinazione di batteriofagi e carvacrolo (un olio essenziale dell’origano e del timo) sembra essere promettente nel controllo della formazione del biofilm. Un approccio del genere è esente da problemi ambientali ed economicamente vantaggioso.
La profilassi consiste nelle seguenti misure:
- Quando si verificano casi di cancro batterico, è opportuno che le piante infette vengano dissodate e bruciate. Inoltre, bisogna disinfettare ogni utensile adoperato al fine di scongiurare la trasmissione della patologia;
- Mantenere un equilibrio nella nutrizione delle piante;
- Non usare sistemi di irrigazione per aspersione;
- Stare attenti a non arrecare ferite accidentali alle piante;
- Decontaminare gli attrezzi usati nella potatura con sali di rame, etanolo e candeggina quando si passa da una pianta all’altra, a prescindere dalla presenza o meno di sintomi tipici del cancro;
- I tagli di potatura vanno chiusi con mastici ecologici miscelati a sali di rame;
- Usare prodotti autorizzati contenenti sali di rame attenendosi alle spiegazioni scritte sulle etichette;
- Rimuovere gli scarti della potatura che si trovano vicino o all’interno dell’impianto;
- Se c’è un impianto infetto e un altro in apparenza sano, non passare dal primo al secondo con trattori o altri macchinari.
Fonti
- Arnold DL, Preston GM. 2019. “Pseudomonas syringae: enterprising epiphyte and stealthy parasite”, Microbiology
- Anzai, Y, Kim, H, Park, JY, Wakabayashi, H; Oyaizu, H. 2000. “Phylogenetic affiliation of the pseudomonads based on 16S rRNA sequence”, International Journal of Systematic and Evolutionary Microbiology.
- Kreig N. R., Holt J. G. 1984. “Bergey’s Manual of Systematic Biology”, Baltimore: Williams and Wilkins
- Nikolaidis Marios, Mossialos Dimitris, Olive, Stephen G., Amoutzias Grigorios D. 2020. “Comparative Analysis of the Core Proteomes among the Pseudomonas Major Evolutionary Groups Reveals Species-Specific Adaptations for Pseudomonas aeruginosa and Pseudomonas chlororaphis“, Diversity
- Scholz-Schroeder Brenda K., Soule Jonathan D., Gross Dennis C. 2003. “The sypA, sypB, and sypC Synthetase Genes Encode Twenty-Two Modules Involved in the Nonribosomal Peptide Synthesis of Syringopeptin by Pseudomonas syringae pv. syringae B301D”, Molecular Plant-Microbe Interactions
- Maki Leroy. 1974. “Ice Nucleation Induced by Pseudomonas syringae“, Applied Microbiology
- Hirano S. S., Upper C D. 1990. “Population Biology and Epidemiology of Pseudomonas Syringae“, Annual Review of Phytopathology
- Hirano S. S., Upper C. D. 2000. “Bacteria in the Leaf Ecosystem with Emphasis on Pseudomonas syringae—a Pathogen, Ice Nucleus, and Epiphyte”, Microbiology and Molecular Biology Reviews
- Suli Sun, Ye Zhi and Zhendong Zhu. 2017. “An emerging diseaese caused by Pseudomonas syringae pv. phaseolicola threatens mung bean production in China”, Plant Disease
- “PM 7/120 (1) Pseudomonas syringae pv. actinidiae”, 2014, Bulletin OEPP/EPPO Bulletin
- Kennelly Megan M., Cazorla Francisco M., de Vicente Antonio, Ramos Cayo and Sundin George W. 2007. “Pseudomonas syringae Diseases of Fruit Trees: Progress Toward Understanding and Control”, Plant Disease
- Ichinose Yuki, Taguchi Fumiko and Mukaihara Takafumi. 2013. “Pathogenicity and virulence factors of Pseudomonas syringae“, J Gen Plant Pathol
- González-Hernández Ana Isabel, Fernández-Crespo Emma, Scalschi Loredana, Hajirezaei Mohammad-Reza, von Wirén Nicolaus, García-Agustín Pilar, Camañes Gemma. 2019. “Ammonium mediated changes in carbon and nitrogen metabolisms induce resistance against Pseudomonas syringae in tomato plants”, Journal of Plant Physiology
- Ni Peien, Wang Lei, Deng Bohan, Jiu Songtao, Ma Chao, Zhang Caixi, Almeida Adelaide, Wang Dapeng, Xu Wenping, Wang Shiping. 2020. “Combined Application of Bacteriophages and Carvacrol in the Control of Pseudomonas syringae pv. actinidiae Planktonic and Biofilm Forms”, Microorganisms