La biocatalisi, ossia la catalisi di reazioni chimiche da parte di cellule o enzimi, è oggi una tecnica consolidata per la sintesi organica, sia nella ricerca accademica sia nell’industria, e rappresenta una strategia cruciale in quella che viene definita “chimica sostenibile” o Green Chemistry.
Alcune proteine enzimatiche di batteri, funghi e animali presentano delle proprietà (es. turnover catalitico, stabilità termica, resistenza ad agenti denaturanti) che possono renderle adatte all’impiego in processi industriali.
Negli ultimi trent’anni vi è stato un significativo aumento dell’impiego di biocatalizzatori industriali per la produzione di molecole ad alto valore aggiunto, in quanto un processo di produzione industriale condotto mediante biocatalisi presenta spesso il vantaggio di essere ecocompatibile, privo di costosi smaltimenti di solventi o prodotti indesiderati, ma soprattutto caratterizzato da una straordinaria chemo-, regio- ed enantioselettività.
L’applicazione di enzimi in forma purificata o inseriti in sistemi cellulari per la produzione di molecole organiche è uno strumento ampiamente utilizzato in diversi campi industriali come quello chimico, farmaceutico, alimentare, cosmetico e tessile.
L’utilizzo di biocatalizzatori, e la loro sempre maggiore diffusione, è principalmente dovuto a importanti progressi tecnologici, come l’introduzione di metodi di manipolazione del DNA, quali l’ingegneria metabolica e proteica. Questi approcci hanno permesso di sviluppare varianti cellulari ed enzimatiche mirate all’ottimizzazione di uno specifico processo catalitico e delle rese di reazione per il prodotto di interesse. L’ingegneria proteica, affiancata alla possibilità di immobilizzare gli enzimi su opportuni supporti, ha inoltre permesso di superare il limite della stabilità degli enzimi in diverse condizioni, laddove parametri, quali la temperatura e la presenza di solventi e/o reattivi e prodotti, possono provocare la denaturazione del biocatalizzatore.
Ad oggi, l’applicazione della biocatalisi su scala industriale è possibile attraverso l’ottimizzazione del biocatalizzatore in funzione sia del substrato e della reazione che dovrà catalizzare, sia delle condizioni di reazione richieste dalla tecnologia industriale. La biocatalisi può inoltre essere una valida alternativa green dal momento che le condizioni di reazione sono solitamente più blande rispetto alla sintesi chimica.
Tra le diverse reazioni di interesse industriale, l’ossi-funzionalizzazione selettiva dei composti organici per via enzimatica è una delle più interessanti in quanto rispetto alla sintesi chimica supera diversi problemi legati all’utilizzo di forti agenti ossidanti e alle difficoltà nell’ottenimento di chemo-, regio- e enantioselettività. Tali reazioni sono catalizzate in natura dalle ossigenasi, enzimi della classe delle ossidoreduttasi (classe 1) coinvolti in diversi processi metabolici.
Le monoossigenasi (Fig. 1) sono enzimi che catalizzano l’inserimento di un singolo atomo di ossigeno molecolare in una molecola organica. A tale scopo, attivano l’ossigeno molecolare grazie al trasferimento di elettroni che genera un intermedio reattivo dell’ossigeno diverso a seconda del cofattore presente in queste proteine. Gli elettroni necessari per l’attivazione dell’ossigeno possono essere estratti direttamente dal substrato oppure possono derivare da cofattori esterni quali il NAD(P)H.
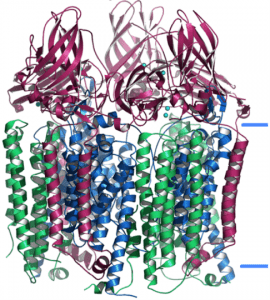
Le monoossigenasi si dividono in diverse classi a seconda del cofattore che possiedono. Tra queste, alcune delle classi più importanti sono rappresentate da monoossigenasi eme-dipendenti, citocromi P450 e monoossigenasi flavina-dipendenti.
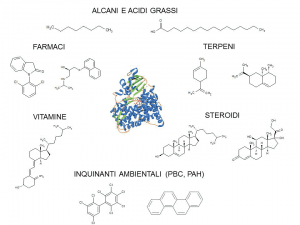
I citocromi P450 sono enzimi ubiquitari, presenti in batteri, funghi, piante e mammiferi, e contenenti il gruppo eme. I substrati che questi enzimi sono in grado di riconoscere e convertire sono molteplici e includono acidi grassi, terpeni, steroidi, prostaglandine, composti aromatici, solventi, farmaci, pesticidi e altri xenobiotici (Fig. 2).
Le applicazioni dei citocromi P450 nell’industria farmaceutica riguardano la sintesi di precursori di farmaci e dei loro metaboliti. Un esempio è la sintesi della pravastatina, un farmaco prodotto dalla Daiichi-Sankyo e prescritto a milioni di persone in più di 100 nazioni per ridurre il colesterolo. In questo processo, il precursore compactina derivate dal fungo Penicillium citrinum è convertito in parvastatina in un processo fermentativo che utilizza Streptomyces carbophilus che, grazie al citocromo P450sca-2 (CYP105A3), catalizza la 6β-idrossilazione della compactina.
L’interesse nell’utilizzo dei citocromi P450 è ancora più grande se si considera la possibilità di utilizzare biomasse o composti di scarto per valorizzarne le risorse. Le biomasse lignocellulosiche rappresentano una delle risorse più diffuse e promettenti del nostro pianeta per la produzione di energia e sostanze a valore aggiunto variabile come alternative alle risorse fossili. Tuttavia, la complessa struttura chimica di questa tipologia di biomasse richiede la messa a punto di tecnologie e processi ad hoc per idrolizzare dapprima le tre componenti principali, quali cellulosa, emicellulosa e lignina, e procedere successivamente con la loro valorizzazione mediante processi chimici, fisici e/o biotecnologici.
In questo contesto, un pool enzimatico formato da biocatalizzatori degradativi accoppiati a enzimi che catalizzano la produzione del composto di interesse potrebbe essere una strategia promettente.
Tale combinazione enzimatica può essere creata in organismi “ospitanti” attraverso metodi di ingegneria genetica e metabolica oppure sfruttare alcune specie di microrganismi wild type (es. funghi basidiomiceti) che possiedono un corredo enzimatico extracellulare per la degradazione di tutte le componenti del legno (compresa la lignina) accoppiato ad un corredo di citocromi P450 intracellulari che permettono di sfruttare le risorse provenienti dalla degradazione.
In conclusione, le straordinarie capacità delle monoossigenasi di sintetizzare composti di interesse industriale rendono questi enzimi molto attraenti. Tuttavia, lo sviluppo di un processo industriale può richiedere la combinazione di tecniche di biologia molecolare, sintesi organica e ingegneria.
Inoltre, nell’era in cui il recupero, il riciclo e la valorizzazione di risorse residuali sono importanti, i corredi enzimatici che la natura mette già a disposizione in diversi organismi possono essere sfruttati. Infatti, il basso costo dei materiali di partenza potrebbero bilanciare i costi, spesso elevati, della biocatalisi.
Infine, sebbene il potenziale delle possibili applicazioni degli enzimi come biocatalizzatori nella produzione industriale di prodotti di chimica fine e farmaceutici sia enorme e promettente, queste applicazioni sono spesso limitate dalle intrinseche caratteristiche degli stessi enzimi naturali o ingegnerizzati.
Nicola Di Fidio
Bibliografia
- Giovanna Di Nardo, Sheila J. Sadeghi, Gianfranco Gilardi. UTILIZZO DI MONOSSIGENASI PER LA BIOCATALISI INDUSTRIALE. 2016. DOI: http://dx.medra.org/10.17374/CI.2016.98.5.12
- Loredano Pollegioni, Mirella S. Pilone. Nuovi biocatalizzatori “su misura”. Chimica e Biotecnologie. 2008.
- Ichiro Watanabe, Futoshi Nara, Nobufusa Serizawa. Cloning, characterization and expression of the gene encoding cytochrome P-450sca-in2 from Streptomyces carbophilus involved in production of pravastatin, a specific HMG-CoA reductase inhibitor. Gene, Volume 163, Issue 1, pages 81-85, 1995.
- Ichinose H. Cytochrome P450 of wood-rotting basidiomycetes and biotechnological applications. Biotechnol. Appl Biochem. 60 (1): 71-81, 2013. doi: 10.1002/bab.1061.
Crediti immagini
- https://www.thieme.de/en/thieme-chemistry/sos-biocatalysis-in-organic-synthesis-66114.htm
- http://www.methanotroph.org/wiki/biochemistry/
- Giovanna Di Nardo, Sheila J. Sadeghi, Gianfranco Gilardi. UTILIZZO DI MONOSSIGENASI PER LA BIOCATALISI INDUSTRIALE. 2016. DOI: http://dx.medra.org/10.17374/CI.2016.98.5.12