La colonizzazione microbica contribuisce all’omeostasi intestinale in una relazione mutualistica dinamica.
I vertebrati sono coinvolti in associazioni simbiotiche con una larga e complessa comunità di microrganismi che colonizzano il loro tratto gastrointestinale. Recenti scoperte hanno investigato i meccanismi di questa simbiosi e come possano questi aver contribuito alla biologia dei vertebrati, sebbene il processo evolutivo che ne è alla base non sia ancora stato chiarito.
La comparsa dei microrganismi procarioti 3 miliardi di anni fa ha portato alla loro colonizzazione di ogni ambiente virtualmente disponibile. Gli eucarioti, comparsi molto tempo dopo, e i loro organismi fornirono nuovi habitat per l’espansione microbica. La comunità di microrganismi che colonizzarono il tratto digerente dei vertebrati fu impressionante sia per numero che per complessità. Infatti, la popolazione più vasta è proprio quella del tratto digerente dei mammiferi, con il numero di cellule più alto registrato per qualsiasi altro ecosistema microbico conosciuto (pari a 1010 – 1012 cellule/mL). Queste comunità comprendono migliaia di specie e la loro variabilità e capacità metabolica è specifica per ogni ospite e tratto intestinale.
Le recenti tecniche di caratterizzazione molecolare e la disponibilità di animali modello hanno permesso di indagare sui meccanismi alla base dell’interazione con l’ospite. Sebbene la maggior parte dei microrganismi risulti non patogeno, ad oggi è largamente riconosciuto il loro contributo negli stati fisio-patologici dell’organismo ospite.
Alla nascita, il tratto digerente dei vertebrati è sterile, ma viene rapidamente colonizzato dalla popolazione microbica che dopo un periodo di iniziale fluttuazione, rimane piuttosto stabile nel tempo. Questa relazione viene definita simbiosi (dal Greco sym=con e bios=vita), un termine che descrive una interazione stretta e a lungo termine tra due organismi diversi. Anche se considerato in principio un fenomeno raro, è stato al contrario riscontrato molto diffuso nel regno animale.
A seconda dell’effetto sull’ospite, la relazione simbiotica può essere vantaggiosa o meno, in quanto l’originale definizione di simbiosi di Anton de Bary del 1879 si intendeva per descrivere rapporti mutualistici commensali o parassitari. C’è tuttavia da considerare che i legami simbiotici nell’intestino dei vertebrati non sono così netti da permettere una categorizzazione unica, in quanto mutualismo e parassitismo spesso sono un continuum e dipendono dal background genetico dell’ospite e dall’interazione con i fattori ambientali. In generale, è risultato evidente che l’effetto sul microbiota sia positivo e di importanza critica per la biologia dei vertebrati.
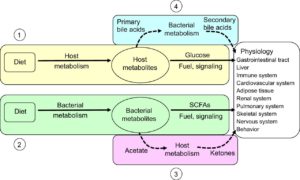
I microrganismi intestinali furono essenziali per le fasi erbivore di mammiferi e uccelli. I genomi dei vertebrati, infatti, contengono un repertorio limitato di glicosil idrolasi (che catalizzano l’idrolisi dei legami glicosidici) e sono proprio i microrganismi a permettere di ricavare energia dalle porzioni fibrose delle piante, come foglie, piccioli e steli. L’energia metabolica ottenuta grazie al metabolismo microbico specialmente sotto forma di acidi grassi a catena corta (SCFA) è molto importante in molte specie di vertebrati rappresentando il 70% nei ruminanti, il 20-30% in vari animali onnivori e il 10% negli umani. Un altro importante fattore conferito dal microbiota intestinale è la capacità di prevenire le malattie enteriche dovute a microrganismi patogeni, un tratto riferito come resistenza alla colonizzazione. Inoltre i microrganismi intestinali contribuiscono alla funzione della barriera epiteliale, all’apporto di vitamine, alla detossificazione di composti tossici, all’angiogenesi e allo sviluppo e maturazione del sistema immunitario. I benefici significativi dovuti al microbiota intestinale dimostrano che è concettualmente discutibile riferirsi a questa simbiosi come un semplice commensalismo.
Roberta Ranieri
Bibliografia:
El Aidy S, Van den Abbeele P, Van de Wiele T, Louis P, Kleerebezem M. Intestinal colonization: how key microbial players become established in this dynamic process: microbial metabolic activities and the interplay between the host and microbes. Bioessays. (2013).
Walter J, Britton RA, Roos S. Host-microbial symbiosis in the vertebrate gastrointestinal tract and the Lactobacillus reuteri paradigm. PNAS. (2011).
Round JL, Mazmanian SK The gut microbiota shapes intestinal immune responses during health and disease. Nat Rev Immunol (2009).
(Figura in evidenza: Escherichia coli, uno dei tanti microrganismi che vive in simbiosi con l’uomo)