Caratteristiche
Il genere >Clostridium è caratterizzato da organismi ubiquitari quindi capaci di vivere e/o sopravvivere in vari tipi di ambienti. Inoltre, racchiude bacilli anaerobi obbligati, Gram-positivi, in grado di formare spore e produrre tossine. In particolare, Clostridium felsineum è un anaerobio cromogeno identificato nel 1917 da Carbone e Tombolato che viene prevalentemente utilizzato in tutta Europa per la macerazione di lino e canapa. Il processo comporta la fermentazione di materiali pectici ed emicellulosici.
Filogenesi
| Dominio | Batteri |
| Phylum | Firmicutes |
| Classe | Clostridia |
| Ordine | Eubacteriales |
| Famiglia | Clostridiaceae |
| Genere | Clostridium |
| Specie | C. felsineum |
| Nome binomiale | Clostridium felsineum – Carbone and Tombolato 1917 |
| Sinonimo | Bacillus felsineus |
Genoma e metabolismo
La filogenesi e le relazioni evolutive all’interno del genere Clostridium sono ancora poco conosciute. Tuttavia, si possono riconoscere delle forti associazioni genetiche tra alcune specie come C. acetobutylicum, C. felsineum e C. roseum. Infatti, è possibile osservare che alcuni ceppi di Clostridium acetobutylicum sono filogeneticamente vicini a Clostridium felsineum (Fig. 2) ma alcuni studi di ibridazione DNA-DNA hanno mostrato differenze genetiche utili a considerarle come due specie distinte. Ulteriori informazioni genetiche associate al sequenziamento del tratto ribosomiale 16s sono accessibili all’interno del database pubblico NCBI al numero di accesso NR_114567.

Sotto il profilo metabolico, grazie alla formazione di elevate quantità di pectinasi, Clostridium felsineum viene considerato come il migliore agente biologico per la macerazione rispetto ad altre tipologie di clostridi. L’agente primario della macerazione è l’enzima extracellulare poligalatturonasi (PG), anche se altri enzimi concorrono all’azione. Inoltre, l’elevata ed interessante produzione di acido acetico permette di ipotizzare il possibile utilizzo in nuovi ambiti applicativi.
Immagini al microscopio
Considerata la stretta somiglianza genotipica e fenotipica tra C. felsineum e C. acetobutylicum, di seguito si propone un’immagine indicativa della struttura di Clostridium felsineum (Fig. 3).
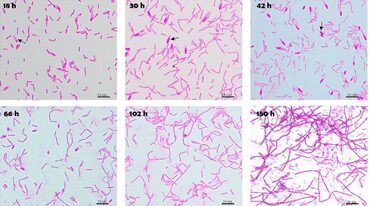
La temperatura ottimale di crescita è di 37 °C e tra i medium di coltura si riconoscono il “clostridium acetobutylicum medium”, l’ “EG medium” ed il “liver tryptone glucose broth”.
Metodi di identificazione
L’identificazione può avvenire mediante l’applicazione di varie metodiche tra le quali si distingue il sequenziamento del tratto ribosomiale 16s e l’utilizzo di specifici terreni di coltura. Il terreno da considerare per la purificazione delle colture può essere lo “yeast infusion-starch agar” dove le colonie appaiono di colore giallo. C. felsineum può essere distinto da C. aurantibutyricum per la mancata riduzione del nitrato mentre da C. puniceum per la fermentazione del ramnosio e per la mancanza di pectinesterasi. Pertanto, anche metodi indirizzati verso l’analisi del metabolismo e dei relativi prodotti possono essere decisivi per un’identificazione corretta e precisa.
Un esempio di tale approccio è l’analisi dell’attività pectinolitica che prevede l’inoculo e la crescita di C. felsineum su terreni contenenti lo 0,5% di pectina. Successivamente, le piastre vengono sottoposte al trattamento con soluzione all’1% di bromuro di ammonio cetiltrimetilico. Infine, dopo 3 giorni di crescita, l’attività enzimatica viene misurata nei surnatanti delle colture cellulari mediante il metodo dell’acido dinitrosalicilico (DNS).
Ecologia
C. felsineum, fu individuato per la prima volta in Italia durante l’analisi dei processi di macerazione della canapa. In seguito, si è registrata la presenza di questo organismo in altri ambienti grazie al riconoscimento di colonie arancioni brillanti che può formare su specifiche superfici. Attualmente, si riconoscono tre ceppi che vengono utilizzati nell’ambito della produzione industriale e l’analisi microbiologica (Fig. 4).
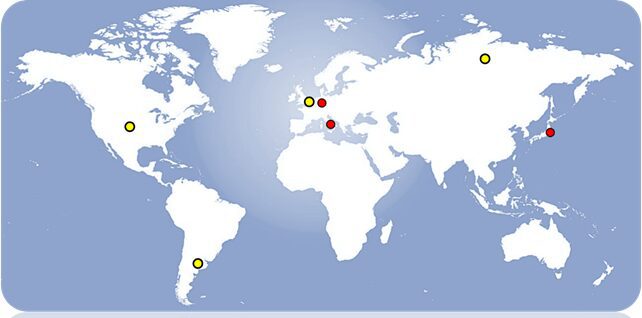
Figura 4 – In rosso gli strains di laboratorio. I ceppi simili o identici sono indicati in giallo – [Credit: produzione propria]
Gli strains oggetto di studio in Italia, Germania e Giappone sono JCM 1399, BCRC 14489 e DSM 794 (in rosso). In letteratura si registra l’isolamento di ceppi wild-type simili o identici a Clostridium felsineum in Olanda, Argentina, Stati Uniti e Russia (in giallo).
Patogenesi
Non esistono evidenze relative alla patogenicità. Gli studi condotti su tutti i ceppi fino ad ora conosciuti sottolineano una sensibilità a clindamicina, eritromicina, penicillina G e tetraciclina. Alcuni ceppi mostrano resistenza al cloramfenicolo.
Applicazioni microbiologiche: la macerazione microbiologica
In generale, il processo di “microbiological retting” prevede l’utilizzo di microrganismi per la trasformazione dei materiali di origine vegetale. Nel caso di C. felsineum, i risultati di alcuni studi indicano che il tipo di acqua, la temperatura dell’acqua di macerazione e l’inoculo batterico possono influenzare la durata del processo e la qualità della fibra (Fig. 5). Inoltre, l’aumento della temperatura dell’acqua da 24 a 28 °C può ridurre la durata del processo da 6 a 4 giorni. Le prove effettuate su canapa suggeriscono risultati migliori in acqua stagnante ad una temperatura di 28 °C.

Infine, l’analisi dei risultati ottenuti dalla macerazione microbiologica della canapa, ha posto in evidenza la formazione di fibre con un diametro maggiore rispetto le fibre ottenute con macerazione chimica e l’assenza di incrostazioni superficiali legate a residui di tessuti parenchimatici.
Fonti
- K.J. Ryan, C.G. Ray, Sherris Medical Microbiology, 4ª edizione, McGraw Hill, 2004, ISBN 0-8385-8529-9
- https://lpsn.dsmz.de/species/clostridium-felsineum
- https://www.ncbi.nlm.nih.gov/Taxonomy/Browser/wwwtax.cgi?lvl=0&id=36839
- http://www.catalogueoflife.org/annual-checklist/2010/details/species/id/4258319/source/tree
- H. Bruggemann, G. Gottschalk, Clostridia: Molecular Biology in the Post-genomic Era, Caister Academic Press, 2009, ISBN 978-1-904455-38-7
- https://bacdive.dsmz.de/strain/2586
- Global catalogue of microorganisms: http://gcm.wfcc.info/
- Kalia, V.C., Mukherjee, T., Bhushan, A. et al. Analysis of the unexplored features of rrs (16S rDNA) of the Genus Clostridium. BMC Genomics 12, 18 (2011). https://doi.org/10.1186/1471-2164-12-18
- Jacobson MJ, Lin G, Whittam TS, Johnson EA: Phylogenetic analysis of Clostridium botulinum type A by multi-locus sequence typing. Microbiol. 2008, 154: 2408-2415. 10.1099/mic.0.2008/016915-0
- Porwal S, Lal S, Cheema S, Kalia VC: Phylogeny in aid of the present and novel microbial lineages: Diversity in Bacillus. PLoS ONE. 2009, 4: e4438-10.1371/journal.pone.0004438
- Verma V, Raju SC, Kapley A, Kalia VC, Purohit HJ: Evaluation of genetic and functional diversity of Stenotrophomonas isolates from diverse effluent treatment plants. Biores Technol. 2010, 101: 7744-7753. 10.1016/j.biortech.2010.05.014
- Tamburini E, Daly S, Steiner U, Vandini C, Mastromei G: Clostridium felsineum and Clostridium acetobutylicum are two distinct species that are phylogenetically closely related. Int J Syst Evol Microbiol. 2001, 51: 963-966
- https://www.ncbi.nlm.nih.gov/nuccore/NR_114567.1
- POTTER LF, MCCOY E. The fermentation of pectin and pectic acid by Clostridium felsineum. J Bacteriol. 1952;64(5):701-708. doi:10.1128/JB.64.5.701-708.1952
- https://www.dsmz.de/microorganisms/medium/pdf/DSMZ_Medium411.pdf
- Avrova, N. P. 1975. Synthesis of pectolytic enzymes by Clostridium felsineum and their hydrolysis of the pectin substances of flax straw. Appl. Biochem. Microbiol. 11:736-741
- Bergey’s Manual of Systematics of Archaea and Bacteria. Online, 2015. Bergey’s Manual Trust. Published by John Wiley & Sons, Inc., in association with Bergey’s Manual Trust. DOI: 10.1002/9781118960608.gbm00619
- http://www.malinf.com/batteria-index/clostridium.htm
- Liu, D., Yang, Z., Chen, Y. et al. Clostridium acetobutylicum grows vegetatively in a biofilm rich in heteropolysaccharides and cytoplasmic proteins. Biotechnol Biofuels 11, 315 (2018). https://doi.org/10.1186/s13068-018-1316-4
- https://etd.adm.unipi.it/theses/available/etd-02192014-152845/
- MCCLUNG, L. S. Isolation of Clostridium felsineum from samples of Indiana mud. In: Proceedings of the Indiana Academy of Science. 1941. p. 71-72.
- Di Candilo, M., Ranalli, P., Bozzi, C., Focher, B., & Mastromei, G. (2000). Preliminary results of tests facing with the controlled retting of hemp. Industrial Crops and Products, 11(2-3), 197–203. doi:10.1016/s0926-6690(99)00047-3
Gennaro Velotto