Burkholderia cenocepacia è un batterio Gram-negativo appartenente al Burkholderia cepacia complex (Bcc), composto da almeno 17 specie diverse ma con fenotipo simile. Presenta forma bastoncellare e si trova comunemente nell’ambiente, essendo capace di adattarsi a diversi tipi di ecosistema.
| Dominio | Prokaryota |
| Regno | Bacteria |
| Phylum | Proteobacteria |
| Classe | Betaproteobacteria |
| Ordine | Burkholderiales |
| Famiglia | Burkholderiaceae |
| Genere | Burkholderia |
| Specie | B. cenocepacia |
È stato scoperto per la prima volta nel 1949 da Walter Burkholder e identificato come responsabile dei processi di putrefazione delle erbe Gigliacee (a cui appartiene la cipolla, “cepa” in latino) e successivamente, nel 1950, è stato riconosciuto come patogeno opportunista nell’uomo. Il complesso Bcc è, infatti, responsabile di infezioni opportunistiche in pazienti immunocompromessi e in modo particolare in quelli affetti da fibrosi cistica (FC). In questo articolo andiamo ad indagare le possibili correlazioni tra Burkholderia cenocepacia e la fibrosi cistica.
La fibrosi cistica
La fibrosi cistica è una malattia genetica autosomica recessiva causata da mutazioni del gene CFTR (Cystic Fibrosis Transmembrane Regulator) che codifica per una proteina composta da circa 1480 amminoacidi. Questa proteina è localizzata sulla membrana apicale delle cellule epiteliali delle vie aeree, del pancreas, dell’intestino, delle ghiandole sudoripare, delle ghiandole salivari e dei vasi deferenti, svolgendo il ruolo di trasportatore del cloro, che favorisce il passaggio di ioni cloro dall’interno all’esterno di queste cellule, con conseguente secrezione di acqua.
Ad oggi si conoscono più di 2000 mutazioni del gene CFTR e quelle di cui è noto l’effetto sulla proteina finale CFTR sono state suddivise in classi.
- Mutazioni di classe I, con mancata produzione della proteina;
- Mutazioni di classe II e classe III, responsabili della produzione della proteina difettosa;
- Mutazioni di classe IV, con produzione della proteina parzialmente difettosa ma capace di svolgere, seppur marginalmente, la sua funzione;
- Mutazioni di classe V, con produzione di una piccola quantità della proteina normalmente funzionante.
La più frequente delle mutazioni è la delezione di una tripletta che porta all’assenza, nella proteina finale, di un singolo amminoacido: la fenilalanina. Questa mutazione appartiene alle prime classi, generando un canale dalla struttura amminoacidica incompleta e mal funzionante. Lo squilibro ionico che si verifica a livello delle membrane delle cellule epiteliali, comporta una diminuzione della secrezioni di ioni cloro e un aumento dell’assorbimento di sodio e acqua. Il secreto normalmente prodotto da queste cellule, diminuisce nella componente d’acqua diventando più denso. Queste secrezioni, anormalmente rigide, determinano negli organi interessati un’ostruzione dei dotti principali che portano alla manifestazione dei sintomi più comuni di questa malattia, quali la comparsa di infezioni polmonari ricorrenti, insufficienza pancreatica, stati di mal nutrizione, cirrosi epatica, infertilità, ecc.

Burkholderia e fibrosi cistica
La presenza di mucose nelle vie respiratorie crea un habitat favorevole all’infezione dei bronchi da parte di batteri Bcc. Questi aderiscono facilmente alla mucosa delle vie aeree dei pazienti affetti da fibrosi cistica e sviluppano meccanismi di difesa verso qualsiasi tipo di trattamento terapeutico e verso il sistema immunitario dell’ospite.
In generale, i pazienti affetti da fibrosi cistica e colonizzati da Burkholderia e dai batteri Bcc mostrano una sopravvivenza a lungo termine significativamente ridotta rispetto ai pazienti FC non colonizzati da Bcc. Tra i membri di questo complesso, quello maggiormente coinvolto nelle infezioni in pazienti con fibrosi cistica è B. cenocepacia. I trattamenti a queste infezioni risultano essere particolarmente complicati in quanto i batteri Bcc sono peculiarmente virulenti e trasmissibili, nonché altamente resistenti alla maggior parte degli antibiotici. Talvolta, le infezioni polmonari possono causare in alcuni pazienti FC una malattia batteriologica progressiva, invasiva e fatale, la cosiddetta “sindrome da cepacia“. È stato dimostrato in diversi studi che le infezioni più aggressive, nonché il più altro tasso di mortalità nei pazienti FC, sono associati ad infezioni da ceppi epidemici appartenenti a B. cenocepacia.
Un trapianto polmonare è una possibile soluzione al percorso di cura. Purtroppo però la riuscita dell’intervento e la ripresa dei pazienti variano a seconda dello stato di salute e delle infezioni pre-trapianto: per infezioni provocate da B. cenocepacia, i casi di sopravvivenza sono nulli. Negli studi volti alla ricerca di cure terapeutiche, nonché nuovi antibiotici, è importante individuare le specie infettanti e conoscere le caratteristiche delle strutture che ne attribuiscono virulenza e trasmissibilità. In particolare, come riportato in letteratura, un ruolo chiave nello sviluppo e nella gravità di queste infezioni polmonari è svolto da una macromolecola normalmente presente nella membrana esterna dei batteri Gram-negativi, il lipopolisaccaride o LPS.
LPS e LOS
I lipopolisaccaridi o LPS sono macromolecole altamente immunogene, ovvero capaci di stimolare il sistema immunitario. Essi ricoprono circa il 75% della membrana esterna dei batteri Gram-negativi e possono differire per composizione sia tra batteri che appartengono allo stesso ceppo sia tra batteri che appartengono a ceppi differenti. Per la loro attività tossica sono considerati delle endotossine e vengono rilasciati dalla cellula batterica durante la fase di replicazione o di lisi. Gli LPS hanno carattere anfifilico avendo una struttura in parte idrofila e in parte idrofoba.
Sono composti da tre domini chimicamente, geneticamente e biologicamente distinti, tenuti da legami covalenti:
- LIPIDE A, preposto all’ancoraggio della macromolecola alla membrana,
- CORE, dominio centrale e
- O-Chain, che sporge all’esterno della cellula.
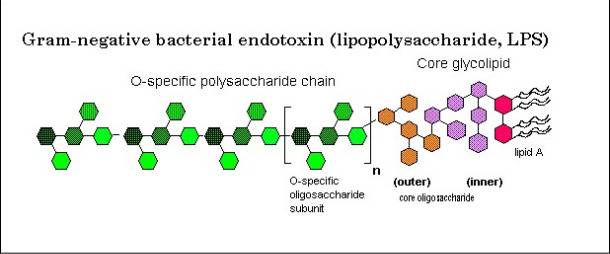
Lipide A
Il lipide A è costituito da un dimero di D-glucosammina (GlcN I e II), unite mediante legame β,1-6 glicosidico, entrambe fosforilate in posizione 1 e 4, rispettivamente. In posizione 2 e 3 sono entrambe legate ad acidi grassi a catenga lunga mediante legami esterei e ammidici. Questi acidi grassi sono detti primari e sono ossidrilati in posizione 3. A questi acidi grassi primari possono legarsi acidi grassi secondari tramite legami esterei. Il tipo di acidi grassi è, in genere, distintivo per batteri appartenenti alla stessa famiglia.
In posizione 6 la GlcN II è legata ad un chetoso tipico degli LPS, un acido 3-deossi-D-mannu-ottulosonico, che rappresenta il fattore di congiunzione tra il Lipide A e il Core.
Core
Il Core è la regione oligosaccaridica dell’LPS essendo costituita un oligosaccaride di 9-12 zuccheri. Questa porzione è molto costante per batteri che appartengono allo stesso genere.
O-Chain
Il terzo dominio rappresenta la parte antigenica. La sua struttura non è conservata ed è quindi difficilmente riconosciuto dal sistema immunitario. È la porzione più lunga della molecola, sporge all’esterno della membrana e conferisce proprietà idrofile e semipermeabili alla parete batterica. È composta essenzialmente da unità ripetitive (da 20 a 40 elementi) che contengono fino a 8 residui di diversa natura.
L’O-Chain può risultare assente in un LPS e distinguere ulteriormente i batteri in:
- smooth (S), dotati dell’O-Chain che conferisce un tipico aspetto liscio ed omogeneo alle colonie (LPS completo)
- rough (S), sprovvisti di O-Chain con colonie tipicamente rugose.
L’assenza del terzo dominio da vita ad una molecola ridotta rispetto al lipopolisaccaride, nota come lipooligosaccaride o LOS.
Attività biologia degli LPS
Il nostro organismo è dotato di un vero e proprio apparato difensivo, indispensabile per la protezione da numerosi agenti provenienti dall’ambiente esterno (batteri, funghi, protozoi, virus) o da elementi intrinseci riconosciuti come estranei dall’organismo. Le cellule che garantiscono la difesa sono riunite in un sistema capace di individuare l’agente causale o antigene e fornire una risposta specifica e selettiva mirata all’eliminazione dello stesso. Il Sistema Immunitario è formato da organi anatomicamente distinti: linfonodi e aggregati di cellule immunocompetenti.
Le risposte immunitarie possono essere distinte in due categorie principali:
- naturali o innate, dotate di minore specificità e che non si modificano a seguito di successive esposizioni agli antigeni, e
- acquisite, nelle quali si ha una elevata specificità di riconoscimento e un aumento di efficacia nella risposta nel corso di successive esposizioni.
L’immunità acquisita è più recente e gode di un meccanismo che si verifica nel primo contatto col patogeno, noto come “meccanismo di memoria”.
L’immunità innata è presente fin dalla nascita e prevede misure di difesa fisico-chimiche, rappresentate dalle cellule dell’epitelio, dalle mucose e da secrezioni esocrine come la saliva, e biologiche, costituite da cellule con funzioni fagocitarie come neutrofili e macrofagi. I recettori presenti sulla membrana di queste cellule possono interagire con molecole o porzioni di molecole che non sono espresse dall’organismo e che per questo vengono identificate come estranee o non-self o PAMP (Pathogen Associated Molecular Patterns). La famiglia dei recettori preposta al riconoscimento di queste strutture molecolari, è quella dei PRRs (Pattern Recognition Receptors).
I lipopolisaccaridi sono tra le molecole PAMP più comuni. Essi sono in grado, in un organismo ospite, di innescare sia una risposta immunitaria innata, mediata dal Lipide A, sia una risposta specifica, mediata dall’O-Chain o dal Core.
Fonti
- Epidemiology and Clinical Course of Burkholderia cepacia Complex Infections, Particularly Those Caused by Different Burkholderia cenocepacia Strains, among Patients Attending an Italian Cystic Fibrosis Center, J Clin Microbiol
- The polysaccharides, Aspinall, vol 1 e 2
- Anatomia umana – Principi, edi-ermes
- Gene CFTR – fibrosicisticaricerca