CRISPR-Cas
, il bisturi genetico che ha rivoluzionato la terapia genica, nasce come sistema di difesa dei batteri contro le infezioni virali. Anche i batteri, infatti, vengono infettati da virus chiamati batteriofagi o fagi, che sfruttano i macchinari dell’ospite per replicare se stessi. Tra preda e predatore esiste un’intensa pressione selettiva reciproca, che determina una “co-evoluzione” delle due specie. In un disperato testa a testa, i batteri imparano a difendersi dai fagi e i fagi cercano di eludere le difese dei batteri… facendo gioco di squadra!
Come funziona CRISPR-Cas?
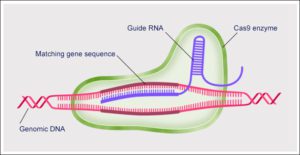
Quando il batterio viene infettato, il DNA dell’ospite virale viene “copiato” nella regione CRISPR (Cluster of Regularly-Interspaced Short Palindromic Sequences) del genoma batterico. Se immaginiamo il DNA come un potente hard-disk, possiamo dire che la sequenza genetica del nemico rimane “in memoria”. Ad ogni infezione, il segmento di DNA incorporato viene copiato su un filamento di RNA complementare, che riconosce il genoma estraneo e guida le proteine Cas al bersaglio. Cas è il nome di un gruppo di proteine con funzione di nucleasi, che spezzano i legami tra le molecole di DNA virale, sconfiggendo così l’infezione.
Come si difendono i fagi?
Una difesa ingegnosa, ma non insormontabile. Nella microscopica guerra tra batteri e batteriofagi, i secondi hanno recuperato terreno, perfezionando un sistema per sfuggire a CRISPR-Cas. Essi producono proteine anti-CRISPR chiamate Acr, che bloccano le sue componenti, ad esempio le “forbici” Cas, impedendogli di legare e tagliare il DNA virale. Esistono molte proteine Acr, con bersagli e meccanismi d’azione leggermente diversi, ma tutte giocano un ruolo fondamentale nell’evasione della risposta immunitaria dell’ospite batterico.
Qualcosa però non quadra. il sistema CRISPR-Cas riesce a distruggere i genomi virali nel giro di pochi minuti dall’infezione; è poco probabile che il fago abbia il tempo di sintetizzare proteine Acr a sufficienza prima di soccombere sotto i colpi dell’implacabile forbice. Intanto però ne produce qualcuna, spianando la strada a chi verrà dopo di lui.
L’unione fa la forza!
Sembra proprio che la parola d’ordine sia “cooperazione”. Un singolo fago non ha speranze di successo, ma può sfiancare l’avversario, rendendolo più suscettibile alle infezioni che seguiranno. Ma il prezzo da pagare è caro e richiederà il suo sacrificio.
Durante l’infezione primaria, il fago produce alcune proteine Acr, ma non abbastanza da impedire la degradazione del genoma virale. Il batterio esce vincitore da questo primo scontro, ma un po’ malconcio. Le proteine Acr non spariscono immediatamente, anzi; la loro persistenza causa nel batterio uno stato di “immunosoppressione” che, ad ogni infezione, lo rende sempre più vulnerabile agli attacchi successivi. I fagi che avranno la fortuna di infettare il batterio adesso, potranno contare sull’eredità dei loro predecessori: nei pochi minuti a disposizione, gli basterà produrre molta meno proteina Acr per raggiungere la soglia critica in grado di bloccare completamente CRISPR-Cas. Potranno quindi completare il ciclo d’infezione, sfruttando il sacrificio dei loro compagni. Dopotutto, chi vince è comunque la popolazione fagica.
In futuro, gli scienziati si propongono di studiare questi meccanismi fuori dal laboratorio, nei ben più complessi ambienti naturali, con la presenza simultanea di molti sottotipi di CRISP-Cas e proteine Acr. Questo tipo di strategie cooperative potrebbero essere piuttosto comuni nelle interazioni tra ospite e patogeno, magari anche in quelle che ci vedono protagonisti.
Erika Salvatori
Fonti:
- Landsberger M., et al. (2018) Anti-CRISPR Phages Cooperate to Overcome CRISPR-Cas Immunity. Cell174 : 908-916
- Borges A.L., et al (2018). Bacteriophage Cooperation Suppresses CRISPR-Cas3 and Cas9 Immunity. Cell174 : 917-925