Caratteristiche
Il batterio Bartonella bacilliformis è un coccobacillo Gram-negativo (Fig. 1), aerobio obbligato, asporigeno, pleomorfo, mobile per flagelli unipolari, intracellulare facoltativo. La prima identificazione del microorganismo avvenne nel 1905 da parte del batteriologo peruviano Alberto Barton, ma la sua scoperta venne pubblicata solo nel 1909; in origine lo scienziato aveva individuato delle strutture endoglobulari, ovvero batteri residenti nei globuli rossi, che sono effettivamente le cellule bersaglio di B. bacilliformis, insieme alle cellule endoteliali.
Questo batterio raffigura l’agente eziologico della malattia bartonellosi sudamericana, denominata anche Malattia di Carriòn, dal nome di Daniel Alcides Carriòn, uno studente di medicina che morì dopo essersi iniettato del sangue prelevato da una lesione di un bambino affetto.
La bartonellosi è diffusa nelle valli delle Ande peruviane, colombiane, boliviane ed ecuadoriane, ad altitudini tra 500 e 3000 metri, dove le condizioni ambientali sono favorevoli per lo sviluppo dei flebotomi del genere Lutzomyia (Fig. 2), che rappresentano i vettori di B. bacilliformis. Comunque, la nazione in cui la patologia è endemica è il Perù.


Dal punto di vista genetico, B. bacilliformis possiede un singolo cromosoma circolare, formato da 1.445.021 baia di basi (bp), che racchiude 1.334 geni, di cui 1.283 codificano per proteine, mentre i restanti 51 codificano per RNA. Tra i geni più rilevanti sono inclusi il locus della flagellina (la proteina che costituisce i flagelli), e i loci A e B associati all’invasione, che consentono al batterio di parassitare gli eritrociti.
Al livello del metabolismo, si conoscono 61 vie metaboliche in B. bacilliformis, di cui le più importanti sono la fissazione del carbonio, in cui l’anidride carbonica (CO₂) viene trasformata in materiali organici, il metabolismo dell’azoto, che converte l’azoto molecolare (N₂) in nitrato, ammonio e ossido di azoto, la glicolisi, che forma il piruvato dal glucosio, e il metabolismo del fruttosio, da cui vengono generati il diidrossiacetone e la gliceraldeide.
Filogenesi
| Dominio | Prokaryota |
| Regno | Bacteria |
| Phylum | Proteobacteria |
| Classe | Alpha proteobacteria |
| Ordine | Rhizobiales |
| Famiglia | Bartonellaceae |
| Genere | Bartonella |
| Specie | B. bacilliformis |
In passato il genere Bartonella era inquadrato nel gruppo delle Rickettsie, tuttavia la sua capacità di proliferare in mezzi di coltura privi di cellule ha condotto a una modifica della classificazione. Le Rickettsie, invece, necessitano di substrati contenenti cellule per la coltivazione in vitro.
Morfologia delle colonie
B. bacilliformis può essere coltivato su terreni arricchiti con sangue o siero; tra questi abbiamo l’agar sangue, dove il microorganismo crea delle colonie biancastre o traslucide che di solito vanno da uno a due millimetri di diametro (Fig. 3). Le condizioni ottimali di crescita sono una temperatura di 25 – 28° C e un pH di 7.8.

Patogenesi
Nel momento in cui l’insetto vettore di B. bacilliformis punge un organismo, il batterio penetra nelle cellule endoteliali, dove inizia il primo ciclo di replicazione, per poi entrare nel circolo ematico e infiltrarsi negli eritrociti; all’interno di questi ultimi può proliferare fino a provocarne la lisi, oppure può persistere in uno stato non replicativo (Fig. 4). Nel primo caso, il batterio dà inizio a un ciclo litico, simile a quello indotto da Plasmodium spp., comportando una grave anemia emolitica, che può coinvolgere fino al 90% delle emazie circolanti. L’ingesso nei globuli rossi consta di alcune fasi importanti, ovvero il legame alla superficie cellulare, la deformazione della membrana eritrocitaria (Fig. 5), la creazione di invaginazioni nella membrana e di vacuoli intracellulari in cui si colloca il batterio. L’invaginazione e la deformazione dei globuli rossi è connessa alla concomitanza dei flagelli e della proteina deformina. L’adesione del microorganismo alla superficie cellulare e la successiva invasione implicano una serie di proteine dei globuli rossi, come l’α-actina, la spettrina, la banda 3, la glicoforina A e la glicoforina B. in aggiunta a ciò, B. bacilliformis esprime tre proteine leganti l’emina (una molecola derivata dall’emoglobina), che giocano un ruolo fondamentale nel contatto batterio-eritrocita.


Il periodo di incubazione della bartonellosi va da 2 a 14 settimane, gli individui colpiti possono essere asintomatici, oppure manifestare sintomi aspecifici come emicrania e malessere. Comunque, nei casi in cui il batterio induce un’anemia marcata (fino a valori di 1.000.000 di eritrociti per mm³), i pazienti entrano nella fase acuta della malattia, ovvero la febbre di Oroya, caratterizzata da febbre, brividi, mal di testa, dolori muscolari e articolari, dolori addominali, pallore, mialgia, tachicardia, linfadenopatia ed epatomegalia. La febbre di Oroya è più frequente nei bambini che negli adulti. Nel 70% delle situazioni, in seguito a un’immunosoppressione temporanea, insorgono infezioni secondarie da vari agenti patogeni (Toxoplasma gondii, Staphylococcus aureus, Salmonella spp., Pneumocystis); in aggiunta a ciò, possono verificarsi complicazioni cardiopolmonari come arresto cardiaco, effusione pericardiale, edema polmonare e shock cardiogeno. A questo stadio c’è un rischio elevato di morte se la malattia non viene curata (da 40 a 85%).
Se la febbre di Oroya non porta al decesso, dopo circa un mese dalla guarigione avviene il passaggio verso la fase cronica, ossia la verruca peruviana, contraddistinta dalla comparsa di lesioni nodulari cutanee simili a emangiomi, colme di sangue che conferisce un colore rosso-porpora (Fig. 6). Esse sono causate dalla proliferazione delle cellule endoteliali, e possono infiammarsi o sanguinare. Oltre alle eruzioni cutanee, le persone affette lamentano anche artralgie, mialgie e parestesia.

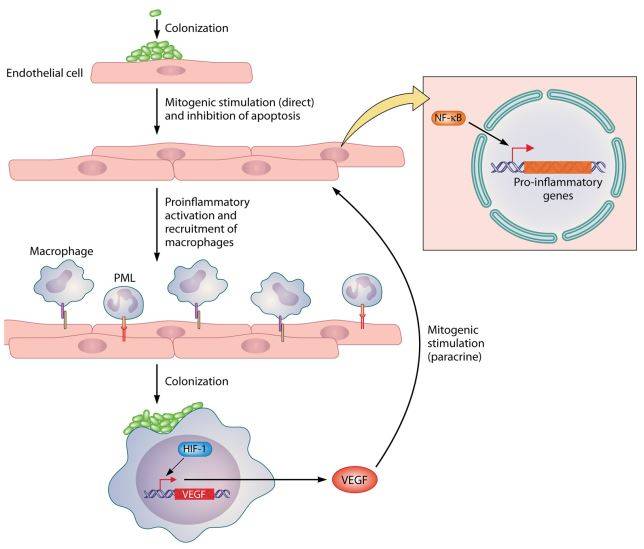
È interessante fornire una descrizione del meccanismo attraverso cui B. bacilliformis avvia la moltiplicazione delle cellule endoteliali, portando alla formazione delle lesioni (Fig. 7). Nel momento in cui colonizza queste cellule, il microorganismo produce dei fattori stimolanti la proliferazione, tra cui la proteina GroEL. Al contempo promuove l’espressione di geni codificanti per molecole proinfiammatorie mediante l’attivazione del fattore di trascrizione NF-kB (nuclear factor kappa-light-chain-enhancer of activated B cells). La liberazione di fattori infiammatori comporta il reclutamento dei macrofagi, che vengono insediati dal batterio, con conseguente attivazione del fattore di trascrizione HIF-1 (hipoxia inducible factor 1), che favorisce l’espressione del fattore di crescita dell’endotelio vascolare (VEGF). Quest’ultimo ha un effetto proliferativo sulle cellule endoteliali.
Uno sguardo al contesto storico
La malattia di Carriòn era conosciuta già ai tempi dell’era pre-colombiana, e tra i reperti più antichi rientra una mummia pre-Inca proveniente da Nazca (Perù meridionale), che presentava lesioni granulomatose contenenti microorganismi che si coloravano mediante colorazione Giemsa. Questi erano evidenti anche nei vasi sanguigni e nei granulomi degli organi interni. Le lesioni erano compatibili con le eruzioni caratteristiche della verruca peruviana, come anche i microorganismi trovati corrispondevano a B. bacilliformis. Alcune opere d’arte in ceramica, create nel periodo prima della conquista dell’America, mostrano persone con le lesioni nodulari tipiche (Fig. 8). Tra l’altro, la lingua parlata anticamente in Perù, il Quechua, include termini che indicano la febbre (rupha), l’anemia (sirki) e le eruzioni (kcepo e ticti). C’è da dire che nel 1525, durante il periodo Inca, la città imperiale di Cusco soffrì un’epidemia che provocò più di 200.000 decessi. Anche se alcuni autori affermano che la causa di tale epidemia fosse la bartonellosi, non è del tutto chiaro, dal momento che la fase cronica della malattia non fu mai descritta. Anzi, è altamente probabile che la causa fosse la prima ondata di vaiolo o morbillo, portate dai conquistatori spagnoli in Panama o dagli insediamenti del fiume Plate in seguito alla spedizione dell’esploratore portoghese Aleixo Garcia.

Nel 1630 il chirurgo Gago de Vadillo descrisse il primo resoconto riguardante la presenza della malattia verrucosa nella provincia di Huaylas, regione di Ancash, e formulò l’ipotesi secondo cui le verruche fossero connesse all’acqua da bere.
La successiva pietra miliare nella storia della bartonellosi risale al 1764, quando lo scienziato Francisco Antonio Cosme Bueno y Alegre citò due nuovi importanti fatti:
- La malattia è fastidiosa e pericolosa in assenza delle verruche, che sono correlate allo sviluppo della fase cronica, che ha un basso tasso di mortalità;
- L’origine della patologia sembra essere un piccolo insetto che funge da vettore.
L’evento che per primo attrasse l’attenzione dei medici sulla bartonellosi fu l’avvento improvviso di una patologia febbrile che uccise migliaia di uomini cinesi e cileni nel 1870 mentre stavano lavorando su una ferrovia nel villaggio di Cocachacra, tra Lima e Oroya. La febbre e l’anemia erano irrefrenabili, come anche il numero di morti (più di 7000 secondo alcuni racconti). La nuova malattia divenne nominata febbre di Oroya, malgrado in questa città non ci fosse stato alcun caso e Oroya fosse abbastanza distante dal luogo dell’epidemia.
Comunque, colui che diede il maggiore contributo all’esposizione di questa patologia fu Daniel Alcides Carriòn, il quale si inoculò del sangue proveniente da un bambino ospedalizzato il 27 agosto 1885. L’obiettivo del giovane studente era quello di descrivere e comprendere i sintomi che precedono la verruca peruviana, in quanto prima della comparsa delle lesioni cutanee, la diagnosi è difficile. Trascorsi 21 giorni dall’inoculazione, Daniel fu colpito dai primi sintomi che progredirono rapidamente e che erano compatibili con le caratteristiche cliniche della febbre di Oroya. Il giovane morì il 5 ottobre, e in suo onore questa data fu dichiarata come il Giorno della Medicina Nazionale in Perù, e la bartonellosi venne chiamata malattia di Carriòn. Il suo esperimento provò che la febbre di Oroya e la verruca peruviana sono due fasi diverse della stessa malattia.
Nel 1909 Alberto Barton annunciò la scoperta dell’agente eziologico della malattia. Inoltre, affermò che i bacilli si moltiplicano nel sangue di pazienti affetti da febbre di Oroya e si riducono fino alla completa scomparsa nel passaggio verso la verruca peruviana. Tuttavia, alcuni ricercatori non erano convinti dalla teoria di Barton, e solo nel 1927 i dubbi svanirono grazie al medico e batteriologo giapponese Hideyo Noguchi, il quale isolò il batterio dal sangue di persone affette sia da febbre di Oroya che da verruca peruviana. Oltre a ciò, il microorganismo venne iniettato in una scimmia, che sviluppò anemia ed eruzioni cutanee. I risultati furono confermati nel 1937 dalla seconda Spedizione di Harvard in Perù, e il batterio venne denominato Bartonella bacilliformis in riconoscimento alle scoperte di Barton.
Metodi di identificazione
L’iter diagnostico della malattia di Carriòn si avvale di tecniche differenti a seconda della fase della patologia, ovvero nella febbre di Oroya le metodiche impiegate sono l’emocoltura e/o l’osservazione microscopica dello striscio di sangue periferico, colorato con Giemsa. Quest’ultimo permette di individuare gli eritrociti parassitati dai batteri (Fig. 9); nonostante l’elevata specificità (96%), l’analisi microscopica ha una bassa sensibilità (da 24 a 36%), in particolare nei casi in cui la patologia è lieve, o durante le fasi subclinica e cronica.

Nella verruca peruviana, l’approccio più indicato, anche se complesso, è l’analisi istopatologica della biopsia cutanea a livello delle lesioni nodulari, colorando le sezioni di tessuto con Giemsa o con colorazione argentica di Warthin-Starry. In questa maniera possiamo dimostrare la presenza del microorganismo nella cute, l’iperplasia delle cellule endoteliali, con nuclei rigonfi, la proliferazione dei capillari e mitosi frequenti.
Oltre alle metodiche che abbiamo appena descritto, è possibile ricorrere ad approcci alternativi, ad esempio i saggi molecolari. Questi si basano soprattutto sull’uso della reazione a catena della DNA polimerasi (PCR), al fine di ricercare specifici geni, per esempio ialB (codificante per la proteina di invasione di tipo B), che ha specificità e sensibilità elevate, i geni per la sintesi della riboflavina (ribC, ribD e ribE), e il gene della subunità 16S dell’RNA ribosomiale. Sia i tre geni della riboflavina che 16S rRNA consentono di distinguere le diverse specie di Bartonella.
Tecniche più semplici e più rapide sono i test sierologici per la ricerca di anticorpi anti-B. bacilliformis, che però non sono ancora largamente disponibili. Vari studi hanno individuato alcuni componenti del batterio che potrebbero rivelarsi dei potenziali antigeni da usare in metodiche come il saggio immuno-assorbente legato ad un enzima (ELISA). Tra gli antigeni identificati abbiamo la proteina autotrasportatore E, le porine A e B, Pap31 (una proteina che lega l’emina) e l’enzima succinil-CoA sintetasi α (SCS-α).
Terapia e profilassi
Per curare l’infezione da B. bacilliformis, è necessario il ricorso ad antibiotici; tra quelli efficaci verso il batterio, abbiamo penicillina, tetraciclina, aminoglicosidi, cefalosporine e cloramfenicolo. Riguardo a quest’ultimo, era considerato il trattamento di scelta per la malattia in fase acuta tra il 1998 e il 2003, ma poiché furono segnalati casi di batteriemia persistente e assenza di effetto terapeutico, venne sostituito con la ciprofloxacina. Se ci troviamo di fronte a febbre di Oroya con anemia grave, è raccomandata anche l’esecuzione di trasfusioni, che aumentano la percentuale di sopravvivenza.
Per la malattia in fase cronica, invece, tra il 1969 e il 1975 il farmaco utilizzato era la streptomicina, che fu rimpiazzato dalla rifampicina, dal momento che mostrava dei risultati migliori.
Per quanto concerne la prevenzione, si consiglia di usare repellenti contro i flebotomi, indossare magliette a maniche lunghe e pantaloni lunghi nei paesi in cui la patologia è endemica. Inoltre, è opportuno evitare attività all’aperto nei momenti della giornata in cui gli insetti vettori sono più attivi, cioè all’alba e al tramonto.
Fonti
- https://microbewiki.kenyon.edu/index.php/Bartonella_bacilliformis
- https://www.sciencedirect.com/topics/agricultural-and-biological-sciences/bartonella-bacilliformis
- https://www.sciencedirect.com/topics/medicine-and-dentistry/bartonella-bacilliformis
- https://www.cdc.gov/bartonella/bartonella-bacilliformis/index.html
- Meritxell Garcia‑Quintanilla, Alexander A. Dichter, Humberto Guerra and Volkhard A. J. Kempf. 2019. “Carrion’s disease: more than a neglected disease”, Parasites Vectors
- Giovanna Mendoza-Mujica and Diana Flores-León. 2015. “Resistencia antimicrobiana de cepas de bartonella bacilliformis procedentes de regiones endémicas de la enfermedad de carrión en el Perú”, Rev Peru Med Exp Salud Publica
- Giuseppe Nicoletti e Vito Mar Nicolosi. 1998. “Dizionario di batteriologia umana normale e patologica”, terza edizione, Menarini
- Cláudia Gomes and Joaquim Ruiz. 2018. “Carrion’s Disease: the Sound of Silence”, American Society for Microbiology
- Paúl Esteben Pachas Chavez. 2001. “Enfermedad de Carriòn (bartonelosis) en el Perù”, Ministerio de la Salud, OGE, INS, Lima, Peru
- Alexander A Dichter, Tilman G Schultze, Anne Wenigmann, Wibke Ballhorn, Andreas Latz, Elif Schlüfter, Palmira Ventosilla, Humberto Guerra Allison, Cesar Ugarte-Gil, Pablo Tsukayama, Volkhard A J Kempf. 2021. “Identifcation of immunodominant Bartonella bacilliformis proteins: a combined in-silico and serology approach”, Lancet Microbe