Secondo la teoria dei due cervelli, elaborata dal dottor Micheal D. Gershon della Columbia University nel 1998, l’intestino è il nostro secondo cervello. A livello intestinale, infatti, sono presenti, oltre ad un vastissimo ecosistema microbico, circa 500 milioni di neuroni intestinali che svolgono molteplici funzioni e stabiliscono una comunicazione diretta con il sistema nervoso centrale (SNC). I neuroni del sistema nervoso enterico (SNE) si raggruppano in plessi gangliari (plesso di Messeiner e plesso di Auerbach) e agangliari; queste cellule nervose regolano l’attività secretoria e motoria del tratto gastrointestinale. Più recente è invece il concetto di psicobatteri, definiti come specifici ceppi batterici probiotici in grado di modulare la comunicazione bidirezionale sull’asse intestino-cervello con l’obiettivo di migliorare le funzioni cognitive, di ridurre i livelli di stress e di ansia, migliorare il nostro umore e attenuare i sintomi della depressione. Metaboliti batterici, ormoni, neurotrasmettitori e citochine modulano questa complessa rete comunicativa.
Microbiota intestinale come driver della comunicazione intestino-cervello
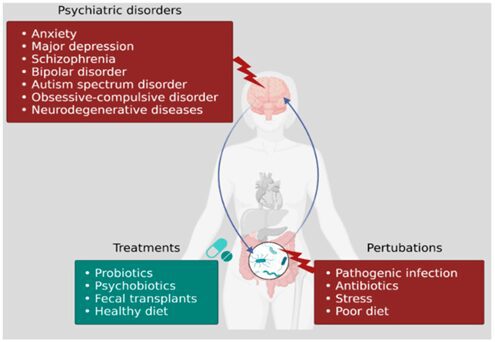
Evidenze scientifiche crescenti concordano sul fatto che l’alterazione del microbiota intestinale, condizione nota come disbiosi, è un fattore che contribuisce alla fisiopatologia di varie malattie neurologiche e psichiatriche, tra cui ansia e depressione, disturbo depressivo maggiore (MDD), schizofrenia, disturbo bipolare, autismo e disturbo ossessivo-compulsivo (OCD). È quindi importante saperne di più sull’effetto che un ecosistema microbico intestinale sano ed equilibrato ha sul SNC, ma anche comprendere l’effetto che la disbiosi ha sulla comunicazione intestino-cervello.
Una rete di cellule enteroepiteliali (EEC) lungo la parete intestinale media la comunicazione bidirezionale tra SNC e tratto gastrointestinale. Il nervo vago è il principale componente nervoso che collega intestino e cervello e comunica con l’epitelio intestinale per esercitare effetti ansiolitici e antidepressivi. Studi condotti su topi con infiammazione intestinale e comportamenti ansiosi hanno mostrato una riduzione dell’ansia in seguito al trattamento con i probiotici B. longum e L. rhamnosus; questi effetti non sono stati osservati in presenza di compromissione del nervo vago nei modelli animali.

[Fonte: Gut Bacteria and Neurospychiatric Disorders, T. Dicks et al., 2021]
Gli SCFAs promuovono la salute intestinale e mentale
Il microbiota intestinale può fermentare i carboidrati non digeribili dall’ospite in acidi grassi a catena corta (SCFAs) come acetato, lattato, propionato e butirrato. Gli SCFAs modulano l’integrità della barriera emato-encefalica che protegge il cervello dai composti chimici che circolano nel sangue, influenzando in particolare la maturazione della microglia. Il butirrato induce l’espressione delle proteine presenti a livello delle giunzioni strette cellulari claudina-2, occludina e cingulina per minimizzare la traslocazione dei microrganismi e dei loro antigeni attraverso la barriera intestinale. Una distruzione della barriera invece favorisce questa traslocazione dal lume intestinale al sistema circolatorio stimolando la secrezione di citochine pro-infiammatorie (IL-6, IL-1b), fattore di necrosi tumorale α (TNF-α) e proteina C reattiva. Diversi studi hanno mostrato che un incremento di queste citochine porta a cambiamenti nell’umore e nel comportamento; difetti nella barriera gastro-intestinale causano disturbi comportamentali legati allo sviluppo neurologico nei roditori.
Inoltre, il butirrato agisce come inibitore delle istone deacetilasi (HDAC). Questa è un’osservazione importante, poiché studi condotti su animali con inibitori dell’HDAC hanno mostrato risultati promettenti nel trattamento del trauma cerebrale e della demenza. La sovrapproduzione di HDAC è stata associata a disturbi neurologici come il morbo di Parkinson, la schizofrenia e la depressione. D’altra parte, un aumento degli istoni acetilati (ACH) promuove l’espressione del gene BDNF (fattore neurotrofico cerebrale) nella corteccia frontale e nell’ippocampo, stimolando lo sviluppo cerebrale. Livelli ridotti di BDNF sono legati a cambiamenti di umore, depressione e ansia. Studi su topi germ-free hanno mostrato livelli più bassi di espressione di BDNF nell’ippocampo. Risultati simili sono stati riportati in topi trattati con antibiotici. Il trattamento dei disturbi neurologici deve pertanto prendere in considerazione il controllo dei livelli di SCFA e HDAC. Ciò sottolinea l’importanza di un microbiota intestinale ben equilibrato.
Inoltre, gli SCFAs influenzano lo sviluppo di una varietà di cellule immunitarie: inibiscono lo sviluppo delle cellule dendritiche dalle cellule staminali del midollo osseo, migliorano la differenziazione delle cellule T in cellule T regolatorie antinfiammatorie, regolano la maturità e la funzione della microglia e influenzano anche l’attività delle cellule immunitarie. Il butirrato riduce l’espressione di mediatori pro-infiammatori nei macrofagi durante la risposta immunitaria promuovendo l’espressione dell’IL-10 antinfiammatoria.
Il microbiota intestinale regola i livelli di Serotonina
Sono stati individuati oltre 50 neurotrasmettitori utilizzati dai neuroni intestinali (o neuroni enterici, NE) nella comunicazione sinaptica, molti di questi sono in comune con il SNC, come acetilcolina, dopamina e serotonina. La serotonina (o 5-idrossitriptamina, 5-HT), più comunemente nota come ormone della felicità è sintetizzata a partire dall’amminoacido triptofano principalmente da cellule enterocromaffini dell’epitelio intestinale, dai neuroni enterici ma anche da abitanti batterici del tratto gastrointestinale. Questo ormone svolge molte funzioni biologiche, che vanno dalla regolazione dell’appetito, della temperatura corporea, del sonno, della sessualità, delle funzioni cognitive e del tono dell’umore. Alterazioni nei pathway biochimici in cui è coinvolta la serotonina sono associate a numerosi disturbi psichiatrici, anche se oggi la comunità scientifica si è allontanata dal concetto della serotonina come causa della depressione, come sottolineato anche nel manuale dell’Associazione Psichiatrica Americana.
La popolazione microbica intestinale regola i livelli della 5-HT, innanzitutto perché specie come Lactococcus, Lactobacillus, Streptococcus, Morganella, Klebsiella, Hafnia, Bacteroides, Bifidobacterium, Propionibacterium, Eubacterium, Roseburia e Prevotella sono in grado di produrla, ma anche perché gli SCFAs ne regolano direttamente la produzione, dal momento in cui inducono l’espressione della triptofano idrossilasi (TPH1) enzima che permette alle cellule enterocromaffini di convertire il triptofano in serotonina. Bassi livelli di serotonina conducono ad una minor espressione di occludina e di conseguenza ad un aumento della permeabilità della barriera intestinale.

Il ruolo dell’infiammazione nella depressione e nell’ansia
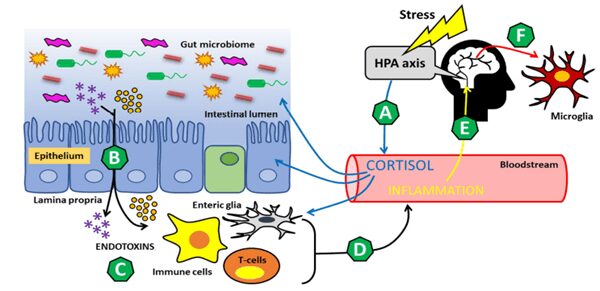
Numerosi studi su pazienti e animali hanno mostrato il ruolo dell’infiammazione e dello stress nell’eziologia dell’ansia e della depressione; ai pazienti depressi si associa un incremento di citochine pro-infiammatorie rispetto ai controlli sani. L’infiammazione indotta dallo stress è associata a disturbi neuropsichiatrici, e c’è un evidente collegamento tra una condizione di disbiosi intestinale e questi disturbi. Infatti, una ridotta biodiversità del microbiota, ambiente pro-infiammatorio intestinale, aumento della permeabilità intestinale, morte neuronale e attivazione della microglia sono responsabili di un’alterazione significativa dei percorsi neuronali, immunitari e infiammatori che caratterizzano l’asse microbiota-intestino-cervello.
Lo stress induce l’attivazione dell’asse ipotalamo-ipofisi-surrene (HPA), principale coordinatore della risposta neuroendocrina allo stress, che comporta la produzione di cortisolo (per l’appunto noto come ormone dello stress) da parte delle ghiandole surrenali; l’iperattivazione dell’asse HPA conduce ad un’aumentata permeabilità intestinale. Ciò consente alle endotossine batteriche di fuoriuscire dal lume intestinale ed entrare nella circolazione sanguigna, dando avvio ad una reazione immunitaria. Questa infiammazione periferica può quindi diffondersi al cervello e avere conseguenze deleterie sulla salute mentale.
Innanzitutto, la microglia attivata contribuisce alla tossicità neuronale rilasciando specie reattive dell’azoto e dell’ossigeno che danneggiano le cellule epiteliali cerebrali e compromettono la barriera emato-encefalica. Le cellule della microglia si occupano della prima difesa immunitaria del SNC il cui sviluppo e attività sono influenzati da cambiamenti del microbiota intestinale. Inoltre, la sintesi dei neurotrasmettitori monoaminici (serotonina, dopamina e norepinefrina) è compromessa in uno stato infiammatorio perché le citochine danneggiano l’attività della tetraidrobiopterina, un cofattore enzimatico essenziale per la sintesi delle monoamine. Complessivamente, la neuro-infiammazione promuove un ambiente tossico e dannoso per la salute mentale.
Gli psicobiotici hanno la capacità di migliorare la salute mentale
I probiotici sono batteri presenti in alimenti o integratori in grado di ripristinare l’equilibrio del microbiota intestinale, i prebiotici sono fibre solubili che fungono da nutrimento per i batteri probiotici. Il termine psicobiotici è stato recentemente introdotto per indicare i sottotipi di probiotici in grado di modulare l’asse cervello-intestino-microbiota migliorando la salute mentale. Numerosi studi sia su modelli animali che pazienti hanno mostrato come l’integrazione probiotica permette di correggere lo stato di disbiosi, di smorzare la risposta allo stress normalizzando l’attività dell’asse HPA, ridurre la permeabilità intestinale ripristinando l’integrità della barriera, ridurre l’infiammazione e migliorare la condizione di ansia e depressione. In una metanalisi del 2019, i ricercatori hanno confrontato i risultati di 34 studi clinici controllati suggerendo un ruolo antidepressivo e ansiolitico dei probiotici; pertanto, le evidenze scientifiche mostrano come l’integrazione probiotica può essere uno strumento terapeutico promettente nella gestione dello stress e dell’ansia in pazienti con disbiosi.
FMT: un trattamento promettente per la depressione e l’ansia
Un nuovo trattamento biologico per i disturbi intestinali con disbiosi è il trapianto di microbiota fecale (FMT), il cui obiettivo è un ripristino di un microbiota sano nel paziente ricevente. Attualmente l’FMT è una pratica clinica utilizzata nei pazienti con infezione da Clostridium difficile antibiotico-resistente, ma sono in corso numerosi studi clinici per espandere questa pratica anche ad altre condizioni patologiche quali infezioni da altri batteri antibiotico-resistenti (MDR), sindrome dell’intestino irritabile (IBS), malattia infiammatoria intestinale (IBD), encefalopatia epatica (HE), pazienti oncologici per migliorare la risposta all’immunoterapia e ridurne gli effetti collaterali.
A supporto dell’idea che i cambiamenti nella composizione del microbiota intestinale compromettono la salute mentale, in uno studio pubblicato su Science Translational Medicine il trapianto di microbiota da pazienti con IBS a topi germ-free ha determinato alterazioni del tempo di transito intestinale, iperattivazione immunitaria e comportamenti ansiosi nei topi trapiantati. Una review sistematica pubblicata nel 2020 ha analizzato 28 studi il cui obiettivo era valutare l’effetto dell’FMT sul benessere psichiatrico in pazienti e/o animali con stress cronico, alcolismo, depressione, IBS, dolore neuropatico; alcuni di questi studi inclusi erano interamente clinici, altri preclinici con donatori umani, altri interamente preclinici. Tutti gli studi hanno riscontrato una diminuzione dei sintomi e dei comportamenti depressivi e ansiosi in seguito al trapianto di microbiota sano. È stato invece riscontrato l’inverso, ovvero comparsa di sintomi e comportamenti depressivi e ansiosi, in seguito al trapianto di microbiota da donatori psichiatrici a riceventi sani.
Conclusioni
Il meccanismo d’azione attraverso il quale la modulazione del microbiota intestinale influenzi il sistema nervoso e il comportamento deve ancora essere completamente compreso. Allo stato della ricerca attuale le principali ipotesi su come il microbioma influenzi la salute mentale includono cambiamenti nella produzione di serotonina, meccanismi d’azione degli acidi grassi a catena corta (SCFA) che influenzano la maturazione della microglia, favoriscono l’integrità della barriera intestinale, promuovono l’espressione del fattore neurotrofico neuronale (BDNF) e hanno proprietà antinfiammatorie.
Ansia, stress, depressione, sindrome bipolare sono alcune delle più frequenti co-morbidità rilevabili in pazienti affetti da disturbi dell’interazione intestino-cervello (FGID); pertanto, la gestione di questi pazienti dovrebbe prevedere, oltre che i trattamenti farmacologici, anche strategie rivolte all’equilibrio del microbiota intestinale.
Debora Rondinella
Bibliografia
- Dicks, Leon M T et al. “Gut Bacteria and Neuropsychiatric Disorders.” Microorganisms vol. 9,12 2583. 14 Dec. 2021, doi:10.3390/microorganisms9122583 Gut Bacteria and Neuropsychiatric Disorders – PubMed (nih.gov)
- De Palma G, et al. ‘’Transplantation of fecal microbiota from patients with irritable bowel syndrome alters gut function and behavior in recipient mice’’. Sci Transl Med. 2017 Mar 1;9(379):eaaf6397. doi: 10.1126/scitranslmed.aaf6397. PMID: 28251905.Transplantation of fecal microbiota from patients with irritable bowel syndrome alters gut function and behavior in recipient mice – PubMed (nih.gov)
- Chinna Meyyappan A, et al. ‘’Effect of fecal microbiota transplant on symptoms of psychiatric disorders: a systematic review’’. BMC Psychiatry. 2020 Jun 15;20(1):299. doi: 10.1186/s12888-020-02654-5. PMID: 32539741; PMCID: PMC7294648.
- Peirce JM, et al. ‘’The role of inflammation and the gut microbiome in depression and anxiety’’ J Neurosci Res. 2019 Oct;97(10):1223-1241. doi: 10.1002/jnr.24476. Epub 2019 May 29. PMID: 31144383.
- Stefano GB, et al. ‘’Gut, Microbiome, and Brain Regulatory Axis: Relevance to Neurodegenerative and Psychiatric Disorders’’ Cell Mol Neurobiol. 2018 Aug;38(6):1197-1206. doi: 10.1007/s10571-018-0589-2. Epub 2018 May 25. PMID: 29802603.
- Lo sapevi che il microbiota intestinale comunica con il cervello? – Microbiologia Italia
- Immagine in evidenza: Open Clipart