Caratteristiche
In tassonomia con il termine Methanobacterium si indica un genere di microrganismi appartenenti alla famiglia delle Methanobacteriaceae, costituito da alcuni dei primi metanogeni idrogenotrofici conosciuti. Contrariamente a ciò che si potrebbe dedurre dalla desinenza -bacterium, questo genere non appartiene al dominio dei Batteri ma bensì al dominio degli Archea.
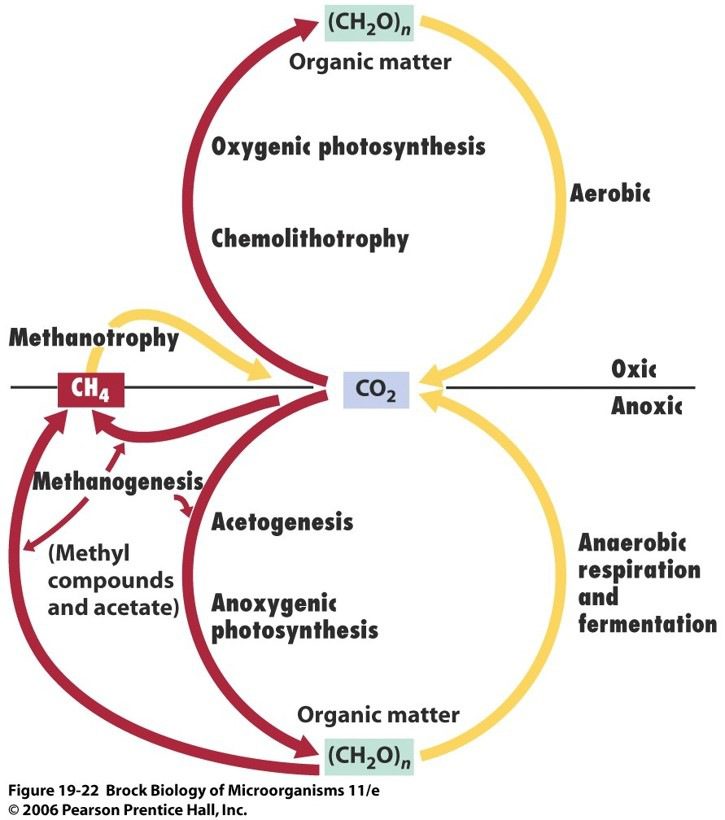
Tutti i metanogeni condividono principalmente due caratteristiche fisiologiche comuni, vale a dire la crescita strettamente anaerobica e la produzione di metano come prodotto finale del metabolismo energetico. Per tal motivo svolgono un ruolo chiave nell’emissione globale di CH4.
Inizialmente, cosi come riportato nell’edizione del 2001 del Bergey’s Manual of Systematic Archaea and Bacteria, tale genere includeva soltanto otto specie: M. formicicum (designata come la specie tipo), M. alcaliphilum , M. bryantii, M. palustre, M. ivanovii , M. subterraneum, M. uliginosum ed M. espanolae.
Da allora, sono state incluse altre 12 specie, quali: M.lacus, M.congolense, M.oryzae, M.kanagiense, M.arcticum, M.veterum, M.aarhusense, M.petrolearium M. ferruginis, M. beijingense, M. movens ed M. flexile.
Altre specie sono rappresentate da: M. movilense e da M. thermaggregans.
Tassonomia
| DOMINIO | Archaea |
| REGNO | Euryarchaeota |
| PHYLUM | Euryarchaeota |
| CLASSE | Methanobacteria |
| ORDINE | Methanobacteriales |
| FAMIGLIA | Methanobacteriaceae |
| GENERE | Methanobacterium |
Genoma e metabolismo
Le diverse specie presentano un’ampia gamma e variazione nelle caratteristiche fenotipiche e genomiche, incluso le diverse condizioni di crescita e il contenuto in moli di G + C del DNA che varia tra 29,4% e 61% .
È stato riscontrato che la maggior parte dei membri del genere Methanobacterium cresce bene a pH neutro, tuttavia ci sono pochi organismi alcalofili o acidofili.
M.espanolae ad esempio è l’unico acidofilo, in grado di tollerare bassi livelli di pH ( 4,6-7) e mostra un otptimum di crescita a pH 5,6-6,2. Per contro, M.alcaliphilum mostra una crescita ottimale in un intervallo di pH compreso tra 8,1 e 9,1 e si trova frequentemente in sedimenti lacustri alcalini. M.subterrenum invece è un microrganismo alotollerante, ossia in grado di crescere e tollerare valori di pH compresi tra 7.8 – 8.8.
Tutte le specie sono in grado di ridurre la CO2 e di generare metano (CH4) mediante l’ossidazione di H2. Alcuni ceppi possono utilizzare il formiato, alcoli secondari, o altri composti. Per esempio il nome di M. formicicum sottolinea proprio la sua capacità di utilizzare il formiato come fonte di carbonio. Tuttavia questo organismo è metabolicamente molto versatile e può utilizzare anche acetato, carboidrati, amminoacidi, etanolo, metanolo, propionato, butirrato e lattato.
Altri organismi in grado di utilizzare il formiato, sono: Methanobacterium espanolae, Methanobacterium ivanovii, Methanobacterium uliginosum, Methanobacterium congolense, Methanobacterium bryantii e Methanobacterium aarhusense.
Particolarmente interessante è il metabolismo di M.palustre governato da 2 processi alternativi. Nel primo caso, la CO2 ossida l’H2 per produrre metano e acqua; l’H2 funge da donatore di elettroni mentre CO2 funge da accettore. Il percorso alternativo, utilizza un enzima, nello specifico un’alcol deidrogenasi, per convertire l’anidride carbonica e il 2-propanolo. Questa reazione produce metano e acetone. In questo caso, gli idrogeni legati nella molecola di 2-propanolo sono i donatori di elettroni e la CO2 funge da accettore. (Fig. 1)
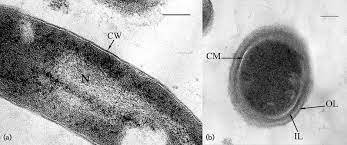
Immagini al microscopio
Da un punto di vista morfologico, le cellule appaiono a forma di bastoncini dritti o ricurvi, aventi un diametro di 0,5-1,0 μm. La spessa parete cellulare, esterna alla membrana citoplasmatica, appare costituita da pseudomurina (o pseudopeptidoglicano). Quest’ultima si differenzia per composizione chimica dal peptidoglicano comunemente presente nella parete cellulare batterica.
Gli organismi non mostrano motilità e possono essere presenti o meno strutture note come fimbrie. Un’eccezione a ciò è rappresenta da M.movens così denominato proprio in virtù della sua capacità di muoversi mediante l’utilizzo di uno o due flagelli polari.
Le cellule possono assemblarsi formando catene, o più frequentemente filamenti, la cui lunghezza variabile può, in alcuni casi, essere strettamente dipendente dal substrato di crescita. Ad esempio, M.flexile forma lunghe catene quando cresce in presenza di formiato (50 mM) o di alta pressione di H2, mentre le cellule si dispongono singolarmente in condizioni di bassa pressione di H2. Invece M. thermaggregans, è noto per la sua capacità di formare grandi aggregati costituiti da fasci di lunghe catene intrecciate fra loro (Fig.2)

Particolarmente interessante è la strategia adottata da Methanobacterium arcticum in condizioni di carenza dei nutrienti. In questo caso la cui cellula assume una forma coccoide simile ad una cisti in cui il citoplasma si addensa e si osservavano strati superficiali differenziati. La parete cellulare spessa 10-11 nm nelle cellule vegetative, raggiunge uno spessore di ben 50 nm nelle cellule coccoidi (Fig.3) .
Ecologia
I membri del genere Methanobacterium sono strettamente anaerobici e, a seconda della specie, possono essere mesofili o termofili. Per tal motivo, pur essendo ubiquitari in natura, si ritrovano più frequentemente in posti decisamente inospitali per altre forme di vita, come ad esempio ambienti caldi e nicchie prevalentemente anossiche. Sono infatti isolati da digestori anaerobici, da fanghi di depurazione, letame, acque sotterranee, acque di rocce petrolifere ma anche dall’apparato gastrointestinale di alcuni animali.
Ad esempio M.formicicum si riscontra abitualmente nei digestori anaerobici o nei sedimenti di acqua dolce. Degno di nota è che, organismi di questa specie possono essere presenti in numero esiguo nel rumine dei bovini o come endosimbionti in protozoi anerobici. Altre specie, come M.oryzae e M.kanagiense sono isolate abitualmente da risaie, nelle Filippine ed in Giappone, rispettivamente.
Altre ancora invece, sono state denominate facendo riferimento proprio al luogo da cui sono state riscontrate. Questo è il caso di M.paludis e di M.palustre isolati da paludi (Fig. 4 ), o di M. petrolearium, isolato dai fanghi depositati in un serbatoio di stoccaggio del petrolio greggio, di M.lacus ritrovato nel sedimento profondo del lago meromittico di Pavin, di M.arcticum isolato dai sedimenti di permafrost dell’Olocene della pianura di Kolyma nell’Artico russo ed infine di M.movilense isolato dal sedimento di un lago sotterraneo a Movile Cave (in Romania).

Metodi di identificazione
I membri de genere Methanobacterium possono essere isolati direttamente dai loro habitat naturali e successivamente vengono inoculati all’interno di provette contenenti i terreni di coltura.
Sono disponibili diversi mezzi di coltura per l’isolamento dei metanobatteri. La maggior parte dei media è costituita da estratto di lievito in combinazione con composti quali xilosio, triptone e glucosio. Inoltre, gli antibiotici in combinazione con sostanze di arricchimento possono essere utili come agenti selettivi nella separazione e nell’identificazione delle diverse specie.
Le colture pure sono ottenute mediante una serie di diluizioni. Le colonie su agar appaiono piccole, rotonde e di colore bianco grigiastro o bianco tannino, con bordi interi e ampiamente diffusi.
Livia Sabetta
Fonti
- https://www.microbiologyresearch.org/content/journal/ijsem/10.1099/ijs.0.059964-0?crawler=true#r31
- https://www.microbiologyresearch.org/content/journal/ijsem/10.1099/ijs.0.027540-0?crawler=true
- https://link.springer.com/referenceworkentry/10.1007%2F978-3-642-38954-2_411
- https://www.microbiologyresearch.org/content/journal/ijsem/10.1099/ijs.0.034538-0?crawler=true
- https://www.sciencedirect.com/science/article/pii/S2451943X17301515
- https://en.wikipedia.org/wiki/Methanobacterium
Crediti immagini
- Immagine in evidenza: https://apbiologywarrenkelley.weebly.com/methanobacterium.html
- Immagine 1: https://microbewiki.kenyon.edu/index.php/File:Wiki6.jpg
- Immagine 2 : https://www.microbiologyresearch.org/content/journal/ijsem/10.1099/ijs.0.000210?crawler=true
- Immagine 3: https://www.microbiologyresearch.org/content/journal/ijsem/10.1099/ijs.0.021311-0?crawler=true