Gli organoidi intestinali
Gli organoidi sono colture di cellule staminali adulte o pluripotenti (embrionali o indotte) in grado di differenziarsi e auto-assemblarsi in maniera tridimensionale, in modo da riprodurre la struttura e la funzione di un organo.
Come potrebbero inserirsi questi “mini-organi” nell’ottica dello studio dei microrganismi? La potenzialità principale dell’utilizzo di questo recente sistema modello nel campo della microbiologia è l’indagine delle interazioni tra l’ospite e il microrganismo, soprattutto a livello di un organo popolato da miliardi di microrganismi: l’intestino.
La conoscenza a livello molecolare delle relazioni tra il microbiota e quest’organo è essenziale, infatti, per delucidare ad esempio le influenze della flora batterica sulla salute e fisiologia dell’ospite, o per determinare nuovi target terapeutici per modulare la riparazione dell’intestino in seguito ad un danno fisico o infettivo. Tuttavia, la caratterizzazione approfondita dei meccanismi sfruttati sia da organismi patogeni che commensali è stato finora limitato dall’uso delle colture cellulari 2D e dai modelli murini. Le colture bidimensionali impediscono una fedele modellizzazione dei
meccanismi patogenetici, dato che non riproducono l’architettura dell’epitelio intestinale né comprendono le diverse linee cellulari dell’intestino, come invece fanno gli organoidi intestinali. I modelli murini sono più fedeli nel rappresentare la fisiologia degli organi, ma portano con sé le problematiche legate alle differenze interspecie e non possono ospitare microrganismi con un tropismo limitato alla specie umana. Per questi motivi, gli organoidi intestinali possono fornire un’alternativa complementare ai precedenti modelli nello studio delle interazioni tra microrganismi e il corpo umano.
Struttura degli organoidi intestinali e co-colture con microrganismi
Questo tipo di organoide è un monostrato di cellule epiteliali intestinali polarizzate, che assume una struttura tridimensionale attorno ad un lume, riproducendo in vitro l’architettura dell’epitelio intestinale. In questo modo, la porzione apicale delle cellule, con i tipici villi, si viene a trovare internamente, mentre quella basolaterale è esterna, a contatto con il medium.

Per instaurare una co-coltura, i microrganismi si devono porre a contatto con la porzione apicale delle cellule, quindi si possono introdurre nel lume tramite tecniche di microiniezione, oppure si può aprire l’organoide e coltivarlo in forma di monostrato. Un’ulteriore alternativa è l’inversione della polarità dell’organoide, esponendo i villi all’esterno, come è stato provato da Co et al (2019).

https://pubmed.ncbi.nlm.nih.gov/32807924/]
Relazioni con il microbiota intestinale
Gli organoidi intestinali sono stati utili, ad esempio, per meglio evidenziare come il contatto continuo tra cellule intestinali dell’ospite eucariotico e i procarioti ha portato ad una coevoluzione. È così che alcuni recettori di riconoscimento dei pattern molecolari dei patogeni (PRR), normalmente associati all’immunità innata e all’invio di un segnale d’allarme e infiammazione per la presenza di un patogeno, hanno assunto il duplice ruolo di sensori per i messaggi provenienti dai microrganismi commensali, necessari per mantenere l’omeostasi tissutale.
A riguardo, si è osservato che la porzione endotossinica del lipopolisaccaride batterico (LPS) interagisce con il recettore TLR4 delle cellule staminali della cripta, diminuendo il loro tasso di proliferazione e promuovendo il loro differenziamento verso la linea delle cellule mucipare. Un ruolo regolatorio quasi opposto, invece, è quello del muramil dipeptide (MDP), un motivo del peptidoglicano. Questo, infatti, attivando NOD2 (nucleotide-binding oligomerization domain-containing protein 2), induce l’eliminazione dei mitocondri danneggiati da eccesso di ROS (intermedi reattivi dell’ossigeno), favorendo la protezione e sopravvivenza delle cellule. Questo risultato potrebbe essere utile in clinica, per i soggetti che assumono farmaci antitumorali che producono molti ROS, al fine di affiancare un trattamento atto ad aumentare la presenza di MDP e favorire la rigenerazione tissutale.
Organoidi come modello per lo studio di infezioni virali
Le co-colture di organoidi non sono state sfruttate solo per investigare meglio meccanismi batterici, ma hanno anche fornito la possibilità di coltivazione, prima esclusa, per certi virus. È il caso del Norovirus, uno dei più comuni responsabili delle gastroenteriti in tutto il mondo, per il quale la mancanza di un sistema di coltivazione riproducibile ha impedito di conoscere approfonditamente i meccanismi di replicazione e patogenesi per 40 anni. Nel 2016, Ettayebi e collaboratori hanno messo a punto un sistema utilizzando enteroidi umani in forma di monostrato, che ha permesso di coltivare con successo vari ceppi di norovirus, tra cui il più diffuso GII.4. Più recentemente, dallo scoppio della pandemia da SARS-CoV-2, gli organoidi hanno soddisfatto l’urgente necessità di trovare adeguati modelli cellulari per lo studio di questo virus, poiché le linee cellulari trasformate hanno fallito nel rappresentare fedelmente la dinamica dell’infezione. Considerando che il virus è in grado di colpire anche l’intestino e che gli enterociti esprimono il recettore per la sua entrata ACE2 (angiotensin converting enzyme 2), degli organoidi intestinali umani sono stati infettati con SARS-CoV-2.
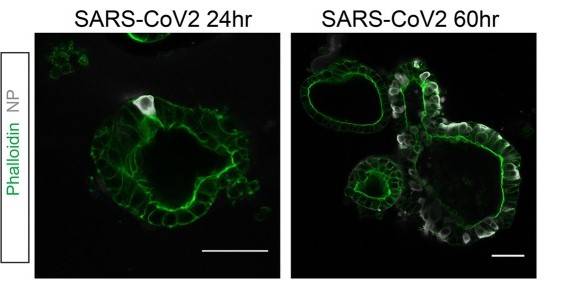
https://pubmed.ncbi.nlm.nih.gov/32358202/]
Successivamente sono stati analizzati tramite titolazione del virus con qRT-PCR (Real Time-PCR), con cui si è rilevata la sua presenza, dimostrando la possibilità di usare questo sistema di coltivazione per la sua replicazione. In questo modo, si è potuto esplorare meglio la risposta delle cellule del colon all’infezione e anche testare possibili farmaci inibitori del virus.
Cosa ci aspetta in un futuro prossimo
Vista la rapida diffusione di questo sistema di coltivazione in un periodo relativamente breve, e la grande versatilità delle sue applicazioni, è prevedibile che gli organoidi acquisiscano sempre più rilevanza. Grazie al continuo miglioramento di questa piattaforma, gli organoidi potranno fornire un valido aiuto anche nella modellizzazione delle malattie infettive e nell’indagine delle interazioni con i microrganismi commensali.
Fonti
- A High-Throughput Organoid Microinjection Platform to Study Gastrointestinal Microbiota and Luminal Physiology: https://pubmed.ncbi.nlm.nih.gov/30123820/
- Use of organoids to study regenerative responses to intestinal damage:
https://pubmed.ncbi.nlm.nih.gov/31589468/ - Lipopolysaccharide from Crypt-Specific Core Microbiota Modulates the Colonic Epithelial Proliferation-to-Differentiation Balance: https://pubmed.ncbi.nlm.nih.gov/29042502/
- Controlling Epithelial Polarity: A Human Enteroid Model for Host-Pathogen Interactions:
https://pubmed.ncbi.nlm.nih.gov/30811997/ - Innate immune receptor NOD2 mediates LGR5+ intestinal stem cell protection against ROS cytotoxicity via mitophagy stimulation: https://pubmed.ncbi.nlm.nih.gov/31919280/
- Replication of human noroviruses in stem cell-derived human enteroids:
https://pubmed.ncbi.nlm.nih.gov/27562956/ - SARS-CoV-2 44 productively infects human gut enterocytes:
https://pubmed.ncbi.nlm.nih.gov/32358202/ - https://www.microbiologiaitalia.it/altro/i-primi-embrioni-chimera-scimmia-uomo-tra-medicina-rigenerativa-e-limiti-alla-ricerca/
- Fonte immagine in evidenza: https://pubmed.ncbi.nlm.nih.gov/25946596/
Crediti immagini
- Immagine in evidenza: https://pubmed.ncbi.nlm.nih.gov/25946596/
- Figura 1: https://pubmed.ncbi.nlm.nih.gov/29787039/ (cap. 22)
- Figura 2: https://pubmed.ncbi.nlm.nih.gov/32807924/
- Figura 3: https://pubmed.ncbi.nlm.nih.gov/32358202/