Principio
Il CLED (Cysteine-Lactose-Electrolyte-Deficient Agar) (Fig. 1) è un terreno di coltura differenziale, sfruttato per l’isolamento e il conteggio dei batteri delle urine. Supporta la crescita dei microrganismi urinari (siano essi patogeni o derivanti da contaminazione) e inibisce lo swarming (sciamaggio) di Proteus spp. grazie alla carenza di elettroliti nel mezzo.

Composizione e preparazione
I nutrienti del CLED agar sono costituiti principalmente da peptoni di gelatina e di caseina, e da estratto di manzo. Inoltre, il lattosio rappresenta la principale fonte energetica per i microrganismi capaci di utilizzarlo tramite fermentazione. Gli organismi che fermentano il lattosio, infatti, liberano acidi che inducono il viraggio del colorante blu di bromotimolo dal verde/blu al giallo.
La cisteina permette lo sviluppo di colonie localizzate di coliformi mentre la carenza di elettroliti blocca lo sciamaggio delle differenti specie di Proteus che, in questo modo, possono essere valutate quantitativamente come altri patogeni urinari.
La formula per litro d’acqua purificata del CLED agar è riportata in Tabella 1:
| Ingredienti | Quantità (g) |
| Digerito pancreatico di gelatina | 4,0 |
| Digerito pancreatico di caseina | 4,0 |
| Estratto di manzo | 3,0 |
| Lattosio | 10,0 |
| L-cisteina | 0,128 |
| Blu di bromotimolo | 0,02 |
| Agar | 15,0 |
Il pH del mezzo dovrebbe essere di 7,3 +/- 0,2, e la formula può essere corretta in base alle esigenze dei criteri di performance.
Metodo
Il CLED agar può essere utilizzato per l’enumerazione e il differenziamento esclusivo dei patogeni urinari.
Si procede quindi recuperando un campione di urina non diluita e ben mescolata con anse da 0,01-0,001 ml. L’urina deve essere prelevata con metodica sterile e seminata non oltre le 2 ore dal suo prelievo se non refrigerata. Se refrigerata può essere utilizzata entro, e non oltre, le 24 h dal prelievo per evitare lo sviluppo di microrganismi contaminanti.
Il campione va poi seminato facendo una riga al centro della piastra, riga da cui si può diffondere ulteriormente l’inoculo.
Il terreno va incubato a 35 +/- 2°C in atmosfera aerobia. Dopo 18-24 h sarà possibile verificare la crescita, la pigmentazione, il colore delle colonie e l’inibizione dello swarming di Proteus spp.
Risultati e immagini
La tipica morfologia delle colonie sul CLED agar è descritta in Tabella 2:
| Microrganismo | Risultati della crescita |
| Escherichia coli | Colonie: gialle e opache Terreno: giallo |
| Klebsiella, Enterobacter | Colonie: gialle-blu/biancastre e mucose Terreno: giallastro |
| Proteus | Colonie: blu e lucide Terreno: blu/verde |
| Pseudomonas aeruginosa | Colonie: verdi con superficie opaca e bordi rugosi Terreno: blu |
| Enterococchi | Colonie: gialle e piccole (0,5 mm di diametro) Terreno: giallo |
| Staphylococcus aureus | Colonie: giallo scuro, uniformi Terreno: giallo |
| Stafilococchi coagulasi negativi | Colonie: giallo pallido, più opache che quelle di Enterococcus faecalis |
Le immagini corrispondenti sono visibili in Fig. 2, 3 e 4:


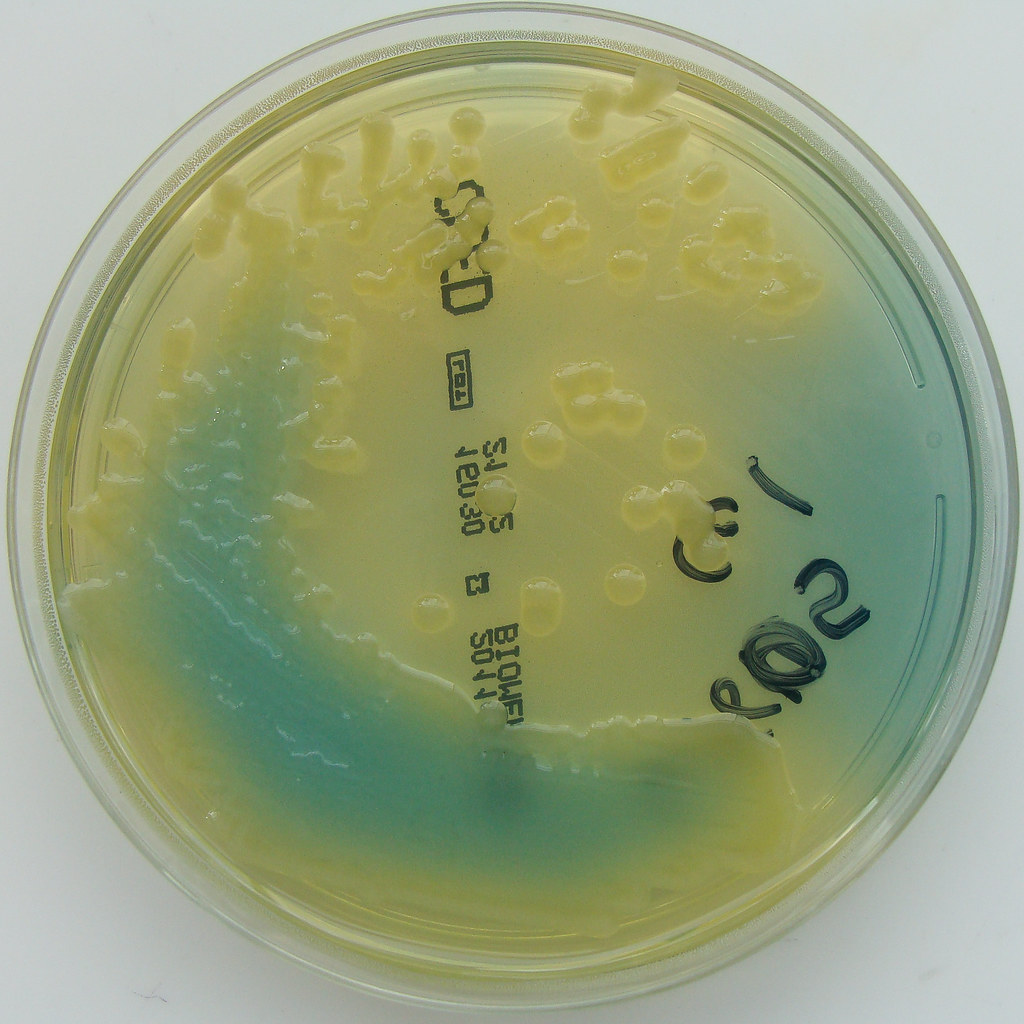
Come riportato in Tabella 2, terreno giallastro con colonie gialle-blu e mucose [Fonte: Flickr]
Calcoli e interpretazione dei risultati
Qui viene descritto il calcolo utile per il conteggio delle colonie (CFU) sul terreno.
Se viene utilizzata un’ansa da 0,01 ml, ogni colonia risultante rappresenterà 100 CFU/ml di urina.
Se viene utilizzata un’ansa da 0,001 ml, ogni colonia risultante corrisponderà a 1000 CFU/ml di urina.
Le linee guida correnti suggeriscono che, per singolo isolato, una densità >/= di 105 indica un’infezione, mentre una densità inferiore a 105 CFU/ml indica una contaminazione uretrale/vaginale.
I microrganismi contaminanti generalmente sono presenti in numero piuttosto basso e con morfologia delle colonie decisamente diversa tra di loro.
Limitazioni
Il terreno è indicato esclusivamente per il conteggio e il differenziamento di microrganismi aerobi come le Enterobacteriaceae e Pseudomonas, e batteri Gram-positivi non fermentanti come gli enterococchi, gli stafilococchi e Candida spp.
Gli streptococchi e altri microrganismi che richiedono la presenza di siero per svilupparsi, potrebbero non crescere a sufficienza sul CLED agar, o comunque necessitare di un passaggio di coltura anteriore in agar sangue.
Alcuni patogeni genito-urinari, come Neisseria gonorrhoae, Gardnerella vaginalis, Chlamydia, Ureaplasma e altri microrganismi fastidiosi, non si sviluppano su questo terreno di coltura.
Tra l’altro, nonostante il viraggio del colorante dovuto alla fermentazione del lattosio possa essere utilizzato per discriminare differenti microrganismi, è sempre consigliabile apportare altri test (biochimici e sierologici) per ottenere una piena conferma.
Controllo qualità
Per il controllo qualità si possono sfruttare i microrganismi riportati in Tabella 3:
| Microrganismo | Risultati della crescita |
| Escherichia coli ATCCTM 25922 | Crescita visibile, colonie gialle, terreno giallo |
| Proteus vulgaris ATCC 8427 | Crescita visibile, colonie dall’incolore al blu, inibizione dello sciamaggio |
| Enterococcus faecalis ATCC 29212 | Crescita visibile, colonie dall’incolore al giallo, terreno giallo |
| Staphylococcus aureus ATCC 25923 | Crescita visibile, colonie piccole e gialle, terreno giallo |
| Staphylococcus saprophyticus ATCC 15305 | Crescita visibile, colonie piccole, dal bianco al giallo, terreno giallo |
| Non incoulato | Terreno dal verde al blu/verde |
Anche per il controllo qualità, le piastre vanno incubate a 35 +/- 2°C in atmosfera aerobia. Devono essere controllate dopo 18-24 h per verificare la crescita, la pigmentazione, la dimensione delle colonie e l’inibizione dello sciamaggio di Proteus spp.
Fonti
- BD Scheda Tecnica;
- Sandys, G.H. 1960. A new method of preventing swarming of Proteus sp. with a description of a new medium suitable for use in routine laboratory practice. J. Med. Lab. Technol. 17:224-233;
- Clarridge, J.E., M.T. Pezzlo, and K.L. Vosti. 1987. Cumitech 2A, Laboratory diagnosis of urinary tract infections. Coordinating ed., A.S. Weissfeld. American Society for Microbiology, Washington, D.C
- Barry, A.L., P.B. Smith, and M. Turck. 1975. Cumitech 2, Laboratory diagnosis of urinary tract infections. Coordinating ed., T.L. Gavan. American Society for Microbiology, Washington, D.C.
- CLED Agar MICROBIOL Diagnostics.
Crediti immagini
- Immagine in evidenza: Flickr;
- Figura 1: MICROBIOL Diagnostics;
- 2: FC GUBKIN;
- 3: datuopinion.com;
- 4: Flickr.
Approfondimenti consigliati
Video 1 – Microbiology- CLED Agar | Dr. Mamta Jawa | Quick Learning Bites | NEET PG & FMGE | DocTutorials.
Video 2 – What is CLED Agar Media ?