La biocatalisi
La catalisi è un fenomeno chimico attraverso il quale la velocità di una reazione chimica subisce delle variazioni per l’intervento di una sostanza (o una miscela di sostanze) definita catalizzatore. Quest’ultimo non viene consumato dal procedere della reazione e non ne altera la costante di equilibrio.
L’azione del catalizzatore si esplica attraverso la riduzione dell’energia di attivazione (Ea). Si definisce “energia di attivazione” la barriera energetica che deve essere superata affinché i reagenti o substrati possano trasformarsi in prodotti (Fig. 1).
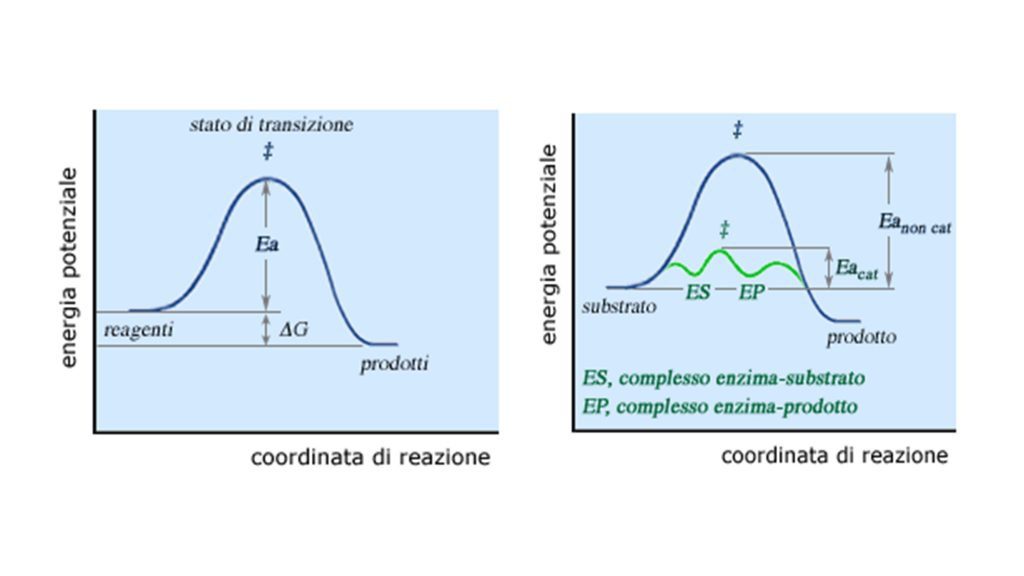
Si definisce biocatalisi la catalisi operata da un elemento biologico, rappresentato da un enzima puro o all’interno di una cellula vivente.
La biocatalisi è oggi una tecnica consolidata per la sintesi organica, sia nella ricerca scientifica sia nei processi industriali, e rappresenta una strategia cruciale in quella che viene definita “chimica sostenibile” o Green Chemistry. Infatti, alcuni enzimi di archea, batteri, funghi e animali presentano delle proprietà che possono renderli adatti all’impiego in processi industriali, quali il turnover catalitico, la stabilità termica e la resistenza ad agenti denaturanti.
I vantaggi della biocatalisi
Negli ultimi trent’anni vi è stato un significativo aumento dell’impiego di biocatalizzatori industriali per la produzione di molecole ad alto valore aggiunto. Infatti, l’applicazione di enzimi in forma purificata o inseriti in sistemi cellulari per la sintesi di molecole organiche è uno strumento ampiamente utilizzato in diversi settori industriali come quello chimico, farmaceutico, alimentare, cosmetico e tessile.
Il crescente sviluppo di approcci di biocatalisi è dovuto ai suoi due principali vantaggi, rappresentati da:
- Efficienza: piccole quantità di catalizzatore (10-3-10-4%) sono capaci di accelerare le reazioni di diversi ordini di grandezza (105-1020) rispetto a quelle non catalizzate;
- Specificità:
- di reazione: ogni enzima catalizza soltanto un unico tipo di reazione o un’unica classe di reazioni strettamente affini;
- chemo-selettività: un enzima riconosce selettivamente il proprio substrato (singolo composto o gruppo di composti);
- regio-selettività: un enzima discrimina tra gruppi funzionali simili sulla stessa molecola, reagendone con una singola tipologia o in una singola posizione;
- stereo-selettività: un enzima produce soltanto uno dei possibili enantiomeri di una molecola chirale (Fig.2);
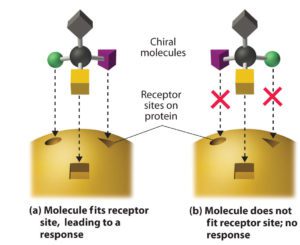
Altri vantaggi sono:
- Modulabilità: la velocità di una reazione catalizzata da un enzima può essere regolata in maniera fine e selettiva, in senso positivo o negativo, mediante l’interazione dell’enzima con attivatori o inibitori;
- Eco-compatibilità: minor impatto ambientale rispetto a catalizzatori chimici;
- Condizioni di processo blande: solitamente pH compreso tra 5 e 8 e temperatura compresa nell’intervallo 20-40 °C, pressione atmosferica;
- Compatibilità tra catalizzatori: possibilità di reazioni enzimatiche a cascata;
- Versatilità: possibilità di utilizzare gli enzimi anche in solventi non acquosi e con substrati leggermente diversi da quelli naturali.
L’immobilizzazione di biocatalizzatori: vantaggi e svantaggi
Una delle strategie di processo che ha favorito l’impiego di biocatalizzatori su scala industriale è rappresentata dalla loro immobilizzazione su supporti solidi inerti. Tuttavia, tale approccio presenta diversi e importanti vantaggi e svantaggi.
Innanzitutto, l’immobilizzazione del biocatalizzatore ne assicura un semplice e rapido recupero a fine reazione, permettendone anche un suo riutilizzo per un numero definito di reazioni. Ciò si traduce sia in una riduzione dei costi di processo sia in una maggiore purezza del prodotto di reazione. Inoltre, essa permette di implementare sequenze catalitiche mediante l’immobilizzazione di enzimi differenti lungo la superficie del supporto, i quali lavorano in maniera sinergica: il prodotto di un primo biocatalizzatore funge da substrato per un secondo e così via lungo la cascata enzimatica fino ad ottenere il prodotto finale desiderato.
Inoltre, in alcuni casi, l’immobilizzazione può determinare una maggiore stabilità dell’enzima con effetti positivi sulla sua efficienza catalitica. Infine, l’immobilizzazione consente di realizzare su scala industriale dei processi in continuo piuttosto che in batch.
Parallelamente a questi vantaggi, l’immobilizzazione di un biocatalizzatore presenta, spesso, uno o più dei seguenti limiti. Innanzitutto, essa non è applicabile a tutti gli enzimi, in quanto dipende dal grado di complessità strutturale del catalizzatore, dall’eventuale necessità di un gruppo prostetico (coenzima o cofattore) e dalla tipologia di sequenza amminoacidica primaria della proteina.
Un altro aspetto che influenza in maniera più o meno significativa l’attività di un enzima immobilizzato è rappresentato dai possibili cambiamenti conformazionali della proteina, che, spesso, possono tradursi in una minore attività catalitica.
Infine, vi sono svantaggi legati alla tipologia di supporto solido utilizzato per l’immobilizzazione. Se si tratta di un supporto non poroso, esso è caratterizzato da una minore superficie di contatto con il substrato (basso rapporto superficie/volume), mentre se esso è poroso può dare luogo a problemi di diffusione dei reagenti.
Il contributo dell’ingegneria proteica e metabolica
Ad oggi, l’applicazione della biocatalisi su scala industriale è possibile attraverso l’ottimizzazione del biocatalizzatore in funzione sia del substrato e della reazione che dovrà catalizzare, sia delle condizioni di reazione richieste dalla tecnologia industriale. La biocatalisi può inoltre essere una valida alternativa green dal momento che le condizioni di reazione sono solitamente a più basso impatto ambientale rispetto alla sintesi chimica.
L’utilizzo di biocatalizzatori, e la loro sempre maggiore diffusione, è principalmente dovuto a importanti progressi tecnologici, come l’introduzione di metodi di manipolazione del DNA come l’ingegneria metabolica e proteica. Questi approcci hanno permesso di sviluppare varianti cellulari ed enzimatiche mirate all’ottimizzazione di uno specifico processo catalitico e delle rese di reazione per il prodotto di interesse.
L’ingegneria proteica, affiancata alla possibilità di immobilizzare enzimi e cellule su opportuni supporti, ha permesso di superare il limite della stabilità degli enzimi in condizioni diverse da quelle naturali, laddove parametri, quali la temperatura e la presenza di solventi e/o reattivi e prodotti, possono provocare la denaturazione del biocatalizzatore.
Inoltre, approcci biotecnologici hanno permesso, in molti casi, il superamento delle problematiche che impedivano lo scale-up del processo di immobilizzazione di enzimi e cellule intere in impianti pilota e/o industriali.
Le tecniche di immobilizzazione di biocatalizzatori
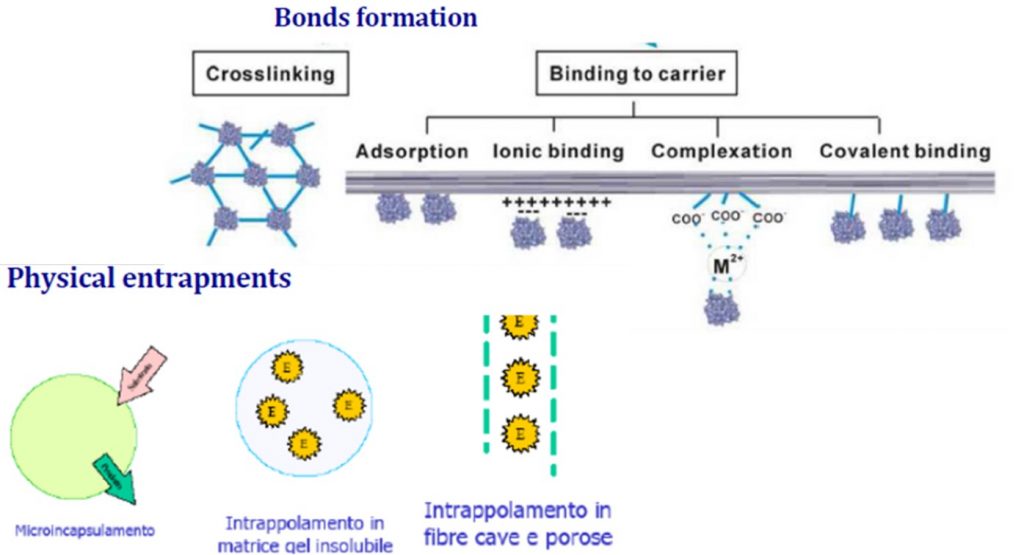
Immobilizzare un enzima o una cellula significa associarne le molecole ad un supporto solido in maniera più o meno “forte”. Questo può essere ottenuto sviluppando dei legami di tipo covalente proteina/solido e/o proteina/proteina (immobilizzazione chimica) oppure sfruttando determinate interazioni di tipo fisico (immobilizzazione fisica).
Quale che sia il principio su cui si basa una tecnica di immobilizzazione, essa non deve tradursi in una perdita significativa dell’attività catalitica. Per cui, uno dei requisiti per un buon metodo di immobilizzazione consiste nel fatto che la struttura terziaria della proteina non sia stravolta.
Le tecniche di immobilizzazione di enzimi finora sviluppate sono le seguenti (Fig. 3):
- Ancoraggio covalente su supporti solidi silanizzati insolubili in acqua;
- Adsorbimento su supporto solido;
- Ancoraggio mediante legami ionici;
- Ancoraggio mediante complessazione;
- Reticolazione con reagenti polifunzionali (cross-linking);
- Inclusione in gel polimerici o fibre cave e porose;
- Incapsulamento.
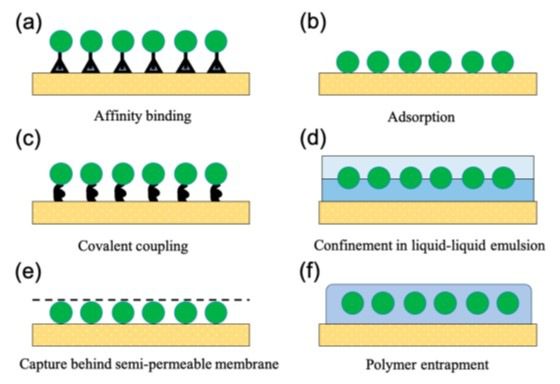
Le tecniche di immobilizzazione di cellule intere sono, invece, le seguenti (Fig. 4):
- Ancoraggio per affinità superficiale;
- Adsorbimento su supporto solido;
- Ancoraggio covalente;
- Inclusione in emulsioni liquido-liquido;
- Inclusione in membrane semi-permeabili;
- Incapsulamento.
I supporti solidi inerti su cui vengono immobilizzati enzimi e/o cellule sono solitamente inorganici. Essi sono di varia natura, tra cui vetro, ceramica porosa, acciaio inox, sabbia, carbone, composti polimerici naturali (es. chitosano) o sintetici. Inoltre, i supporti vengono dapprima silanizzati e, successivamente, gli enzimi vengono immobilizzati attraverso dei legami covalenti sfruttando i loro gruppi carbossilici o amminici (Fig. 5).
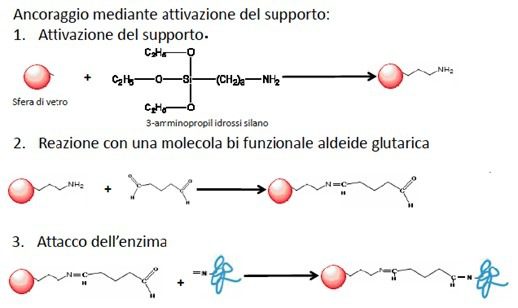
Innovativi sistemi di immobilizzazione cellulare
Studi scientifici recenti hanno sviluppato una serie di innovativi sistemi di immobilizzazione delle cellule sia in matrici bidimensionali sia in matrici tridimensionali.
Molti di questi metodi si basano sull’utilizzo di supporti solidi tridimensionali, definiti “scaffold”, costituiti da una struttura e da materiali estremamente innovativi e facilmente scalabili per applicazioni industriali.
Un esempio di materiale innovativo è il lattice, costituito da un’emulsione complessa di caucciù in acqua. Inoltre, molti supporti solidi innovativi si ispirano a strutture naturali come i biofilm batterici o i licheni (Fig. 6).
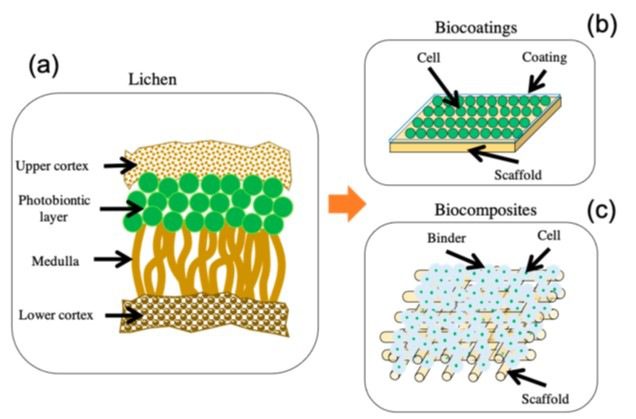
I licheni sono organismi simbionti derivanti dall’associazione di due individui: un organismo autotrofo, un cianobatterio o un’alga, e un fungo, in genere un ascomicete o un basidiomicete. Sono caratterizzati da un tallo e vengono classificati basandosi sulla tassonomia della specie fungina.
I due simbionti convivono traendo reciproco vantaggio: il fungo eterotrofo sopravvive grazie ai composti organici prodotti dalla fotosintesi del cianobatterio o dell’alga, mentre quest’ultima riceve in cambio protezione, sali minerali e acqua.
Nicola Di Fidio
Sitografia:
- Nicola Di Fidio (24 ottobre 2018, Microbiologia Italia). Processi sempre più green grazie alla biocatalisi industriale. Estrapolato da: https://www.microbiologiaitalia.it/batteriologia/processi-sempre-piu-green-grazie-alla-biocatalisi-industriale/
- Simone Rinaldi (4 aprile 2018, Microbiologia Italia). Biocatalisi: quando il Chimico ed il Microbiologo s’incontrano. Estrapolato da: https://www.microbiologiaitalia.it/batteriologia/biocatalisi-quando-il-chimico-ed-il-microbiologo-sincontrano/
- Nicola Di Fidio (8 aprile 2020, Microbiologia Italia). Biocatalisi nella sintesi organica: un utile strumento per la chimica verde. Estrapolato da: https://www.microbiologiaitalia.it/micologia/biocatalisi-nella-sintesi-organica-un-utile-strumento-per-la-chimica-verde/
- Nicola Di Fidio (7 settembre 2021, Microbiologia Italia). Biocatalizzatori per la produzione di acidi carbossilici in moderni schemi di bioraffineria. Estrapolato da: https://www.microbiologiaitalia.it/batteriologia/acidi-carbossilici/
- Nicola Di Fidio (10 febbraio 2021, Microbiologia Italia). Bioprodotti sostenibili dalla lignina: microrganismi fantastici e dove trovarli. Estrapolato da: https://www.microbiologiaitalia.it/batteriologia/bioprodotti-sostenibili-dalla-lignina-microrganismi-fantastici-e-dove-trovarli/
- Nicola Di Fidio (27 gennaio 2021, Microbiologia Italia). Dai microrganismi una classe di enzimi per il degommaggio degli oli vegetali. Estrapolato da: https://www.microbiologiaitalia.it/batteriologia/dai-microrganismi-una-classe-di-enzimi-per-il-degommaggio-degli-oli-vegetali/
Bibliografia:
- Liu, D. M., Chen, J., Shi, Y. P. (2018). Advances on methods and easy separated support materials for enzymes immobilization. TrAC Trends in Analytical Chemistry, 102, 332-342.
- Bilal, M., Zhao, Y., Rasheed, T., Iqbal, H. M. (2018). Magnetic nanoparticles as versatile carriers for enzymes immobilization: A review. International journal of biological macromolecules, 120, 2530-2544.
- Wahab, R. A., Elias, N., Abdullah, F., Ghoshal, S. K. (2020). On the taught new tricks of enzymes immobilization: An all-inclusive overview. Reactive and Functional Polymers, 152, 104613.
- Bouabidi, Z. B., El-Naas, M. H., Zhang, Z. (2019). Immobilization of microbial cells for the biotreatment of wastewater: a review. Environmental Chemistry Letters, 17(1), 241-257.
- Caldwell, G. S., In-na, P., Hart, R., Sharp, E., Stefanova, A., Pickersgill, M., Lee, J. G. (2021). Immobilising Microalgae and Cyanobacteria as Biocomposites: New Opportunities to Intensify Algae Biotechnology and Bioprocessing. Energies, 14(9), 2566.
Crediti immagini:
- Immagine in evidenza – https://doi.org/10.3390/catal9080647
- Fig. 1, Fig. 3 e Fig. 5 – Nicola Di Fidio
- Fig. 2 – https://www.microbiologiaitalia.it/batteriologia/biocatalisi-quando-il-chimico-ed-il-microbiologo-sincontrano/
- Fig. 4 e Fig. 6 – https://doi.org/10.3390/en14092566