Scoperta e caratterizzazione della Biotina
Era il 1927 quando il biochimico M.A. Boas scoprì per la prima volta l’importanza della molecola che oggi chiamiamo biotina. Pur non sapendo infatti di cosa si trattasse, si accorse che, animali che assumevano un’alimentazione ricca di albume d’uovo crudo, mostravano sintomi quali disturbi neuromuscolari, estese lesioni cutanee e caduta del pelo. Fu P. Gyorgyi ad avanzare più tardi l’ipotesi che si trattasse di un’avitaminosi (deficienza di vitamina) senza però identificare la vitamina coinvolta.
Nel 1942, un altro biochimico, si rese finalmente conto che la molecola coinvolta nella cosiddetta “malattia dell’albume d’uovo crudo” corrispondeva alla vitamina H, che era stata precedentemente isolata come fattore di crescita per il lievito. Oggi questa vitamina, identificata come vitamina B8 o biotina, sappiamo essere disattivata dall’avidina, un enzima presente nel bianco d’uovo che legandosi alla molecola la sottrae dall’assorbimento intestinale.
![igura 1 – La figura mette a paragone lo stesso ratto a distanza di mesi. A sinistra si osserva il ratto avente una dieta carente di biotina, a destra lo stesso con un adeguato apporto di biotina. [Crediti: https://www.britannica.com/science/biotin#/media/1/66228/110500]](https://www.microbiologiaitalia.it/wp-content/uploads/2021/07/Immagine2-1.jpg)
Struttura molecolare
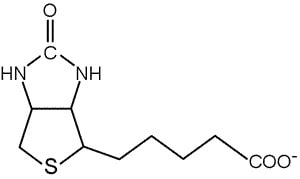
A livello strutturale possiamo pensare alla biotina come ad una molecola formata da tre componenti: un anello imidazolico, un anello tiofenico e l’acido valerianico. I due anelli a cinque termini sono fusi fra di loro a formare quella che potremmo immaginare come una casa che si specchia in un lago. L’acido valerianico invece costituisce una coda carboniosa che termina con un gruppo carbossilico.
La funzione di queste tre componenti sarà più chiara nella discussione sulla funzione biologica della biotina, ma per ora è importante sottolineare come l’acido carbossilico renda possibile il legame della molecola all’enzima. Mediante, infatti, un legame carboamidico un residuo di lisina si lega con il gruppo COO– . Il composto che ne deriva prende il nome biocitina o biotinil-lisina.
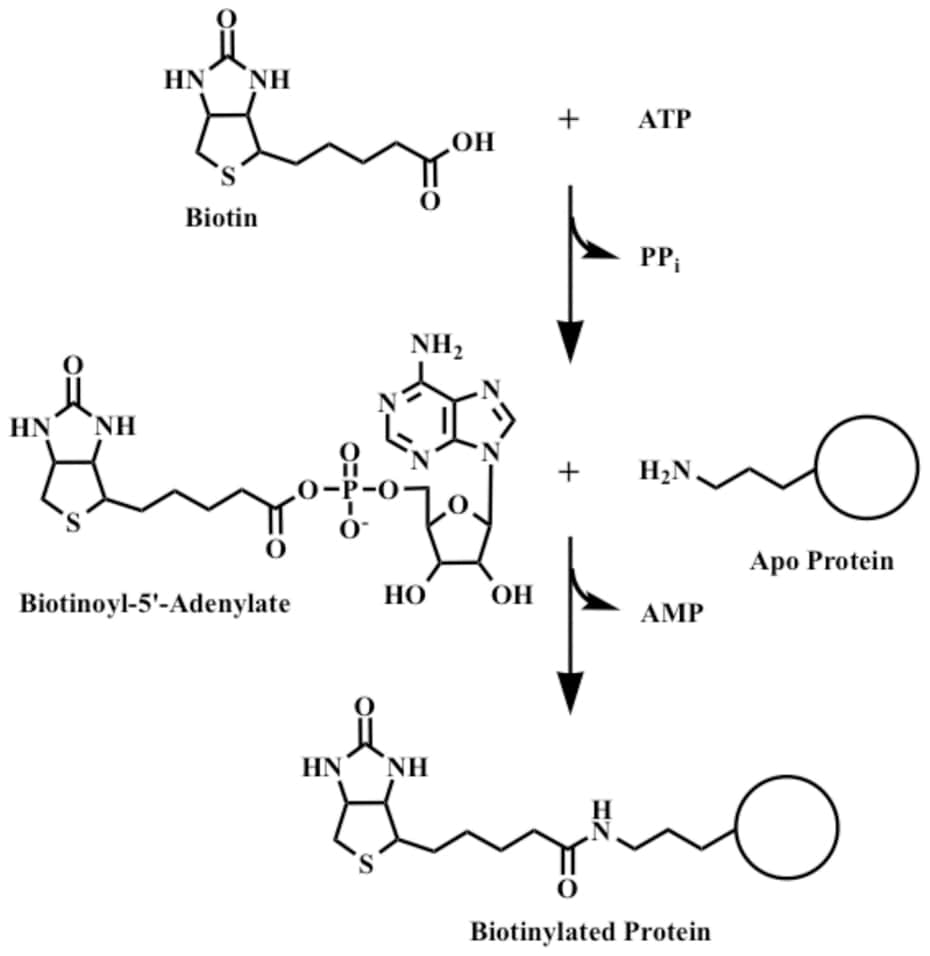
Funzioni biologiche
La biotina è il coenzima delle carbossilasi, ovvero degli enzimi che catalizzano l’aggiunta di un gruppo carbossilico mediante reazione del substrato con anidride carbonica (CO2). Tra le carbossilasi che utilizzano la biotina troviamo:
- Acetil-CoA carbossilasi
- Propionil-CoA carbossilasi
- Piruvato carbossilasi
In questo paragrafo ci concentreremo sulla funzione della piruvato carbossilasi tenendo conto che il suo meccanismo d’azione è simile in ogni enzima sopraelencato.
Piruvato carbossilasi
La piruvato carbossilasi è un enzima fondamentale della gluconeogenesi, il processo che nel nostro organismo permette la conversione di precursori non saccaridici in glucosio.
La maggior parte delle tappe della gluconeogenesi corrispondo alle reazioni inverse della glicolisi ma, alcune di esse, devono seguire percorsi alternativi al fine di rendere possibile il processo. In particolare, la prima tappa, che consiste nella formazione di fosfoenol-piruvato a partire dal piruvato, ha bisogno della piruvato carbossilasi. In assenza di tale enzima non viene formato l’intermedio ossalacetato e la gluconeogenesi non può andare avanti.

Meccanismo d’azione
Entriamo ora nel dettaglio e capiamo in che modo avviene l’aggiunta del gruppo carbossilico. Per farlo possiamo immaginare l’acido valerianico come un braccio mentre la restante parte della molecola come ad una mano. Il braccio, legato all’enzima, permette alla mano di spostarsi e di svolgere reazioni diverse in siti diversi.
La prima reazione avviene nel sito catalitico 1, dove la biotina reagisce con l’anidrite carbonica, precedentemente attivata, e forma il carbossi-biotil-enzima. Successivamente la CO2 viene trasportata nel sito catalitico 2 dove viene rilasciata per poter reagire con il piruvato.
Qualsiasi sia la molecola da carbossilare, l’atomo di carbonio interessato è sempre il carbonio attiguo al gruppo carbonilico, che in questo caso rompe il doppio legame per legarsi a un nuovo atomo di carbonio.
A questo punto, l’ossalacetato formato viene riconvertito ad un composto a tre atomi di carbonio, il fosfoenol-piruvato, che può proseguire con le restanti tappe della gluconeogenesi.

Via biosintetica
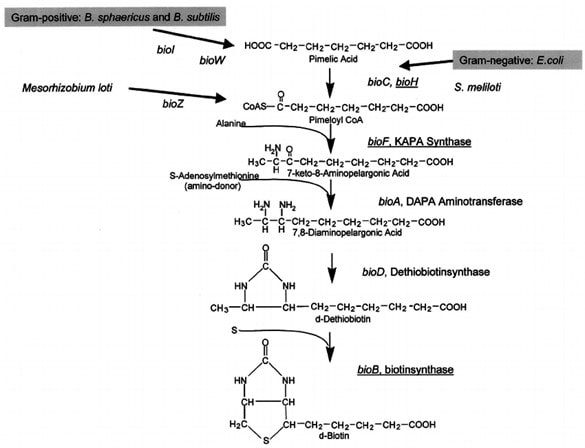
Come tutte le vitamine, la biotina non può essere sintetizzata dalle cellule del nostro organismo e richiede quindi di essere assunta con la dieta. Nonostante ciò, una carenza di biotina è comunque improbabile grazie alla presenza di microorganismi in grado di sintetizzarla indipendentemente dalla sua assunzione. Ovviamente, come spiegato nel primo paragrafo, enzimi quali l’avidina possono comunque causare una avitaminosi in quanto agiscono sia sulla biotina assunta con gli alimenti sia su quella prodotta dai microrganismi.
La figura 6 mostra i passaggi biosinteci della formazione di biotina prendendo sia in considerazione i batteri gram+ B. sphaericus e B. subtilis sia il batterio gram- E. coli. In entrambi i casi le vie convergono verso un’unica via metabolica che fa uso degli enzimi codificati dai geni che si trovano nel cosiddetto bio-operone. La regolazione di questi geni è fortemente stringente in quanto, per ogni molecola di biotina prodotta, vengono consumate 20 molecole di ATP.
Immagini


Fonti
- Principi di biochimica di Lehninger
- Principi di biochimica di Voet
- http://www.discoveriesinmedicine.com/Bar-Cod/Biotin.html
- https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4757853/
- https://www.torrinomedica.it/approfondimenti/vitamine/vitamina-b8-biotina/#P1
- https://www.sciencedirect.com/science/article/pii/S2405805X15300090
1 commento su “La biotina (B8): il cofattore delle carbossilasi”