Caratteristiche
Ustilago nuda è un fungo basidiomicete ed agente eziologico del carbone volante su orzo (loose smut). Il suo metodo di infezione rende difficile la differenziazione tra il materiale sano e quello infetto. Infatti questo patogeno fungino, come molti Ustilaginaceae, si trova all’interno del seme attaccando l’embrione e manifestando l’infezione solamente nel periodo dell’infiorescenza.
È un patogeno cosmopolita ed è uno dei principali patogeni trasmessi nei semi di Horedum vulgare sia estivi che invernali.
Questa malattia monociclica è nota ai produttori di mangimi e di malto in quanto causa perdite del raccolto e riduce la qualità della produzione.
La perdita della resa non è legata solamente al grado di infezione, ma anche alla sensibilità delle varietà e pratiche agronomiche non adeguate. Tutti questi fattori possono portare a perdite dal 5% al 30%. Questa problematica in Europa e in Nord America è tenuta sotto controllo da trattamenti con fungicidi sistemici e dalla scelta di varietà resistenti. Pratiche che non sempre possono essere svolte nei paesi in via di sviluppo, dove si registrano perdite comuni del 10%-30%. (Fig. 1)

Filogenesi
| Regno | Funghi |
| Divisione | Basidiomycota |
| Classe | Ustilaginomiceti |
| Ordine | Ustilaginales |
| Famiglia | Ustilaginaceae |
| Genere | Ustilago |
| Specie | Ustilago segetum var. nuda |
Tassonomia
Inizialmente Ustilago nuda non era differenziata da Ustilgao hordei, anche se nel 1581 Lobelius aveva applicato due nomi diversi al carbone volante dell’orzo: Ustilago polystichi e Ustilago hordei distychi. Però, non ci sono fonti certe che avesse applicato questi due nomi per differenziarle anche in base ai sintomi, dato che con “polystichi” e “distychi” (polistico e distico) potrebbe aver indicato la differenza di varietà di orzo infetta.
Il primo a fare una differenziazione è stato Jensen nel 1888, notando la differenza del carattere della massa di spore e la differenza di colore delle singole teliospore. Dapprima pensò che Ustilago nuda fosse una varietà di Ustilago hordei, e la nominò quindi Ustilago segetum var. hordei nuda. Dal nome associatogli è facile comprendere la sintomatologia, la specie della pianta ospite e il fatto che era stata ritrovata su un cereale coltivato. Infatti, segetum vuol dire “seminativo/campo coltivato”, hodei “orzo” e nuda è come si presenta la spiga dopo aver perso le spore.
Nello stesso anno Brefeld giunse alla conclusione che il carbone dell’orzo (U. nuda) e del grano (U. tritici) non era lo stesso che colpiva l’avena (U. hordei). Tale conclusione fu raggiunta studiando la differenza di germinazione delle spore in substrati artificiali.
Principali differenze tra U. nuda, U. tritici e U. hordei
La principale differenza tra Ustilago nuda e U. tritici è la specificità dell’ospite. Infatti, U. nuda colpisce l’orzo, mentre U. tritici il grano. Nel caso di U. hordei le differenze col carbone volante dell’orzo sono riconoscibili anche a livello morfologico, nonostante attacchino lo stesso ospite.
A livello di morfologia delle teliospore è stata osservata una differenza tra la lunghezza e la larghezza:
- U. tritici lunghezza 6-9 μm e larghezza 5-7 μm;
- Ustilago nuda è leggermente più piccola, con una lunghezza di 5.5-8.0 μm e larghezza 5.5-6.0 μm;
- U. hordei è più sferoidale e di conseguenza le misure sono riportate per il diametro di 5-9 μm.
Inoltre, si è notato che le teliospore di U. tritici sono echinulate, con spine più prominenti rispetto a quelle di U. nuda. L’ultrastruttura delle due specie è invece simile. Quindi, risulta abbastanza difficile differenziare le due specie in base alla morfologia delle teliospore. Se fosse necessario differenziarle è consigliato utilizzare approcci che coinvolgono il polimorfismo del DNA per la separazione delle specie.
Nel caso di U. hordei si nota una differenza sia a livello di spore lisce prive di spine, ma anche a nella sintomatologia. Le spore, marroni nerastre, sono contenute all’interno di una membrana prodotta dall’ospite, che gradualmente si rompe e rilascia le teliospore.
Genoma e metabolismo
Con lo studio sulla germinazione delle spore i ricercatori hanno scoperto che per crescere esse necessitano di glucosio, di ossigeno e di un pH tra 3 e 8 (preferibilmente 5). Inoltre, lo sviluppo delle spore dipende dalla neosintesi sia delle proteine che dell’RNA. Questa conclusione è stata dedotta dal fatto che la teliospora subisce l’inibizione da parte di cicloeximide e actionomycin D.
L’assenza di trealosio e di altri carboidrati solubili all’interno delle teliospore potrebbe essere la causa della scarsa sopravvivenza al secco. Inoltre, nelle spore è stato osservato il funzionamento simultaneo della glicolisi e della via del pentoso fosfato, ma soprattutto che la maggior parte degli enzimi erano già presenti nelle spore non germinate e non sono stati sintetizzati o attivati durante la germinazione precoce.
Un fattore interessante è l’aumento dell’attività della fruttochinasi durante la germinazione. Solitamente è un fattore limitante negli organismi, ma in questo caso sembrerebbe un fattore importante nello sviluppo delle spore.
Immagini al microscopio
Le teliospore (clamidiospore) sono di colore marrone oliva, più chiare su un lato, con forma ovoidale-globosa, spine brevi e coperte da una membrana sottile. Il diametro è di 3.6-10.0 μm (seppure il range più comune sia di 5.5-6,0 μm) e si presentano minimamente echinulate (Fig. 2).
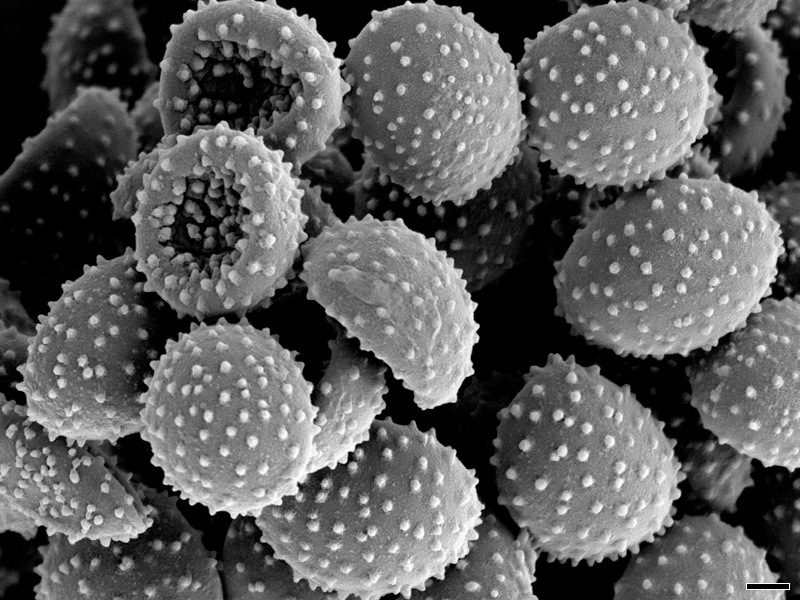
Le spore presentano una colorazione più chiara e un minore spessore su un lato. Inoltre, una parte di questa zona, ricoperta di escrescenze disposte in maniera irregolare, è priva di spine ed è il punto da cui uscirà il promicelio. Inoltre, è possibile distinguere con l’aggiunta di idrossido di potassio la due parti delle pareti della spora: l’epispora e l’endospora.
Morfologia della colonia
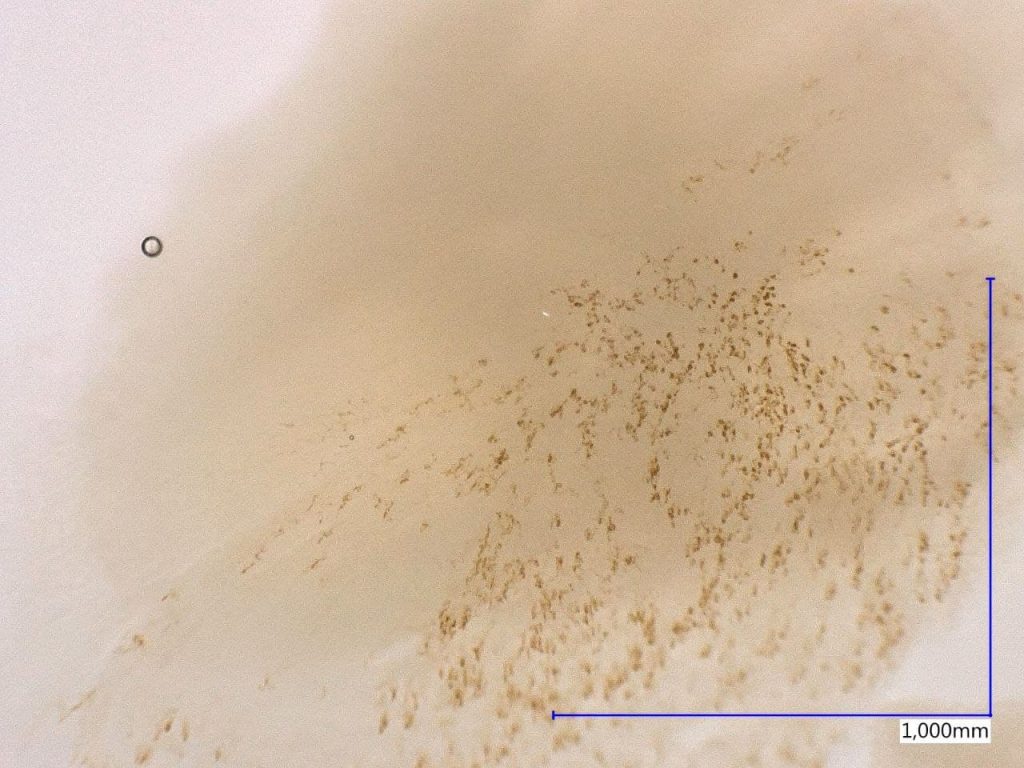
In colture con soluzione acquosa-zuccherina, alcuni ricercatori hanno osservato che il promicelio è suddiviso con tre setti ed è piuttosto stretto rispetto a quello di U. tritici e U. hordei. La spora su substrato artificiale e naturale dà origine a basidi divisi in quattro cellule. Data la poca vitalità e, di conseguenza, la difficoltà nella crescita delle spore su substrato sintetico e le lunghe tempistiche per poter osservare la colonia, viene valutata la crescita del micelio direttamente nel substrato naturale. Questo è dovuto alla natura obbligata del patogeno.
Infatti, in natura, dalla fusione delle quattro cellule basidiali si originano le ife dicariotiche che infettano l’embrione. Questa ifa può crescere sia in maniera intra che intercellulare. Con analisi al microscopio è possibile identificare il micelio all’interno dell’embrione. L’ifa ha un colore dorato scuro che si espande all’interno dell’embrione (Fig. 3).
Metodi di identificazione
L’identificazione ufficiale di Ustilago nuda, prima della sintomatologia in campo, è una procedura molto difficile.
La procedura ufficiale per la rilevazione di infezione da carbone volante è quella dell’International Rules Seed Testing che consiste nell’embryo test. É una metodologia molto complessa e tediosa. L’operatore, adoperando diversi reagenti chimici tra cui la soda caustica, deve estrarre 2000 embrioni e poi valutarli ad uno ad uno (Fig. 4). Durante il processo di estrazione è consigliato utilizzare più semi del materiale necessario per la valutazione, data la fragilità degli embrioni. Nella valutazione bisogna porre molta attenzione per identificare la presenza o meno del micelio all’interno dell’embrione. Come è ben comprensibile non è un’operazione facile e soprattutto potrebbe avere un alto errore umano se l’operatore non è esperto.
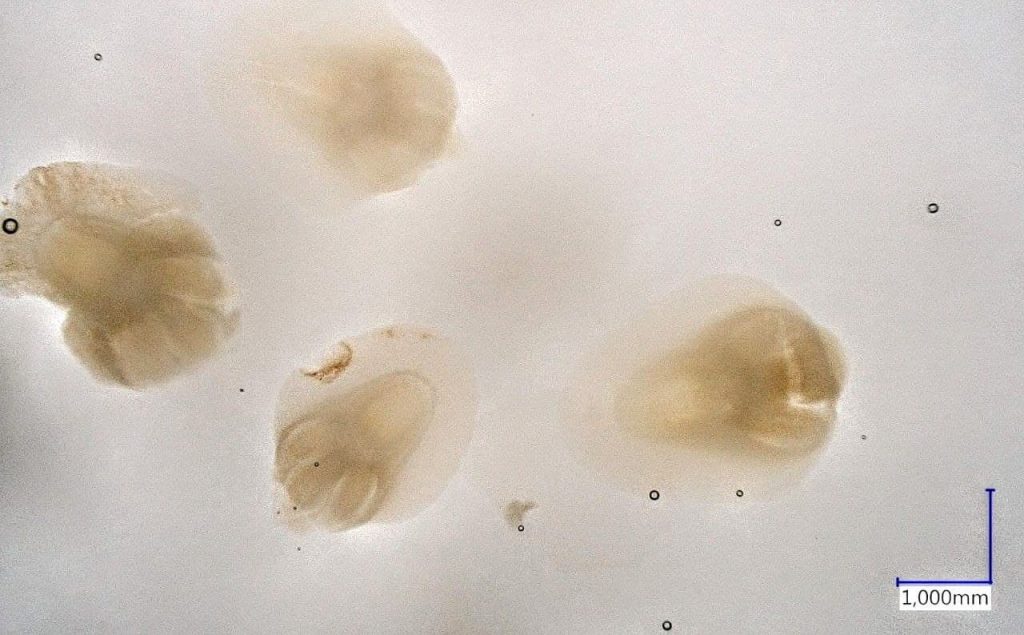
Le diverse problematiche di questo test hanno portato i ricercatori ad ottimizzarlo. Alcuni studiosi si sono concentrati sul velocizzare le tempistiche di estrazione degli embrioni. Altri invece hanno voluto concentrarsi sulla sicurezza del test sia per l’operatore sia per ottenere un risultato con un minor errore umano. Il modo per farlo sono la rilevazione su germoglio, dato che è un fungo sistemico, con qPCR ed ELISA. Ovviamente la ricerca è in costante sviluppo.
Il metodo di identificazione più utilizzato, dato che non esiste una normativa generale mondiale o Europea in cui viene imposto il controllo sulle sementi, è il riconoscimento in campo. La spiga infetta è facilmente riconoscibile: la cariosside viene completamente sostituita dalle spore, lasciando solamente il rachide con un ammasso fuligginoso di teliospore dal color bruno-olivastro scuro (Fig.5). Inoltre, le piante infette tendono ad essere più alte rispetto alle piante sane ed a spigare in maniera anticipata di due o tre giorni.

Ecologia
L’Ustilago nuda non richiede condizioni particolari, dato che il micelio è interno all’embrione. Nonostante questa affermazione sia vera in generale, è stato osservato da dei ricercatori che, se durante l’emergenza delle piantine il terreno è caldo, l’infezione sistemica è favorita rispetto ad un terreno freddo.
Però, è stato anche evidenziato che il carbone volante dell’orzo è più comune nelle zone fredde e con forti piogge, manifestandosi maggiormente negli anni che seguono primavere umide. Infatti, una primavera umida favorisce l’infezione dei semi. Il clima fresco, umido, nuvoloso e la temperatura moderata (15-22°C) prolungano il periodo di fioritura. Quindi le teliospore avranno più tempo di atterrare sui fiori ed ad avviare l’infezione. Inoltre, una pioggia intensa durante la fioritura nei campi infetti può causare un aumento dell’infezione di 10-20 volte e nel caso di cultivar sensibili anche un’umidità elevata potrebbe causare un aumento di casi. Al contrario, il calore eccessivo e/o l’aria secca riducono la germinazione e la crescita del tubo germinale all’interno del tessuto del fiore, ritardando cosi la penetrazione dell’ovario e impedendo al fungo di raggiungere il punto di crescita.
Patogenesi
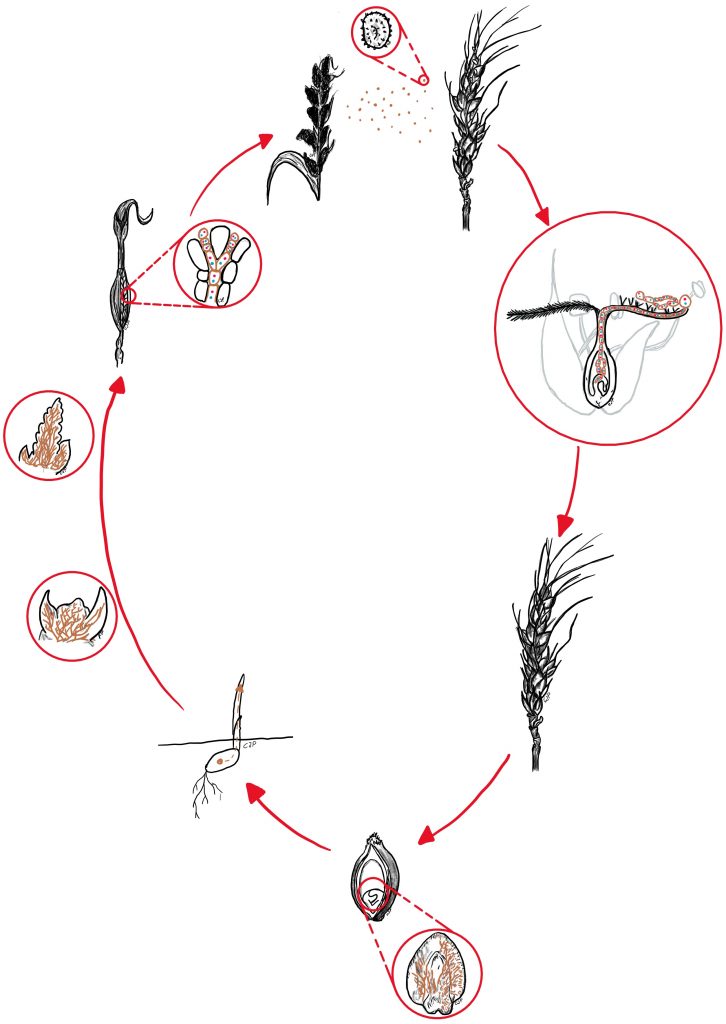
Ustilago nuda può essere descritto come un patogeno monociclico (Fig. 6) trasmesso internamente dai semi, perché cresce al loro interno in modo sistematico senza modificare lo sviluppo della cariosside.
Il processo di infezione ha inizio dopo la semina del materiale infetto. Con l’inizio della germinazione dell’orzo, il micelio rompe la dormienza ed inizia la crescita sistematica all’interno della piantina. Questo colonizza il tessuto meristematico e, solamente quando le spighe si svilupperanno, saranno visibili i sintomi dell’infezione. Infatti, il micelio si sviluppa all’interno di tutti i tessuti delle spighette, ad eccezione del rachide, e svilupperà le ife sporifere.
Quest’ultime si trasformano in sori coperti da fragili membrane del pericarpo, che si rompono facilmente, e rilasciano le teliospore. Le spore sono trasportate dal vento o dalla pioggia oppure da vettori su una pianta sana. Infatti, la teliospora arriva sullo stigma della pianta sana ed inizia a germinare. Questa emette un filamento, simile al tubo germinale di granello di polline, e penetrerà le pareti dell’ovario fino ad infettare l’embrione. In questo modo, il fungo è in grado di sopravvivere alla stagione invernale sotto forma di micelio dormiente a livello intercellulare, in particolare nello scutello.
Terapia
Come per tutte le malattie trasmesse dai semi, è consigliato di acquistare materiale certificato e controllato.
L’unica soluzione che riesce a mantenere sotto controllo l’infezione è quella di utilizzare fungicidi sistemici. Fra questi, gli unici che han mostrato efficacia e, per il momento, rari casi di resistenza sono i fungicidi a base di carboxin, triadimenol, difenoconazole/mefenoxam e tebuconazole/thiram.
Nel caso si volesse trattare il materiale in maniera biologica, momentaneamente l’unica soluzione abbastanza efficace sono i trattamenti termici. Nonostante la ricerca stia proseguendo per trovare soluzioni alternative non da molecole di sintesi, si incorre spesso nel problema che il fungo cresce all’interno dell’embrione e di conseguenza è difficile raggiungerlo senza danneggiare il seme.
Inoltre, come ogni fungo, U. nuda sta iniziando a sviluppare resistenze, in questo caso al carboxin. Tale resistenza è data da un singolo gene CBX1R, gene dominante anche se incompleto.
Questo sviluppo di resistenza ai fungicidi e la difficoltà di trovare alternative adeguate stanno spronando la ricerca ad attuare miglioramenti nella rilevazione e prevenzione del patogeno, piuttosto che nella cura.
Fonti
- Stakman, E. C. (1913). Spore germinations of cereal smuts
- Smut Fungi of Australia (daff.qld.gov.au)
- International Rules Seed Testing (7-013b)
- Method Validation Reports on proposed changes to the International Rules for Seed Testing (2012)
- Asaad S., Najjar D., Koudsueh S. (2014). Improved method for detecting Ustilago nuda in barley seed. Archives of Phytophatology and Plant Protection 47 (2)
- Wunderle J., Schaffrath U., Leclarque A., Slusarenko A. (2012). Assessment of the loose smut fungi (Ustilago nuda and U. tritici) in tissues of barley and wheat by fluorescence microscopy and real-time PCR. European Journal of Plant Pathology, 133 (4), 865-875.
- Eibel P., Wolf G. A., Koch E. (2005). Development and evaluation of an enzyme-linked immunosorbent assay (ELISA) for the detection of loose smut of barley (Ustilago nuda). European Journal of Plant Pathology, 111, 113
- Sharifnabi B., Mitter N. and Agarwal D. K. (2003). Characterization of Ustilago tritici and U. nuda on wheat and barley II RAPD analysis, Mycotaxon, Queensland Alliance for Agriculture and Food Innovation, 86, 87-97
- Van Laere A. & Fransen M. (1989). Metabolism of germinating teliospores of Ustilago nuda. Archives of Microbiology, 153, 33-37.
- Woldemichael, M. D. (2019). Importance, Biology, Epidemiology, and Management of Loose Smut (Ustilago nuda) of Barley (Hordeum vulgare): A Review. East African Journal of Sciences, 13(1), 89-108.