Premessa
In letteratura medica si trovano centinaia di studi sul rapporto tra microbiota intestinale e varie patologie date da disfunzioni di organi a funzione endocrina.
Ancora, il ruolo delle oltre milleduecento specie batteriche presenti nell’intestino sul metabolismo della tiroide è stato poco indagato.
Allo stato attuale si sa poco sul ruolo della componente microbica intestinale nel regolare la funzionalità della ghiandola tiroidea e quindi sul rapporto tra microbiota e tiroide.
Pochi Autori si sono cimentati in questo argomento ma si avanza l’ipotesi che possa esistere un asse intestino-tiroide così come esistono un asse intestino-cervello, un asse intestino-fegato, un asse intestino-cuore, un asse intestino-polmone.
In questo articolo vedremo quali siano le attuali conoscenze sui collegamenti tra microbiota intestinale e tiroide.
Tiroide, ormoni e patologie
La ghiandola tiroidea è responsabile del rilascio di due importanti ormoni, la tiroxina (T4) e la triiodotironina (T3), i quali si distinguono dagli altri ormoni circolanti per il loro contenuto in iodio.
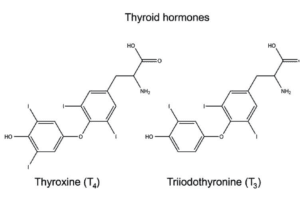
La T3 è la forma attiva dell’ormone e costituisce il 20% del prodotto totale della tiroide.
L’80% viene mantenuto nella forma T4, pronta ad essere convertita in T3 secondo le necessità dell’organismo.
La tiroidite cronica è la malattia autoimmune più frequente al mondo, causata da un processo infiammatorio che porta alla distruzione dei follicoli tiroidei che interessa dal 5 al 15% della popolazione femminile e dall’1 al 5% della popolazione maschile.
Fa parte delle cosiddette ATD (Autoimmune Thyroid Diseases) che distinguono due forme principali: il morbo di Basedow e la tiroidite cronica autoimmune (TCA).
Studi
Il collegamento tra microbiota intestinale e tiroide fu ipotizzato per la prima volta nei primi dello scorso secolo quando il ricercatore A. Lane si soffermò sugli effetti tiroidei dell’accumulo di tossine conseguente alla stipsi.
In tempi più recenti sono state dimostrate alterazioni del microbiota in corso di ipotiroidismo.
L’assorbimento dello iodio sembrerebbe legato alla composizione del microbiota: studi condotti su animali dimostrano che questo micronutriente è assorbito più lentamente a livello intestinale in presenza di un trattamento antibiotico, tuttavia, tale dato, non è risultato uniforme nei vari studi condotti.
Sembra esiste anche un rapporto fra microbiota intestinale e selenio; il selenio, assorbito principalmente nel duodeno e nel cieco, è presente a concentrazioni sensibilmente più alte nella tiroide rispetto al resto dell’organismo. Il selenio non assorbito nell’intestino tenue viene metabolizzato dai batteri residenti nel colon, e uno studio recente mostra come una dieta arricchita con selenio sia in grado di aumentare la biodiversità del microbiota intestinale.
Più dibattuta, invece, è l’influenza del microbiota sui processi metabolici legati alle iodotironine: l’affinità di questi ormoni con i batteri intestinali è stata dimostrata fin dagli anni sessanta e confermata più tardi attraverso studi su animali. Quando la barriera intestinale non funziona bene si può verificare una permeabilità che potrebbe essere alla base di numerose malattie autoimmuni.
Alcuni studi hanno messo in evidenza che le persone con problemi di tiroide hanno più facilmente un’inclinazione a soffrire di malattia celiaca (alcuni studi hanno evidenziato che il Morbo di Graves aumenta di cinque volte il rischio di soffrirne) o di sindrome da intestino irritabile (collegata con chi soffre di tiroidite di Hashimoto).
Batteri intestinali e metabolismo degli ormoni tiroidei
È proprio nell’intestino che il 20% della tiroxina (T4) viene convertita in triiodiotironina, ossia la sua forma attiva (T3), ma un ambiente intestinale alterato mette a repentaglio questo processo di conversione.
Considerando il suo potenziale enzimatico, l’intestino può essere considerato un rilevante regolatore del metabolismo tiroideo.
La presenza di enzimi deiodinasi in un organo così grande come quello intestinale fa sì che la produzione intestinale di T3 sia da non sottovalutare. Da qui le nuove forme di ormoni tiroidei rientrano nella circolazione generale contribuendo ai livelli ormonali totali.
Gli ormoni tiroidei vengono sottoposti a livello epatico alle reazioni di fase II (coniugazione con acido glucoronico ed acido solforico). Queste reazioni hanno l’effetto di accrescere la solubilità delle iodiotironine aumentandone la clearance biliare e renale e allo stesso tempo riducendone l’assorbimento intestinale.
Il T4 viene preferenzialmente glucoro-coniugato mentre il T3 viene coniugato in egual misura con acido glucoronico e con acido solforico.
Sia nei ratti che negli uomini è stato notato come i farmaci e le tossine in grado di indurre la glucuronidazione possono causare il gozzo e riducendo la concentrazione di T4, di T3 e di TSH.
Si è visto inoltre che alcuni batteri anaerobi obbligati sarebbero in grado di idrolizzare le iodiotironine solfatate e glucuronidate.
Con riferimento a questo fenomeno alcuni ricercatori parlano di una fase III di biotrasformazione: la separazione degli ormoni tiroidei dall’acido glucoronico o dall’acido solforico (o deconiugazione) che avviene a livello del canale gastroenterico, ad opera della componente microbica residente, ripristina così l’ormone attivo che anziché essere eliminato viene riassorbito e reimmesso in circolo.
Rapporto tra microbiota e tiroide
I clinici hanno da tempo riconosciuto che gli ormoni tiroidei hanno alcuni effetti sul tratto gastrointestinale.
Una ricerca del 2014 ha mostrato come le persone che soffrono di ipertiroidismo hanno in media molti meno Bifidobatteri e Lattobacilli (buoni) e molti più Enterococchi (dannosi) rispetto alle persone sane. Questo studio mostra la caratterizzazione del microbiota intestinale nell’ipertiroidismo.
Inoltre, la natura dell’ipotiroidismo è nella maggioranza dei casi di tipo autoimmune, e dato che il microbiota è coinvolto in numerose altre malattie autoimmuni, è molto probabile che la disbiosi svolga un ruolo importante anche nelle malattie della tiroide.
La disbiosi è la condizione di squilibrio tra batteri buoni e cattivi chiamata in causa per numerose patologie o loro aggravamento.
Nonostante alcuni studi evidenzino un’associazione fra la carenza di tiroxina (legata al mancato assorbimento da parte dell’organismo) e squilibri nel microbiota in soggetti celiaci o intolleranti al lattosio, non disponiamo al momento di prove conclusive a sostegno di questa tesi.
In breve l’intestino è un sito importante per la produzione di ormoni tiroidei bioattivi e la disbiosi può determinare un malfunzionamento del normale asse intestino-fegato ed una minore conversione dei precursori ormonali nella forma attiva T3; questa è una delle evidenze che suggeriscono un collegamento tra microbiota intestinale e tiroide
Alcune evidenze, inoltre, indicano come il microbiota sia in grado di provocare direttamente la deiodinazione degli stessi ormoni tiroidei come avviene fisiologicamente nel nostro corpo.
Le evidenze scientifiche hanno dimostrato che l’esposizione a molecole batteriche dette LPS, componente della parete cellulare dei batteri, durante le infezioni può contribuire ad un abbassamento dei livelli ormonali tiroidei inibendo la conversione della forma inattiva T4 nella forma attiva T3.
Quando si presenta un’infiammazione intestinale, come per esempio nella disbiosi, i villi si atrofizzano e non sono più in grado di assorbire nutrienti essenziali per l’organismo umano. Nel momento in cui l’intestino diventa più permeabile, perdendo la sua selettività, l’LPS di origine microbica può infiltrarsi nel flusso sanguigno danneggiando la tiroide.
Una delle azioni dell’ LPS è quella di diminuire uno speciale enzima, l’enzima deiodinasi, deputato alla produzione di T3 libero che va in circolo.
Questi effetti sono mediati da processi complessi non solo a livello tiroideo, dove avviene la captazione dello iodio necessario per la sintesi degli ormoni, ma anche a livello del fegato, dove avviene la conversione dell’ormone T4 in T3, e del sistema nervoso, da cui partono gli stimoli per la sintesi del TSH.
Affinché le ghiandole del nostro organismo funzionino bene, è necessario che vi sia un buon assorbimento intestinale dei nutrienti.
Infatti, elementi come lo iodio e il selenio, fondamentali per la salute della tiroide, vengono assorbiti dall’organismo tramite i villi intestinali, che sono la struttura funzionale di assorbimento che caratterizza l’intestino.
La tiroide possiede la più alta concentrazione per grammo di selenio dell’intero organismo, ma è stato stimato che ¼ dei batteri intestinali possiede i geni che codificano per le selenio-proteine (E. coli, Clostridia, Enterobacteria).
In uno studio recente, del 2016, ha messo in evidenza come il selenio non assorbito a livello del piccolo intestino viene metabolizzato a livello colico dai batteri ivi residenti (meccanismo di competizione per substrato tra ospite e ospitante). Un incremento della captazione di selenio ad opera dei batteri intestinali può influenzare negativamente la sintesi di selenio proteine da parte dell’ospite.
In questo caso la tiroide sarà esposta ad un maggiore stress ossidativo (per carenza della tioredossina reduttasi) mentre a livello periferico si avrà un deficit di conversione dell’FT4 in FT3 per carenza di deiodinasi.
La metabolizzazione degli acidi biliari prodotti nella cistifellea da parte dei batteri intestinali invece aumenta l’attività di questo enzima.
Gli acidi grassi a catena corta (SCFA), tra i principali prodotti del metabolismo microbico a livello intestinale, sono coinvolti nella formazione e nella funzione degli ormoni tiroidei, dimostrando in maniera chiara che vi sia una correlazione tra microbiota intestinale e tiroide.
Conclusioni
Se è vero che i batteri intestinali possono interferire con la captazione dello iodio e del selenio, allora la ricerca di uno stato di eubiosi riveste un ruolo chiave nel trattamento dei soggetti con patologie tiroidee.
I disturbi intestinali con un incremento della permeabilità intestinale ed infiltrazione immunitaria possono aumentare il rischio di tiroidite autoimmune.
In merito, i meccanismi ipotizzati riguardano l’attivazione dei linfociti e l’amplificazione dei processi autoimmuni a causa dello stato infiammatorio, che a sua volta è sostenuto anche dal microbiota intestinale.
Inoltre si ipotizza che in condizioni di disbiosi avvenga la modificazione delle proteine intestinali da parte degli enzimi batterici con la formazione di nuove strutture potenzialmente immunogeniche e, quindi, promotrici dell’autoimmunità. Un altro meccanismo potrebbe risiedere nella forte somiglianza tra gli antigeni esterni e quelli tiroidei, che il sistema immunitario potrebbe confondere con i primi.
Secondo i ricercatori, in definitiva, il rapporto fra microbioma intestinale e tiroide è ben lontano dall’essere compreso del tutto: se da un lato esistono numerose evidenze a sostegno di un ruolo del microbiota nel metabolismo delle iodotironine, dall’altro sono necessarie maggiori indagini per comprenderne l’influenza sull’equilibrio della tiroide nel suo complesso.
La disbiosi intestinale indotta da fattori esterni come la dieta, le infezioni o l´uso eccessivo di antibiotici porta a una risposta infiammatoria che influenza l’esito di diverse malattie autoimmuni come la malattia di Graves e la tiroidite di Hashimoto,
In conclusione, affrontare le disfunzioni della tiroide non vuol dire semplicemente concentrare l´attenzione solo sulla ghiandola, ma prendere in considerazione i numerosi fattori che ne sono alla base.
Molecole conosciute come acidi grassi a catena corta (SCFA) come il butirrato, il propionato e l´acetato di produzione microbica modulano il sistema immunitario promuovendo un’azione antinfiammatoria e modificando la composizione del microbiota che, in tal modo, influenza l’equilibrio delle cellule Treg e Th17 nell’intestino.
Quindi, alla luce di tutte le considerazioni fatte, possiamo concludere che, la modulazione del microbiota intestinale in un paziente che soffre di malattia tiroidea, potrebbe essere considerata una interessante strategia terapeutica promuovendo una risposta antinfiammatoria da parte dell´ospite.
Fonti
- Ebert E.C. “The thyroid and the gut”. J Clin Gastroenterol. 2010; 44 (6):402-6
- Lauritano C. et al. “Association between hypothyroidism and small intestinal bacterial overgrowth”. J. Clin. Endocrinol. Metab. 2007. 92, 4180–4184.
- Mori K. et al. “Does the gut microbiota trigger Hashimoto’s Thyroiditis?” Discov Med. 2012; 14 (78): 321-6.
- Virili C., Centanni M. “Does microbiota composition affect thyroid homeostasis?” Endocrine 2015; 49:583–587.
- Zhou L., Li X. “Gut Microbe Analysis Between Hyperthyroid and Healthy Individuals” Curr Microbiol. 2014; 69 (5): 675-80.
Giuseppe Chindemi