Ottimizzazione del metabolismo batterico di produzione dei terpeni mediante CRISPR-Cas9 a favore della bioeconomia
Il concetto di “microbial cell factory”
Una “cell factory” è una cellula ingegnerizzata in modo tale da riprodurre, su scala micrometrica, un processo di produzione industriale, ossia la trasformazione di una materia prima in un prodotto a più alto valore.
Grazie ai costanti avanzamenti scientifici nell’ambito dell’ingegneria genetica è sempre più “semplice” ingegnerizzare una cellula per farle acquisire delle caratteristiche che possono risultare vantaggiose per gli scopi umani.
Infatti, la biocatalisi, ossia la trasformazione di un reagente in un prodotto ad opera di una cellula intera o di enzimi isolati, è un approccio che sta prendendo sempre più piede nel settore chimico-farmaceutico in quanto moltissime molecole biologicamente attive (soprattutto quelle dotate di una complessa struttura chimica) sono impossibili da ottenere mediante sintesi chimica o, anche nel caso in cui lo fossero, il loro processo di produzione sarebbe molto costoso e/o potrebbe richiedere dei solventi/reagenti tossici per l’uomo o inquinanti per l’ambiente.
L’esempio migliore di tale concetto è la produzione dell’insulina, ad oggi implementata su scala industriale grazie ad un batterio ingegnerizzato in cui è stato inserito il gene codificante la proteina in questione. Sintetizzare chimicamente l’intera catena polipeptidica sarebbe possibile, ma il processo sarebbe troppo costoso e lungo.
Rhodobacter sphaeroides: un esempio di cell factory
Rhodobacter sphaeroides (Fig. 1) è un alpha-proteobatterio appartenente al gruppo dei batteri rossi non sulfurei, i quali sono noti per la loro capacità di crescere sia fototroficamente che eterotroficamente, sia in condizioni aerobie che anaerobie.
Inoltre, tale microrganismo è in grado di crescere su una vasta gamma di substrati, a partire da composti ad un solo atomo di carbonio, come l’anidride carbonica (CO2), fino ad arrivare agli acidi grassi (≥C16). Tali caratteristiche lo rendono un microrganismo molto duttile, idoneo per essere studiato in differenti bioprocessi.
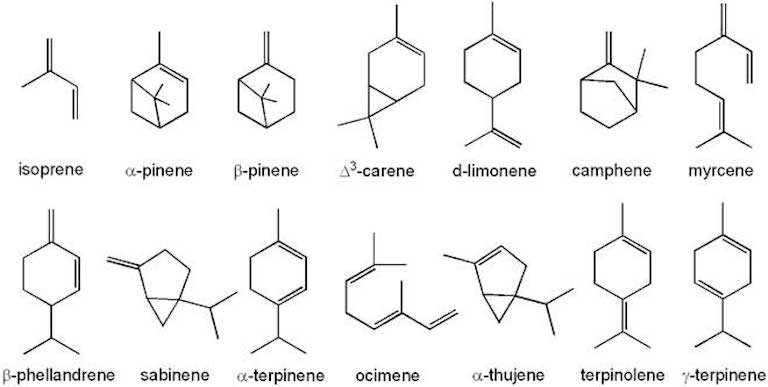
Tra questi, R. sphaeroides rappresenta un ottimo candidato al ruolo di cell factory per la biosintesi su scala industriale di terpeni (Fig. 2).
Bioeconomia, terpeni ed ingegneria metabolica
Il Dott. Enrico Orsi, giovane ricercatore italiano presso l’Università di Wageningen in Olanda, si è occupato negli ultimi anni di ottimizzare il metabolismo di questo batterio per favorire la produzione industriale di terpeni. Infatti, i terpeni sono composti importanti per la bioeconomia, ossia quel nuovo modello di economia che si propone di sostituire l’economia fossile con un’economia basata su fonti rinnovabili (Fig. 3).
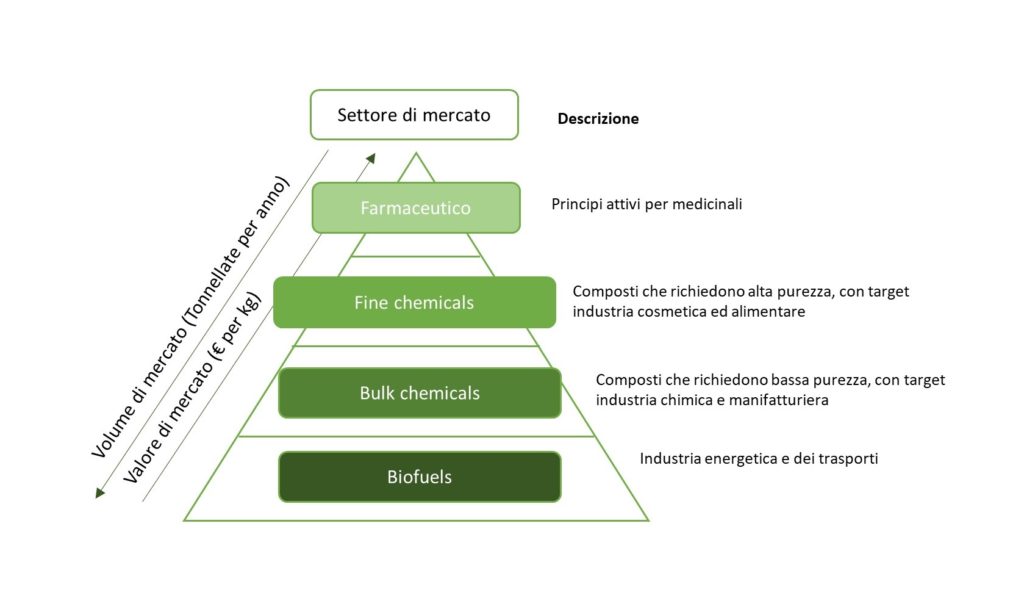
I terpeni possono essere prodotti da microrganismi in grado di utilizzare substrati rinnovabili, come ad esempio zuccheri, lipidi e acidi organici ottenuti da biomasse e CO2. Inoltre, i terpeni trovano grande applicazione in diversi settori, a partire da quello farmaceutico fino al settore bioenergetico.
Secondo il Dott. Orsi: “Considerato che i terpeni hanno tante possibili applicazioni, migliorarne la sintesi tramite l’utilizzo di cell factory ottimizzate può rendere la bioeconomia veramente competitiva con l’economia fossile”.
Inoltre, secondo il ricercatore italiano: “Attualmente, le cell factory tradizionali non sono capaci di sintetizzare quantità competitive di queste molecole. Recentemente, gli sviluppi nelle tecnologie di ingegneria genetica e delle discipline -omiche hanno aperto prospettive interessanti per lo studio di nuove cell factory. Queste nuove cell factory presentano fenotipi interessanti, ma sono generalmente poco caratterizzate. Inoltre, gli strumenti per studiarle e migliorarle geneticamente devono essere sviluppati prima di poter fare miglioramento genetico. R. sphaeroides appartiene a questo gruppo di nuove cell factory. Sebbene interessante, è stato poco caratterizzato e quindi vi è molto margine per il suo miglioramento”.
Lo studio innovativo e il suo sviluppo
Lo studio del Dott. Orsi si è basato su un concetto centrale in ingegneria metabolica e biologia sintetica, ossia quello dei cicli iterativi di “design-build-test-learn” (DBTL).
Secondo l’autore dello studio descritto in diverse pubblicazioni scientifiche: “Questi cicli rappresentano la pipeline per il miglioramento di una cell factory ed integrano conoscenze da diverse aree di ricerca, come la bioinformatica, l’ingegneria genetica, la fisiologia microbica e l’ingegneria dei processi. La somma dei contributi di queste discipline aiuta a migliorare razionalmente una cell factory.”
Lo studio scientifico ha avuto come obiettivi quelli di migliorare la tecnologia della pipeline usata per studiare e migliorare geneticamente il microrganismo, raccogliere informazioni dettagliate sulla sua fisiologia e metabolismo, ed infine usare la conoscenza generata per ingegnerizzare razionalmente le vie metaboliche del batterio R. sphaeroides.
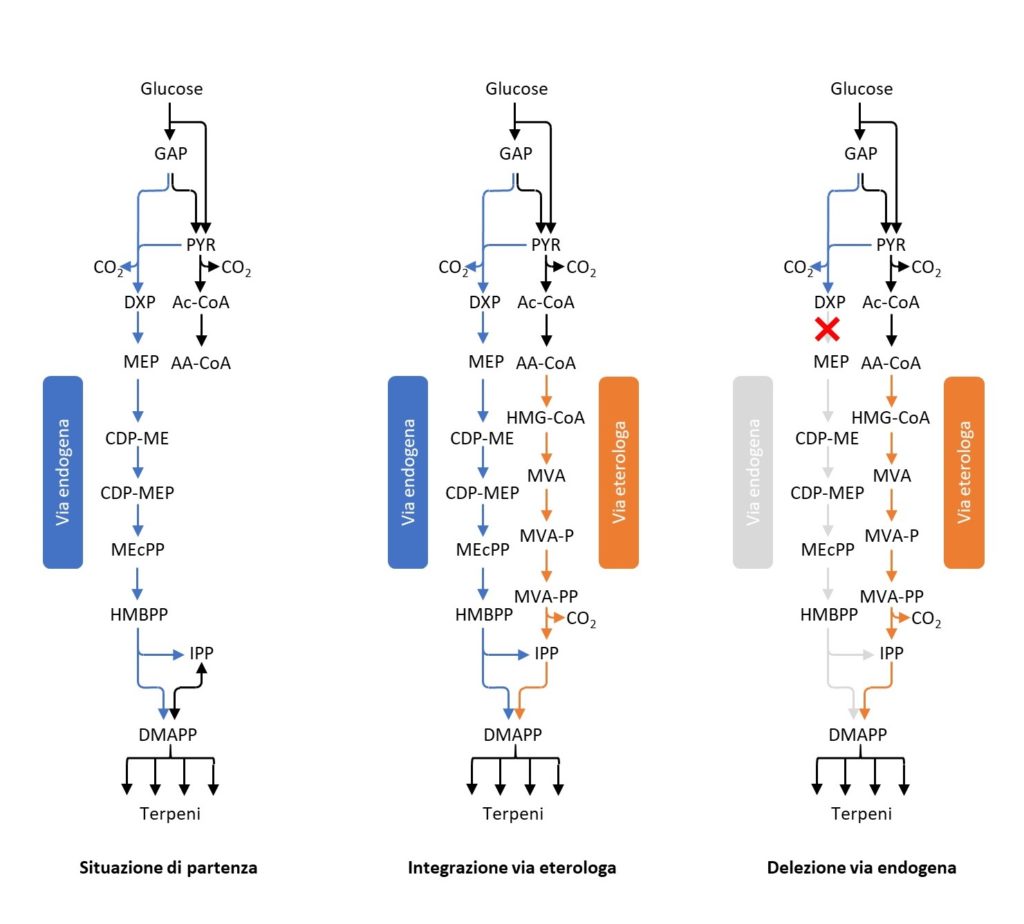
Il lavoro svolto ha permesso di sviluppare tecniche di laboratorio completamente nuove per R. sphaeroides. Le innovazioni tecnologiche principali di questo studio sono state l’implementazione di un toolkit per genome editing basato su CRISPR-Cas9 e la creazione di un metodo per misurare i flussi metabolici intracellulari (metabolic flux analysis) per lo studio dei terpeni.
Inoltre, lo studio realizzato ha permesso di approfondire la conoscenza della fisiologia di questo microrganismo, comprendendo meglio concetti di biologia di base come la regolazione delle sue vie metaboliche. Infatti, grazie a tali informazioni, successivamente, è stato possibile ingegnerizzare le vie metaboliche di R. sphaeroides ed ottenere un aumento significativo della produttività di terpeni (Fig. 4).
Uno sguardo al futuro
Nella transizione da un modello economico ad alto impatto ambientale ad un nuovo modello ecosostenibile la microbiologia e le biotecnologie svolgono un ruolo fondamentale.
Nei prossimi decenni, la varietà delle specie microbiche, dei rispettivi pathway biochimici e degli approcci di miglioramento metabolico permetteranno la produzione, su scala industriale, di energia e materiali a partire da fonti rinnovabili e in processi a basso impatto ambientale.
In conclusione, il Dott. Orsi ha affermato: “Ora la conoscenza su R. sphaeroides è un po’ più approfondita. Conosciamo meglio la sua fisiologia ed abbiamo gli strumenti per studiarlo e manipolarlo con maggiore efficienza. Abbiamo anche dimostrato che l’ingegneria metabolica su questa cell factory è promettente. Ora bisogna continuare a studiarla e sfruttare il suo metabolismo così versatile per creare nuovi processi all’interno della bioeconomia, non solo relativi ai terpeni, che possano competere seriamente con l’industria fossile“.
Nicola Di Fidio
Sitografia:
- Nicola Di Fidio (24 ottobre 2018, Microbiologia Italia). Processi sempre più green grazie alla biocatalisi industriale. Estrapolato da: https://www.microbiologiaitalia.it/batteriologia/processi-sempre-piu-green-grazie-alla-biocatalisi-industriale/
- Nicola Di Fidio (11 aprile 2018, Microbiologia Italia). Dalle raffinerie alle bioraffinerie grazie a batteri, lieviti e microalghe. Estrapolato da: https://www.microbiologiaitalia.it/batteriologia/dalle-raffinerie-alle-bioraffinerie-grazie-a-batteri-lieviti-e-microalghe/
- Dottor Pimpi (6 novembre 2018, UpBiotech). Cell factory. Estrapolato da: https://upbiotech.wordpress.com/2018/11/06/cell-factory/
Bibliografia:
- I. Mougiakos, E. Orsi, M. R. Ghiffari, A. De Maria, W. Post, B. Adiego-Perez, S. W. M. Kengen, R. A. Weusthuis, J. van der Oost, Efficient Cas9-based genome editing of Rhodobacter sphaeroides for metabolic engineering. Microb. Cell Fact. 18, 1–13 (2019).
- E. Orsi, J. Beekwilder, S. Peek, G. Eggink, S. W. M. Kengen, R. A. Weusthuis, Metabolic flux ratio analysis by parallel 13C labeling of isoprenoid biosynthesis in Rhodobacter sphaeroides. Metab. Eng. 57, 228–238 (2020).
- E. Orsi, P. L. Folch, V. T. Monje-López, B. M. Fernhout, A. Turcato, S. W. M. Kengen, G. Eggink, R. A. Weusthuis, Characterization of heterotrophic growth and sesquiterpene production by Rhodobacter sphaeroides on a defined medium. J. Ind. Microbiol. Biotechnol. 46, 1179–1190 (2019).
- E. Orsi, J. Beekwlider, D. van Gelder, A. van Houwelingen, G. Eggink, S. W. M. Kengen, R. A. Weusthuis, Functional replacement of isoprenoid biosynthetic pathways in Rhodobacter sphaeroides. Microb. Biotechnol. (2020).
Crediti immagini:
- https://upbiotech.wordpress.com/2018/11/06/cell-factory/
- https://www.terpy.it/blog/terpeni/terpeni-e-terpenoidi/
- E. Orsi, J. Beekwlider, D. van Gelder, A. van Houwelingen, G. Eggink, S. W. M. Kengen, R. A. Weusthuis, Functional replacement of isoprenoid biosynthetic pathways in Rhodobacter sphaeroides. Microb. Biotechnol. (2020).
- E. Orsi, J. Beekwilder, S. Peek, G. Eggink, S. W. M. Kengen, R. A. Weusthuis, Metabolic flux ratio analysis by parallel 13C labeling of isoprenoid biosynthesis in Rhodobacter sphaeroides. Metab. Eng. 57, 228–238 (2020).