Perché si usa?
Il batterio anaerobio Clostridioides difficile (prima Clostridium difficile) é riconosciuto globalmente come il principale responsabile della diarrea legata all’utilizzo di antibiotici, soprattutto in pazienti con alterazione del microbioma intestinale, con difese immunitarie soppresse e/o anziani, in ricovero prolungato.
Sebbene esistano metodi rapidi per l’identificazione del C. difficile, come PCR e immunocromatografia, tuttavia la coltura di isolati tossigenici è il gold standard per la diagnosi delle infezioni da C. difficile.
Lo svantaggio dei metodi classici é, peró, la durata della stessa coltura, in genere 48 ore. Per questa ragione, si é reso indispensabile sviluppare terreni di coltura che permettano di ottenere risultati nel minor tempo possibile, come il CHROMagar® C.diff (fluorogenico) o il CHROMID® agar (terreno cromogenico), che permettono di osservare le colonie in sole 24 ore.
Composizione del terreno
La composizione base del terreno si ottiene con una miscela di peptone e taurocolato, i quali incentivano la germinazione delle spore di C. difficile. Inoltre, contiene una sostanza cromogenica che permette di inibire i batteri Gram negativi e gli altri batteri Gram positivi, rendendolo un terreno selettivo e differenziale, riconoscendo facilmente le colonie di C. difficile produttrici di beta-glucosidasi.
Gli ingredienti base sono i seguenti:
- Carne di peptone (suino) 8,0 g
- Taurocholate (bovino) 1 g
- Estratto di lievito 3,5 g
- Cloruro di sodio 6,0 g
- Miscela selettiva 0,27 g
- Miscela cromogenica 0,3 g
- Agar 13,0 g
- Acqua purificata 1L
Si conserva a 2/8 °C, visto che viene giá fornito come terreno solido. É importante mantenerlo al buio, onde evitare la degradazione del reattivo cromogenico. Non é consigliato utilizzarlo se non mantenuto alle condizioni ottimali.
Risultati della crescita
Il terreno CHROMID® C. difficile può essere testato il ceppo Clostridioides difficile ATCC® BAA2155 (equivalente al ceppo CCUG 60276). In laboratorio, una volta coltivato il campione e trascorse 24 ore, dopo incubazione a 37ºC in ambiente anaerobio, si dovrebbero osservare colonie di colore grigio-nero. Si possono effettuare colture da campioni clinici diretti. É stato anche osservata una grande utilità del terreno per raccogliere campioni ambientali, dalle superfici di camere occupate da pazienti con infezione per C. difficile.
Immagini

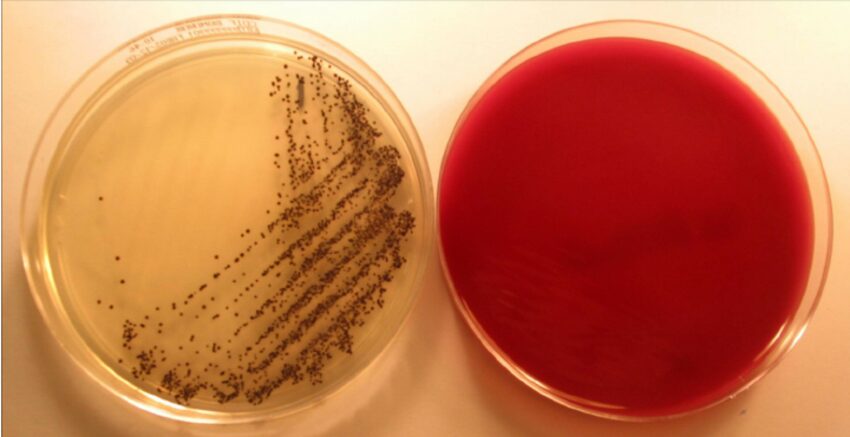
Limitazioni del terreno
Il terreno CHROMID®, nonostrante sia selettivo e si caratterizzi per buone specificitá e sensibilitá, presenta alcune limitazioni:
- Alcuni microrganismi, come C. tertium, C. clostridioforme, Bacteroides sp o Lactobacillus sp, potrebbero dare dei falsi positivi, sviluppandosi debolmente sul mezzo e producendo colonie con un colore grigio-nero.
- A causa di interferenze, le colonie prodotte su agar chromID® C. difficile non devono essere identificate con il sistema VITEK®2 ANC e caratterizate con gli E-test ATB™ indicate per agli anaerobi, in quanto si potrebbe sovrastimare globalmente la resistenza. Per tale ragione, si raccomanda di effettuare una ulteriore coltura su un terreno non selettivo.
- La crescita dipende dalle esigenze di ogni singolo microrganismo. È quindi possibile che alcuni ceppi di Clostridium difficile non possano germinare e essere identificati.
Raffaella Onori
Fonti
- Eckert, C., Burghoffer, B., Lalande, V., & Barbut, F. (2013). Evaluation of the chromogenic agar chromID C. difficile. Journal of clinical microbiology, 51(3), 1002-1
- Han, S. B., Chang, J., Shin, S. H., Park, K. G., Lee, G. D., Park, Y. G., & Park, Y. J. (2014). Performance of chromID Clostridium difficile agar compared with BBL C. difficile selective agar for detection of C. difficile in stool specimens. Annals of laboratory medicine, 34(5), 376-379.
- Hill, K. A., Collins, J., Wilson, L., Perry, J. D., & Gould, F. K. (2013). Comparison of two selective media for the recovery of Clostridium difficile from environmental surfaces. Journal of Hospital Infection, 83(2), 164-166.
- Reigadas, E., Vázquez-Cuesta, S., Onori, R., Villar-Gómara, L., Alcalá, L., Marín, M., … & Bouza, E. (2019). Clostridioides difficile contamination in the environment of a clinical microbiology laboratory and laboratory workers. Clinical Microbiology and Infection.