Obiettivo della colorazione di Gram
La colorazione di Gram permette di distinguere e classificare i batteri presenti in un campione.
In base alla diversa colorazione assunta, che dipende dalla loro permeabilità al colorante principale (il cristalvioletto, detto anche violetto di genziana), essi sono identificabili in due grandi classi: batteri gram positivi e negativi, chiamati anche gram + e gram -.
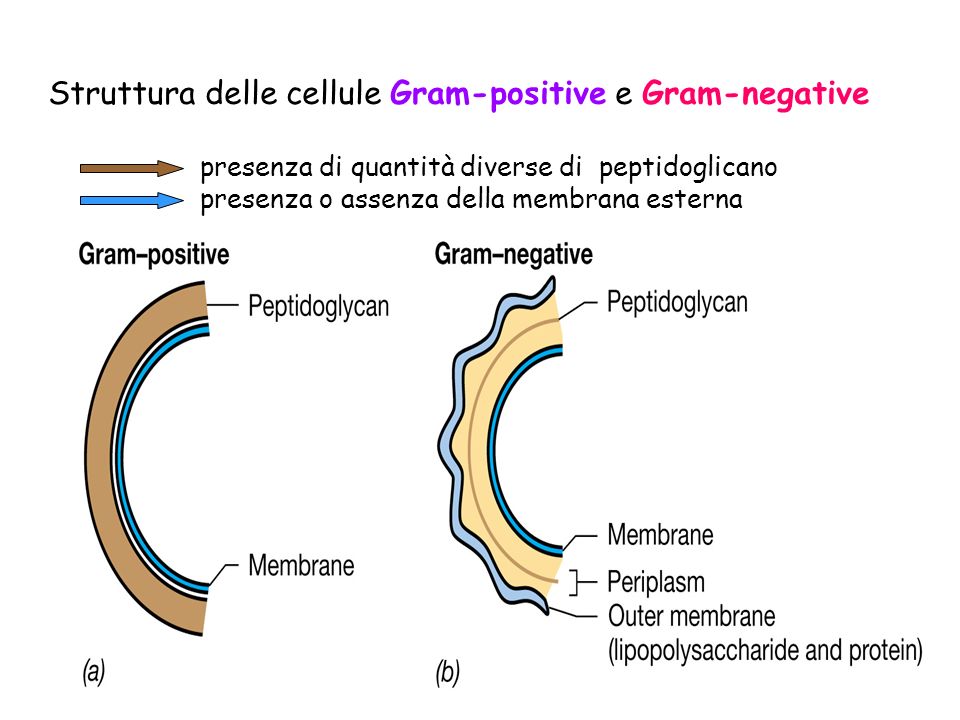
La diversa permeabilità è dovuta a ragioni morfologiche intrinseche alla struttura della parete cellulare del batterio e può dare solo due esiti: colorazione piena (“gram-positività”) o non colorazione (“gram-negatività”).
Per questo motivo, tale colorazione rientra a pieno titolo nei metodi di classificazione cosiddetti morfologici della Batteriologia.
E’ senza alcun dubbio la colorazione fondamentale per l’analisi batteriologica della microscopia ottica; nella pratica clinica ha inoltre un’alta valenza prediagnostica.
Tuttavia essa non è applicabile ad alcuni batteri, quali i bacilli acido resistenti (i Micobatteri necessitano infatti di una colorazione specifica) e risulta inoltre inefficace su funghi e lieviti.
Che cos’è e come funziona la colorazione di Gram
Questa tecnica deve il suo nome al proprio inventore, il medico danese Hans Christian Gram, che fu direttore della Clinica di Copenaghen nella seconda metà dell’Ottocento e la mise a punto nel 1884. Per approfondire al riguardo, si rimanda al seguente articolo.
E’ una colorazione cosiddetta Differenziale o di contrasto.
Si basa infatti sulla diversa reattività tintoriale che le principali specie batteriche presentano quando sono trattate con il colorante primario, di natura basica, cristalvioletto e vengono successivamente sottoposte ad un particolare mordenzante (una sostanza che aumenta il fissaggio del colore), rappresentato dal cosiddetto Reattivo di Lugol (una soluzione acquosa iodo-iodurata).
Come tutti i coloranti basici, il cristalvioletto presenta molti gruppi cationici (carichi positivamente) ed ha perciò elevata affinità con la superficie delle cellule batteriche, carica invece negativamente.
Quando il campione è trattato con il colorate primario, tutti i batteri presenti si colorano perciò indiscriminatamente.
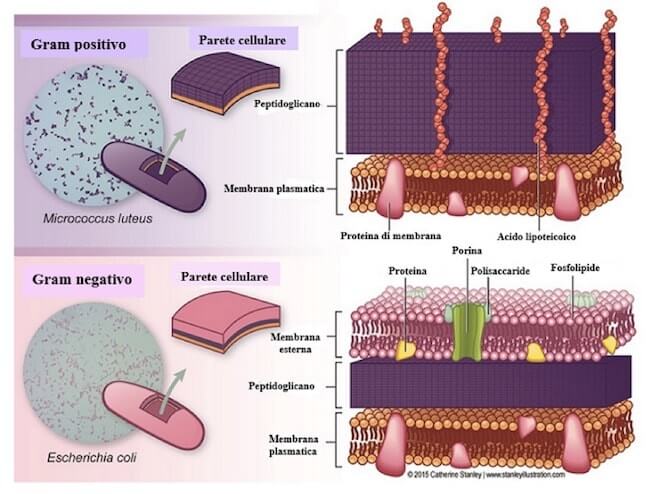
E’ per poter distinguere tra gram + e gram – che occorre il Reattivo di Lugol. Il cristalvioletto reagisce infatti con lo iodio del mordenzante, formando un grosso complesso che precipita all’interno delle trabecolature della parete cellulare. Quindi, più la parete è spessa e rigida, ricca in peptidoglicano (come accade nei gram positivi), più essa tratterrà il complesso colorante (Fig.1).
Immagine a confronto della parete nei gram+ e gram-
Il ruolo dell’agente decolorante
Particolare importanza, in questa tecnica, è rappresentata inoltre dall’agente decolorante utilizzato per il lavaggio che rimuove l’eccesso di colorante, l’etanolo (oppure l’acetone, entrambi solventi organici).
Quando si rimuove infatti l’eccesso di colorante e Lugol con etanolo, il peptidoglicano della parete si disidrata e condensa, trattenendo definitivamente il complesso che conferisce il colore.
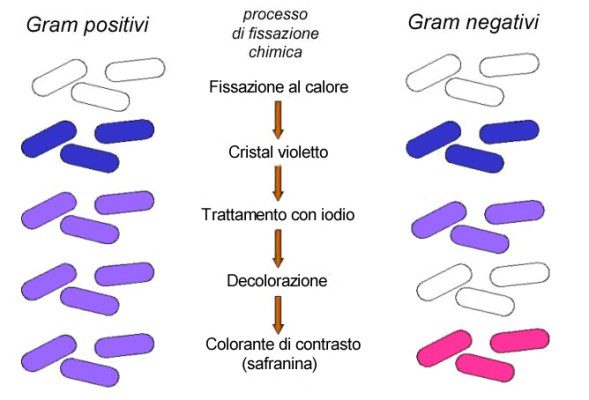
Il risultato è che i batteri “gram positivi” si colorano di una tonalità caratteristica tra il viola ed il porpora.
La parete dei batteri classificabili invece come “gram negativi”, meno ricca in peptidoglicano e con maggior presenza di composti lipidici, non è in grado di trattenere adeguatamente il complesso colorante. In particolare, quando essi vengono trattati con etanolo (che dissolve la componente lipidica più esterna della parete), rilasciano completamente il colorante e risultano alla fine incolori (Fig.2)
Per evidenziare questi ultimi, si utilizza in seguito un secondo colorante di contrasto, tipicamente la Safranina (oppure la Fucsina).
Materiale occorrente per la colorazione gram:
- un vetrino per microscopio;
- una spruzzetta contenete etanolo (oppure acetone);
- una spruzzetta contenente acqua distillata;
- cristalvioletto;
- reattivo di Lugol;
- safranina (soluzione al 2,5%) (oppure fucsina)
Colorazione di gram procedura
- depositare il campione da analizzare su un vetrino per microscopia ed effettuarne la fissazione al calore, quindi lasciar raffreddare;
- con l’ausilio di un contagocce, disporre il colorante primario cristalvioletto sul vetrino e lasciar agire per circa tre minuti;
- effettuare un lavaggio con acqua per rimuovere l’eccesso di colorante ed asciugare;
- con l’ausilio del contagocce, aggiungere il reattivo di Lugol e lasciar agire per circa due minuti;
- effettuare un lavaggio con acqua per rimuovere l’eventuale eccesso di mordenzante ed asciugare;
- effettuare il lavaggio con etanolo per decolorare; il vetrino va tenuto a circa 45 gradi per un’estremità, valutando ad occhio la scomparsa della tonalità viola purpurea del complesso colorante, quindi va asciugato;
- effettuare la posa del colorante di contrasto (Safranina) per circa tre minuti;
- effettuare un lavaggio con acqua per rimuovere l’eccesso del colorante di contrasto ed asciugare.
Alcuni protocolli di questa colorazione, propongono tempi d’esposizione ai diversi coloranti o al mordenzante differenti da quelli qui riportati: ciò e perfettamente normale.
La manualità e l’esperienza dei diversi operatori può portare infatti a suggerire delle possibili variazioni sul protocollo standard, al fine di ottimizzarlo secondo le proprie necessità.
Il vetrino cosi’ preparato (Fig.3) è ora pronto per l’osservazione al microscopio ottico.
Osservazione del vetrino
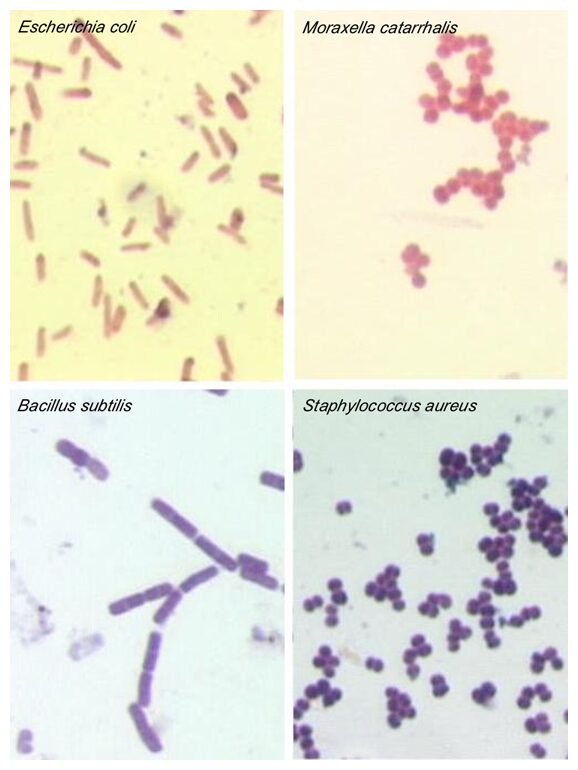
L’osservazione viene condotta al normale microscopio ottico; si consiglia di utilizzare un livello d’ingrandimento superiore al 10X (Fig.4) ed ovviamente di aumentarlo ulteriormente al bisogno.

Come già accennato, la colorazione di gram viene tutt’ora utilizzata nella normale pratica clinica, come prima fase dello screening di un campione biologico per individuare ed identificare eventuali microrganismi patogeni presenti (Fig.5).
Letture consigliate
Vi consigliamo la lettura dei seguenti testi che potete acquistare tramite i seguenti link. Conoscete queste letture? fatecelo sapere nei commenti.
- Gram Stain: Webster’s Timeline History, 1853 – 2007 (Inglese)
- Gram Stain: Looking Beyond Bacteria to Find Fungi in Gram Stained Smear: A laboratory guide for medical microbiology (Inglese)
Video sulla colorazione gram
Fonti utilizzate per l’articolo
Sitografia di approfondimento
Sulla natura chimica del colorante primario (cristalvioletto) della colorazione di Gram:
Sulla natura chimica del mordenzante di questa colorazione (Reattivo di Lugol):
A questo link è possibile trovare un’utile tabella riassuntiva della differenza tra gram positivi e gram negativi
Sitografia di riferimento
Bibliografia di riferimento
- Lansing M. Prescott, John P. Harley (ed altri). “Microbiologia”. Bologna: edizioni Zanichelli, 2005.
- Appunti del corso di:”Virologia Molecolare e Microbiologia”; corso di Laurea in Biotecnologie Farmaceutiche, Università degli Studi di Milano
Crediti per le immagini
Immagine in evidenza:
- https://www.biopills.net/colorazione-di-gram-identificare-batteri-gram-positivi-e-gr
- Figura 1: https://www.chimica-online.it/biologia/
- Figura 2: https://slideplayer.it/slide/9766770/
- Figura 3: https://unpodichimica.wordpress.com/page/23/?fbclid=IwAR37FeD54LmLrtn3MVZOrOEYs6Cui1j7ZDe-TuW0-6Pr7E-DhSRtm-EVpW8
- Figura 4: https://orbitbiotech.com/characterisation-of-microorganism-grams-staining/orbit-biotech-gram-staining-protocol-2/
- Figura 5: http://denstoredanske.dk/Natur_og_milj%C3%B8/Mikrobiologi/Bakterier_og_mikrobiologi_generelt/gramfarvning
Wikipedia è una fonte assolutamente inaffidabile, ciarlatanica e di frode, mezzo della diffusione delle menzogne della psicopropaganda politica.