Breve trattato tecnico scientifico sulle micotossine originate da funghi su prodotti alimentari
La prevenzione della contaminazione da micotossine e microbica è sempre stata una priorità assoluta nell’industria alimentare. Il rischio per il consumatore, sia esso animale o umano, dipende dalla presenza sia del patogeno biologico stesso sia del contaminante da esso derivato. In questo caso si parla di avvelenamento. Il motivo per cui questo fenomeno si verifica principalmente negli alimenti è, ovviamente, dovuto all’elevata concentrazione di nutrienti e al verificarsi di particolari condizioni ambientali favorevoli alla crescita dei microrganismi e alla formazione di contaminanti.
La gamma di microrganismi che possono presentarsi nei cibi si compone di due macro-categorie:
- microrganismi che devono presenziare negli alimenti: il sostegno dei microbi è importantissimo per la qualità di questi alimenti (fermenti lattici nello yogurt);
- microrganismi nocivi: questi microrganismi sono direttamente o indirettamente dannosi per la salute dei consumatori e la loro presenza negli alimenti è quindi strettamente regolamentata. È quindi essenziale che vengano effettuati controlli mirati sui cibi in ogni fase della produzione, dello stoccaggio, del trasporto, della distribuzione, del commercio e della somministrazione in relazione alla contaminazione da microorganismi, compresa la produzione di tossine e micotossine da essi derivate.
Come si classificano le tossinfezioni alimentari?
Per quanto riguarda la classificazione delle tossine alimentari, esse possono essere suddivise in tre categorie:
- Intossicazioni: si riferisce ai sintomi pre-assunzione derivanti dal consumo di alimenti contenenti tossine microbiche.
- Tossinfezioni: in questo caso il cibo è contaminato sia da microrganismi che da tossine.
- Infezioni: i microrganismi vivi crescono nell’intestino dell’ospite e possono produrre o meno tossine.
Quali sono i microbi che contaminano gli alimenti?
Le principali combinazioni microbiologiche presenti nella matrice alimentare comprendono batteri, virus, funghi e parassiti. I più importanti sono elencati di seguito:
- Virus: Astrovirus, Rotavirus, Epatite A.
- Batteri: Salmonella, Listeria monocytogenes, Staphilococcus aureus, Clostridium prefringens, Campylobacter, Bacillus cereus, Salmonella typhi, E. coli enteropatogeni e enterotossinogeni, Brucella spp., VTEC (E. Coli produttore di verocitotossina), Shighella sonnei, Yersinia enterocolitica, Cryptosporidium parvum, Cyclospora cayetaniensis, Vibrio spp.
- Funghi: Aspergillus, Pennicillium. Fusarium.
Quali sono le strategie di contaminazione dirette e indirette?
La prima strategia riguarda gli alimenti, che vengono contaminati da micotossine a causa della crescita di muffe e della produzione di tossine direttamente sul substrato alimentare. Tuttavia, si segnala la crescita di muffe su altri tipi di prodotti, come formaggi e salsicce, e le micotossine si possono produrre durante la stagionatura e la conservazione.
La seconda strategia invece, riguarda la contaminazione indiretta, che avviene quando le tossine delle muffe si presentano nelle parti commestibili del bestiame e/o nei prodotti di origine animale come “carry-over” della contaminazione dei mangimi. Tale contaminazione si verifica quando il bestiame viene alimentato con cibo per animali contaminato da tossine di muffa.
Consumare alimenti contaminati da micotossine cosa potrebbe causare ai sistemi biologici?
I modelli di malattia nell’uomo e negli animali esposti alle micotossine sono raggruppati sotto il termine comune di “micotossicosi“. Tuttavia, a causa dell’enorme diversità strutturale delle varie micotossine, la gamma di effetti biologici causati da queste ultime è molto ampia. La spiegazione delle interazioni tra micotossine e sistemi biologici può basarsi sugli organi e sulle funzioni che vengono alterati dall’esposizione a questi tossici.
E’ possibile determinare gli effetti tossici, sugli organi del corpo umano in presenza di basse concentrazioni di micotossine?
Pertanto, le micotossine sono classificate in base ai loro effetti su fegato, reni, sistema nervoso, gastrointestinale, ematopoietico, riproduttivo e immunitario, genotossicità, cancerogenicità ed effetti teratogeni. In realtà, sulla base delle più recenti scoperte sui meccanismi d’azione a livello cellulare e subcellulare e per basse concentrazioni di micotossine, è molto più difficile e approssimativo separare gli effetti in base ai vari sistemi coinvolti.
Il comparto dei cereali e il problema delle micotossine: una spiegazione del problema “Industriale”
La malattia è causata dal consumo di alimenti contaminati da muffe del genere: Aspergillus, Penicillium e Fusarium, nonché da Myrothecium, Memnonella, Trichoderma, Trichothecium, Cephalosporium, Verticimonosporium e Stachybotrytis.
Le micotossine causano un’intossicazione acuta del fegato, dei reni e del sistema nervoso centrale e sono cancerogene, mutagene e teratogene per l’uomo.
Quali sono gli alimenti di origine animale soggetti alla contaminazione da micotossine?
Il latte e i suoi derivati sono gli alimenti animali più frequentemente contaminati da micotossine, poiché le mucche ingeriscono queste tossine da mangimi contaminati. Sebbene le vacche possano convertire biologicamente le micotossine in prodotti meno tossici nel rumine, sono tuttavia suscettibili agli effetti nocivi delle micotossine.
Quali sono i parametri che favoriscono lo sviluppo delle micotossine?
I parametri importanti per lo sviluppo delle micotossine sono:
- umidità ambientale o acqua libera (aw): a seconda della presenza o dell’assenza di acqua, le muffe si possono dividere in tre tipi:
- igrofile: le spore germinano solo se l’aw supera 0,90;
- mesofile: le spore germinano con valori di aw compresi tra 0,80 e 0,90 e crescono in modo ottimale tra 0,95 e 1,00;
- xerofile: le spore germinano a valori di aw anche inferiori a 0,80, la crescita ottimale è intorno a 0,95.
- Temperatura: la temperatura ideale per la crescita fungina va dai 15 ai 30°C (temperatura ottimale dai 20 ai 25°C). Le ocratossine e i tricoteceni sono prodotti a +4 e a 6°C (optimum 18°C), mentre le aflatossine sono prodotte in condizioni di caldo e umidità (optimum circa 25°C). Il clima caldo e secco è ideale per i funghi produttori di fumonisina e zearalenone (la temperatura di crescita è di circa 14°C).
- pH e ossigeno: La crescita delle muffe avviene solitamente a pH che vanno da 4 a 8, ma può avvenire anche a valori di pH più estremi. Le muffe sono aerobiche e quindi tendono a crescere sulla superficie del substrato. Tuttavia, alcune specie possono crescere a una certa profondità o su substrati liquidi dove la disponibilità di ossigeno è minore.
La contaminazione degli alimenti con micotossine è legata a diversi fattori, come gli elevati sbalzi termici durante la maturazione delle piante, le forti piogge al momento del raccolto, i danni causati dagli insetti e gli errori di conservazione degli alimenti.
Funghi da campo:
l’elevata umidità e le forti differenze di temperatura tra giorno e notte favoriscono la crescita. Non si sviluppano in condizioni di anaerobiosi e a pH basso.
Funghi da stoccaggio:
La crescita di questi funghi è di solito stimolata da un pH leggermente più alto a causa della presenza di lieviti che consumano acido lattico. Lo sviluppo è ridotto dalla rivalità con i batteri anaerobi.
Come reagiscono gli animali monogastrici e i ruminanti all’ingestione di micotossine?
Infine, va notato che i monogastrici e i ruminanti reagiscono in modo diverso rispetto alle micotossine: i ruminanti sono meno esposti agli effetti delle tossine grazie all’ambiente del rumine e alla detossificazione da parte di microrganismi specifici che si trovano nel rumine. Alcuni di questi batteri utilizzano le micotossine come nutrimento per produrre energia.
Le principali micotossine, le loro proprietà chimiche e l’incidenza della contaminazione negli alimenti di origine animale e vegetale
È noto che un’ampia varietà di funghi tossigeni, tra cui Aspergillus, Penicillium, Fusarium, Alternaria, Cladosporium e Rhizopus, producono oltre 300 micotossine.
Aflatossine
Le aflatossine sono metaboliti secondari di alcune specie di Aspergillus flavus e A. parasiticus, da cui prendono il nome, questi funghi possono crescere su molti substrati vegetali tra cui cereali, semi oleosi, fichi secchi e spezie, sia nel momento della coltivazione che durante la raccolta e lo stoccaggio (periodo di post raccolta). Le aflatossine maggiormente presenti nelle matrici alimentari sono le AFB₁ e AFB₂ prodotte da Aspergillus flavus e A. parasiticus, e le aflatossine G₁ e G₂ prodotte solo da A. parasiticus.
Quando l’AFB₁ viene ingerito, i processi metabolici continuano in condizioni favorevoli a produrre una serie di metaboliti, tra cui l’aflatossina M₁ e l’aflatossicolo Q₁, AFB₂ₐ, AFP₁,AFQ₁.
Caratteristiche chimiche delle aflatossine:
Da un punto di vista chimico, le aflatossine sono formate da composti eterociclici altamente ossigenati e hanno quindi strutture strettamente correlate. Tutte le aflatossine hanno un nucleo di cumarina bis-furano cumarinico e includono un anello pentenonico o un anello lattonico a sei atomi.
Le aflatossine sono sostanze molto fluorescenti se esposte alla luce quasi ultravioletta e hanno diverso colore, blu o verde, da Blue=blu e Green=verde. Allo stato secco, l’aflatossina è altamente stabile (termostabilità fino a 250°C) al calore fino al punto di fusione (269°C per Aflatossina B1). La temperatura necessaria per la produzione delle aflatossine da parte dei funghi va dai 25 ai 32°C, con un valore di acqua libera tra lo 0,82 e 0,87. Gli alimenti contaminati da questa micotossina sono più comunemente rilevati, sono matrici oleose come le arachidi, cereali, frutta secca e spezie come i peperoncini. L’AFB₁ è genotossica e cancerogena in molte specie animali

Aflatossine nel mais
Il mais e i suoi derivati sono tra i più importanti mangimi che contengono i più alti livelli di aflatossine. L’intossicazione da aflatossine B₁ si può presentare sia nella granella di mais importata, che in quella prodotta a livello nazionale. Per quanto riguarda la contaminazione da aflatossine nell’insilato di mais, occorre considerare che il processo di fermentazione crea condizioni ambientali sfavorevoli alla crescita di miceti produttori di micotossine. Le più alte concentrazioni di aflatossine si trovano nelle aree di degradazione aerobica. In Italia, l’82% del mais coltivato viene utilizzato per l’alimentazione animale e poi c’è l’aggiunta del 3,7% di sottoprodotto dell’industria dell’amido ai mangimi.

Quali sono le ripercussioni dell’aflatossina sulla salute umana?
Le aflatossine G₁, G₂, B₁ e B₂, sono le più pericolose per la salute umana. La ricerca ha collegato l’avvelenamento da aflatossine alle mutazioni del gene p53, un importante oncosoppressore che, se mutato, priva le cellule di un’importante protezione contro il cancro.
Che cosa si è osservato nei pazienti affetti da cancro in aree ad alta esposizione all’aflatossina?
Nei pazienti affetti da cancro al fegato che vivono in aree ad alta esposizione alle aflatossine, fino al 50% dei casi presenta alcune mutazioni puntiformi in questo gene. L’ingestione di grandi quantità di aflatossina B1 può anche causare emorragie gastrointestinali e renali, come in un avvelenamento acuto (per fortuna raramente). Focolai di avvelenamento da aflatossina si sono verificati soprattutto in Africa, dove non esiste un sistema di controllo della coltivazione e dello stoccaggio dei cereali.
Quali sono le fonti di contaminazione delle micotossine?
Come hanno osservato gli esperti dell’IARC (International Agency for Research on Cancer in italiano Agenzia internazionale per la ricerca sul cancro ) nella loro recente revisione sull’argomento “Volume 100F, 2012“, la principale fonte di esposizione a queste tossine è il cibo, ma esiste anche un’esposizione professionale, soprattutto tra coloro che hanno a che fare con alimenti contaminati (come agricoltori e coltivatori). Sono inoltre particolarmente pericolose per le persone che hanno già una malattia epatica cronica.
Cosa propongono le norme internazionali sulle concentrazioni di micotossine?
Gli standard internazionali per le concentrazioni di micotossine nei mangimi non sono armonizzati e ci sono limiti rigorosi solo per l’aflatossina B₁. Tuttavia, la Food and Drug Administration Statunitense ( Agenzia per gli alimenti e i medicinali) fornisce linee guida per le concentrazioni massime ammissibili di micotossine nel mais per il bestiame. Nel caso dell’aflatossina M₁, la legislazione entrata in vigore il 1° gennaio 1999, prevede che le concentrazioni nel latte non superino 0,05 µg/kg.
La severità di questo limite è anche legata all’attribuzione del consumo di latte a una categoria di persone più esposta ai rischi tossicologici rispetto ad altre.
Come si calcola la contaminazione da micotossine nel latte?
Si sono condotti diversi studi sul modo in cui l’aflatossina B₁ presente nella dieta delle mucche viene trasferita al latte come aflatossina M₁. Il trasporto è espresso come rapporto tra la quantità di tossina escreta e la quantità di tossina ingerita, ed entrambi i valori sono espressi in mg/giorno o µg/giorno. Per la M₁, questo valore varia dall’1% al 3%. Mira ad essere crescente all’inizio della lattazione o in presenza di malattie. La formula di Veldman viene solitamente utilizzata per calcolare il valore di aflatossina M₁ prodotta in base alla quantità di aflatossina B₁ ingerita:
Aflatossina M₁ (ng/kg di latte) = 1,19 x Aflatossina B₁ (µg/d) + 1,9.
L’Ocratossina A e B
Di maggiore interesse per l’industria alimentare è l’ocratossina A. Queste sono prodotte da muffe dei generi Penicillium e Aspergillus, in particolare A. acraceus e P. viridicatum, e sono particolarmente diffuse nei climi freschi e temperati. L’OA (Ocratossina A) è la sostanza più studiata a causa della sua elevata diffusione e importanza tossicologica. Dal punto di vista chimico, l’OA consiste in un derivato della cumarina legato alla fenilalanina, mentre la forma B consiste in un omologo privo dell’atomo di cloro.
Quali sono i parametri chimici e fisici di queste micotossine?
I parametri chimici e fisici ottimali per la sua formazione variano, la temperatura va da 4 a 31°C e i valori dell’acqua libera da 0,83 a 0,90. Si trova nel caffè, nelle spezie, nei cereali, nelle arachidi, nel cacao e nei legumi ed è probabile che si manifestino se questi alimenti non vengono conservati bene. Provoca nefrite ed epatite. Nei ruminanti adulti, i segni di avvelenamento sono insignificanti data la capacità di detossificazione del rumine, ma nei vitelli con rumine non funzionante anche piccole dosi possono essere fatali. In generale, i livelli inferiori a 10.000 ppb sono considerati sicuri. L’ocratossina A viene metabolizzata nel rumine in ocratossina α.
Zea o zearalenone
È una micotossina con attività estrogenica prodotta da Fusarium graminearum, F. culmorum, F. crookwellense, F. equiseti e F. semitectum. È nota pure come micotossina RAL e F-2. Si trova nei cereali, soprattutto mais, grano, avena e orzo. I sintomi più comuni di avvelenamento nei bovini sono l’aborto, l’accorciamento del ciclo di ovulazione, la riduzione della fertilità, la vaginite, la diarrea e la crescita anomala della mammella nelle giovenche, nonché la riduzione della produzione di latte.
Come avviene il processo di contaminazione e avvelenamento della micotossina?
Ciò accade perché lo ZEA compete con l’estradiolo nel sito di legame, cioè “spiazza” l’estradiolo dal recettore specifico dell’utero. La presenza di Zearalenone nei cibi dipende fortemente dalle condizioni climatiche ed è più frequente nei climi umidi e freschi. Lo ZEA, come il DON, si può utilizzare come marcatore di mangimi contaminati. I dati disponibili suggeriscono che concentrazioni di questa micotossina superiori a 200-300 ppb nei mangimi possono essere dannose per la salute degli animali. Lo ZEA rimane stabile nello stoccaggio e durante la cottura ad alta temperatura. Si trova principalmente nel mais, ma anche in avena, orzo, grano e sorgo.
Tricoteceni
I tricoteceni sono un gruppo di molteplici metaboliti generati dalle specie Fusarium, Stachybotrys, Verticimonosporium e Cephalosporium. Queste micotossine hanno una struttura molto simile e sono caratterizzati da quattro anelli fusi contenenti gruppi alcolici, dei gruppi esteri e un gruppo epossido. Essi sono i più comuni comprendono il deossinivalenolo o vomitossina, il nivalenolo, il diacetossiscirpenolo e le tossine HT-2 e T-2. Dette micotossine si ritrovano assiduamente principalmente nei cereali.
Cosa accade quando si ingerisce cibo contaminato da questa micotossina?
I bersagli specifici di queste micotossine sono il tratto gastrointestinale; negli animali si segnalano perdita di peso, diarrea sanguinolenta, riduzione della resa, necrosi epiteliale, emorragia e morte. Per le tossine T-2 si segnala la biotrasformazione in metaboliti idrossilati non tossici e l’escrezione attraverso la bile. Per questa classe di micotossine, oltre alla tossicità gastrointestinale, sono stati segnalati anche effetti sul sistema ematopoietico.
Fumonisine, acido penicillico, Patulina, Citrina, Ergotine, Griseofulvina, Sterigmatocistina, Rubratossina, Moniliformina
Fumonisine:
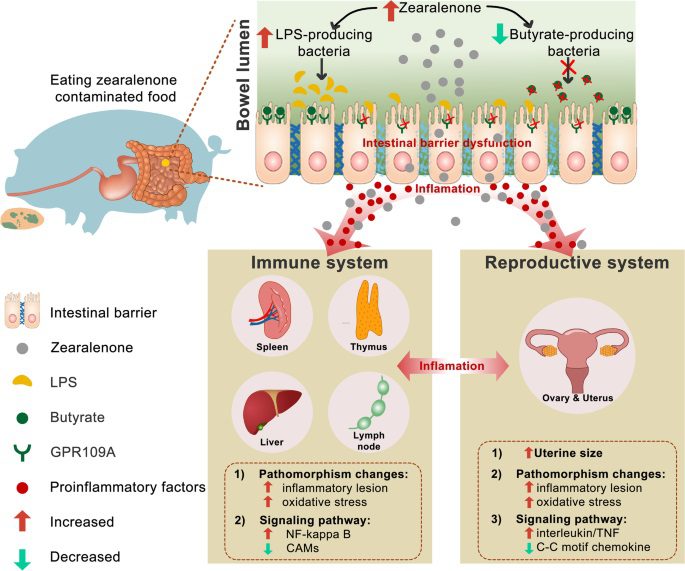
Queste tossine sono un insieme di sostanze strutturalmente correlate, create dalla specie Fusarium moniliforme. Esse sono strutturalmente simili alle basi sfingoidi libere, specialmente alla sfinganina. Le fumonisine B₁, le più studiate, si trovano comunemente in alcuni alimenti, principalmente cereali come il mais e il grano, e nei mangimi. La temperatura ottimale per la produzione di queste tossine va dai 20 ai 28°C.
La Fumonisina B₁ è un inibitore di un importante enzima del metabolismo degli sfingolipidi noto come N-aciltransferasi. La fumonisina è anche epatotossica, come indicato dall’induzione di epatopatia acuta e carcinoma epatocellulare quando questa tossina viene somministrata ai ratti.
Acido penicillico:
È prodotto da varie muffe dei generi Penicillium, Aspergillus ochraceus e meleus. Ha attività antibiotica e cancerogena, provoca rotture del DNA a singolo filamento e si trova principalmente nel tabacco, nelle salsicce e nel mais.
Patulina:
La tossina è prodotta da muffe dei generi Aspergillus, Penicillium, Byssochlamys e Paecilomyces. È instabile a pH basico, in anidride solforosa e in acqua distillata; provoca la scissione del DNA, altera il flusso di ioni attraverso la membrana cellulare e interferisce con il metabolismo dei carboidrati. Ha una elevata azione antimicrobica e può inibire lo sviluppo di oltre 75 specie di batteri. Gli effetti a lungo termine sugli animali includono immunotossicità, neurotossicità, cancerogenicità e genotossicità. Tuttavia, i suoi effetti a lungo termine nell’uomo non sono ancora stati descritti.
Citrina:
È una micotossina nefrotossica e cancerogena derivata dal benzopirano, di colore giallo intenso, generata da specie di Penicillium comunemente presenti in: cereali, grano, salsicce, riso sgranato, pane ammuffito, salsicce artigianali, caffè, cacao, avena e altri alimenti. Nel cacao e nel caffè, la caffeina è un inibitore della citrinina, quindi l’espressione non è proporzionale alla quantità di crescita microbica. La luce UV mostra una fluorescenza giallo limone a lunghezze d’onda che vanno da 315 a 400 nm.
Ergotina:
Alcaloide prodotto da Claviceps purpurea. Il fungo è un parassita dei cereali, soprattutto della segale. L’effetto della tossina è soprattutto la vasocostrizione e provoca sintomi come allucinazioni e convulsioni.
Griseofulvina:
Prodotta dal Penicillium griseofulvum. Agisce legandosi alla tubulina e inibendo i processi microtubulari come la mitosi. Viene utilizzata come agente antimicotico per la dermatomicosi.
Sterigmatocistina:
Come l’aflatossina, è prodotta principalmente da Aspergillus ridulans e A. versicolor e colpisce il fegato. Ha anche un’affinità chimico strutturale con l’aflatossina, ossia un nucleo xantonico legato alla struttura del bifurano ed è in realtà un precursore dell’aflatossina B₁. Si trova nei cereali, nei formaggi e nei chicchi di caffè.
Rubratossine:
Ne esistono due tipi, A e B. Prodotte principalmente da Penicillium rubrum e P. purpurogenum. Causa emorragie, ha effetti epatotossici, provoca degenerazione epatica e inibisce il sistema immunitario. Si trova in cereali come il mais.
Moniliformina:
Prodotta specialmente da Fusarium moniliforme, F. avenaceum, F. subglutinans, F.proliferatum e F. fujikuroi. Di solito è mortale per i polli e non sembra avere conseguenze su ulteriori animali se non in dosi molto notevoli.
Importanza del campionamento
La produzione di aflatossine è rappresentata da una definita variabilità di una serie di fattori, tra cui quelli:
- agronomici e agroclimatici;
- la competizione tra microrganismi ambientali;
- le condizioni di conservazione.
In questo senso, sono necessari almeno due elementi per garantire che la contaminazione da aflatossine sia identificata e contenuta prima che diventi una fonte alimentare per l’uomo e gli animali, cioè:
- campionare il carico in modo certo e rappresentativo;
- analizzare il campionamento in maniera certa, impiegando un metodo del quale si conosca l’incertezza di misura.
Il rapporto Istisan 1123/3117 si basa sul l’articolo 2 del Regolamento CE n. 882/2004 secondo cui, il “campionamento a fini di analisi” è definito come ” il campionamento di mangimi o alimenti o di altre sostanze necessario per la loro produzione, trasformazione, analisi, la conformità alla regolamentazione in materia di mangimi e alimenti e alla direttiva sulla salute degli animali“.
Diventa quindi necessario interpolare tra due aspetti apparentemente in competizione:
- un campione rappresentativo del lotto;
- la fattibilità del campionamento.
Un metodo innovativo per stabilire la contaminazione da micotossine nei prodotti alimentari è il “sistema Aflaflesh”
Si è sviluppata una nuova metodologia di monitoraggio automatica detta “Aflaflesh”, che serve per misurare indirettamente le aflatossine nel mais. Il sistema si è sviluppato e successivamente brevettato sulla base del rilevamento della fluorescenza emessa dall’acido kojico sulle cariossidi di mais contaminate.
A cosa serve il metodo Aflaflesh?
Il punto di partenza di questo sistema è costituito dalle proprietà uniche dell’acido kojico. Quando viene eccitato dalla luce UV, riemette luce nelle bande del rosso e del verde, che si può prontamente rilevare. Come già detto, il metodo non rileva proprio la fluorescenza trasmessa dall’aflatossina, ma quella emanata dall’acido kojico, un altro metabolita fungino.
Qual è la teoria del metodo Aflaflesh?
Osservando la produzione metabolica di Aspergillus flavus, uno dei più rilevanti microrganismi produttori di aflatossine, si è in grado di confermare che l’aflatossina e l’acido kojico sono prodotti contemporaneamente nella maggior parte dei campioni analizzati. Comunque, l’acido kojico è presente in concentrazioni tanto più alte rispetto all’aflatossina ed è quindi comodamente rilevabile.
La curva di calibrazione viene caricata nel software e consente di determinare la concentrazione in ppb di aflatossina in base al numero di pixel fluorescenti rilevati nel campione.
Quali sono i punti di forza e il funzionamento del metodo Aflaflesh?
Punti di forza del sistema Aflaflesh per la determinazione delle micotossine nel mais:
- Usando campioni da 1 kg a 5 kg rispetto ai lotti di riferimento aumenta significativamente la rappresentatività del campione.
- Ogni misurazione dura circa 10 minuti e consente di eseguire ulteriori misurazioni su più campioni di ciascun lotto in tempi adeguati alle esigenze di consorzi e mangimifici.
- Il sistema di misurazione è facile e non necessita personale qualificato o manodopera per eseguire l’analisi e l’intero processo si può allineare con le realtà e le tempistiche ideali del settore agricolo e zootecnico.
Legislazione sulla contaminazione da micotossine negli alimenti
I limiti al momento in esecuzione nell’UE sono stabiliti dal Regolamento (CE) n. 1881/2006, dal Regolamento (CE) n. 1126/2007, dal Regolamento (CE) n. 105/2010 e dal Regolamento (CE) n. 165/2010, sul principio di una valutazione del Comitato scientifico dell’alimentazione umana (SCF) o dell’Autorità europea per la sicurezza alimentare (EFSA).
- Il Regolamento (CE) n. 1881/2006 stabilisce le concentrazioni massime ammissibili di alcuni contaminanti, facendo riferimento alle matrici alimentari più probabilmente contaminate. Questi includono le più comuni tossine di muffa, in particolare le aflatossine B₁, B₂, G₁ e G₂, l’ocratossina A, la patulina, il deossinivalenolo, lo zearalenone, la fumonisina B₁ e B₂.
- Il Regolamento 1126/2007 modifica e integra parzialmente il precedente regolamento stabilendo le tolleranze massime per alcune tossine prodotte da funghi del genere Fusarium nei cereali e nei prodotti derivati.
- Il Regolamento 105/2010 aggiunge un limite per l’ocratossina A in alcune spezie e prodotti a base di liquirizia e specifica che la fissazione di valori massimi ammissibili per questa tossina di muffa nel cacao e nei prodotti a base di cacao, nei prodotti a base di carne e nella frutta secca, ad eccezione dell’uva, non è necessaria per la protezione della salute pubblica.
- Il Regolamento 165/2010 sostituisce il Regolamento 1881/2006 sui valori limite massimi di aflatossina.
Esempio pratico di latte contaminato dalla micotossina: aflatossina M₁
Questo esempio pratico prende in considerazione la contaminazione dalla micotossina AFM₁ nel latte di vacche da latte alimentate con mangimi o foraggi contaminati da aflatossina B₁.
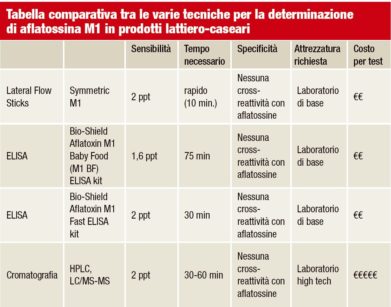
Il Regolamento CE 1881/2006 stabilisce un limite massimo di 50 ng/kg (ppt) per la contaminazione da aflatossina M₁ nel latte utilizzato dagli esseri umani.
Sulla base di questa normativa e della possibile conversione dell’AFB₁ ingerito in AFM₁ nel latte crudo, un’assunzione media che va da 30 a 40 g/vacca/giorno potrebbe generare latte con un tenore superiore a 50 ppt e questo latte non è commercializzabile.
Trasformazione dell’AFB1 del mangime all’AFM1 nel latte:
- Aflatossina M₁ (ng/kg di latte crudo) = 1,19 x assunzione di Aflatossina B₁ (µg/vacca/giorno) + 1,9
- Mais proveniente da aziende agricole conformi alla legge: 20 µg/kg
- Produzione aggiuntiva di mangime utilizzando il 30% di questo mais a 20 x 0,30 = 6 µg/kg AB₁ nel mangime
- Ogni vacca da latte in produzione è alimentata con 8 kg di questo mangime al giorno.
- L’assunzione giornaliera di AFB₁ da parte di una vacca da latte è 6 x 8 = 48 µg/kg/vacca/giorno
- Si applica la formula di conversione:
Aflatossina M₁ (ng/kg di latte) = 1,19 x assunzione di Aflatossina B₁ (µg/vacca/giorno) + 1,9
Aflatossina M₁ (ng/kg di latte) = 1,19 x 48 + 1,19 = 59,02 ng/kg
Questo valore è superiore al valore consentito: 50 ng/kg
L’uso di un mangime conforme alla normativa ma al limite, supera il limite legale nel latte.
Conclusioni
Non tutte le muffe sono pericolose per la salute o per il cancro. I rischi cancerogeni sono particolarmente associati al cancro al fegato e sono principalmente legati alla presenza e all’esposizione a una tossina specifica – l’aflatossina – prodotta da alcune specie di funghi Aspergillus. Il rischio di esposizione all’aflatossina può essere ridotto in modo significativo grazie alle norme di legge delle autorità preposte alla sicurezza alimentare e alla cura nella conservazione degli alimenti fatti in casa.
Fonti
- https://www.airc.it/cancro/informazioni-tumori/corretta-informazione/aflatossine-muffe-alimenti
- https://www.aslal.it/allegati/Presentazione_MICOTOSSINE_ALLEVATORI.pdf
- Giorgio Rusconi, Giacomo Bonelli, Gabriele Casartelli, et al., Diritto alimentare, Ipsoa, ISBN: 8821761444, 3/03/2017, Italia.
- Alice Capuano, Giovanni Dugo, Patrizia Restani, TOSSICOLOGIA DEGLI ALIMENTI, UTET, ISBN: 8802054754, 15/12/2006, Italia.
- Paolo Cabras, Carlo I. G. Tuberoso, ANALISI DEI PRODOTTI ALIMENTARI, Piccin Nuova Libraria S.P.A. Padova, ISBN: 9788829923113, 14/09/2013, Italia.
Crediti immagini
- Immagine in evidenza: https://www.ruminantia.it/come-e-meglio-utilizzare-i-catturanti-per-le-micotossine-opinioni-a-confronto/
- Figura 1: https://www.rivistadiagraria.org/articoli/anno-2019/rischio-tossicologico-micotossine-negli-animali-nelluomo/?print=print
- Figura 2: http://www.assomais.it/cambiamento_climatico_aflatossine/
- Figura 3: https://microbiomejournal.biomedcentral.com/articles/10.1186/s40168-022-01397-7
- Figura 4: https://vetjournal.it/images/archive/pdf_riviste/3755.pdf
- Figura 5: https://www.lattenews.it/determinazione-dellaflatossina-m1-nei-prodotti-lattiero-caseari/